Лейцин — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 июня 2017; проверки требуют 18 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 июня 2017; проверки требуют 18 правок.| Лейцин | |||
|---|---|---|---|
| |||
| Сокращения | Лей, Leu, L | ||
| Хим. формула | HO2CCH(NH2)CH2CH(CH3)2 | ||
| Рац. формула | C6H13NO2 | ||
| Молярная масса | 131,18 г/моль | ||
| Рег. номер CAS | 61-90-5 | ||
| PubChem | 6106 | ||
| Рег. номер EINECS | 200-522-0 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 15603 | ||
| ChemSpider | 5880 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
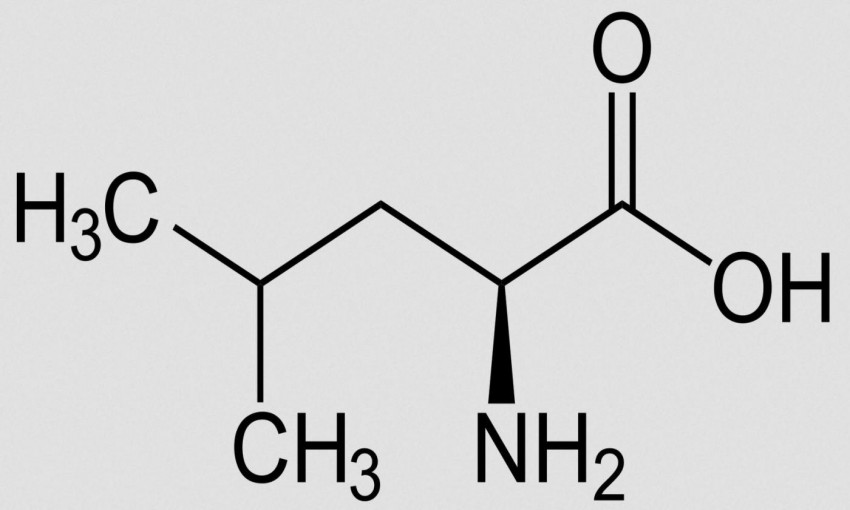
Лейцин (сокр. Leu или L; 2-амино-4-метилпентановая кислота; от греч. leukos — «белый») — алифатическая аминокислота с химической формулой HO2CCH(NH2)CH2CH(CH3)2. Имеет в своей структуре один хиральный центр и может существовать в виде D- или L-оптических изомера, а также в виде рацемата (смеси равных количеств D- и L-изомера). В живых организмах встречается в виде L-изомера. При повышении уровня эстрона в организме способствует его уменьшению.
Бесцветный порошок с температурой плавления 293°C (чистый D- или L-изомеры) и 332°C (D,L рацемат). Ограниченно растворим в воде, плохо в этаноле, хорошо в растворах щелочей и кислот, не растворим в диэтиловом эфире. pKa(COOH)=2.36, pKa(NH3+)=9.6. Изоэлектрическая точка pI=6.04. Удельное вращение [α]D L-лейцина в воде при 25°С составляет -14.4
Впервые выделен из мышечного волокна и шерсти в 1820 году А. Браконно. Впервые синтезирован взаимодействием 2-бром-4-метилпентановой кислоты с аммиаком в 1904 году Э.Фишером.
Незаменимая аминокислота, то есть она в организме человека, как и в организмах животных, не синтезируется. Лейцин синтезируется растениями и микроорганизмами из пировиноградной кислоты. Его кодоны: UUA, UUG, CUU, CUC, CUA и CUG. Лейцин входит в состав природных белков, применяется для лечения болезней печени, анемий и других заболеваний. В среднем суточная потребность организма в лейцине для здорового человека составляет 4-6 грамм. Входит в состав многих БАД. L-лейцин — пищевая добавка E641 классифицируется как усилитель вкуса.
Лейцин [LifeBio.wiki]
Молекула Лейцина
Фармакологическая группа: Аминокислоты; незаменимые аминокислоты
Лейцин (сокращенно Leu или L) – альфа-аминокислота с разветвленной цепью с химической формулой HO2CCH (NH2) CH 2 CH (CH 3)
Краткая информация
Лейцин является одной из трех аминокислот с разветвленной цепью. Иногда ее называют «главной» аминокислотой, поскольку она обладает самым популярным полезным свойством АРЦ – способствует наращиванию мышечной массы. Лейцин является активатором белка, известного как «мишень рапамицина в клетках» (МРК), который затем индуцирует синтез мышечного белка с помощью киназы рибосомного белка S6; две другие АРЦ могут также активировать МРК, но значительно слабее, чем лейцин, таким образом, 5 г лейцина будут иметь больший эффект, чем 5 г смеси АРЦ. Метаболит лейцина, гидроксиметилбутират моногидрат, также слабее индуцирует синтез мышечного белка, чем лейцин, но, несмотря на это, лучше предохраняет от потери безжировую (сухую) мышечную массу. Лейцин не сильно отличается от двух других АРЦ – изолейцина и валина. Две другие АРЦ, изолейцин и валин, требуют более подробного изучения. В исследованиях лейцин в основном оценивают по синтезу мышечного белка, когда дополнительное количество лейцина добавляют к обычному или тестовому рациону. Исследования тестового рациона показали, что лейцин значительно увеличивает синтез белка. Несмотря на то, что это, возможно, приводит к образованию более сухой массы в течение некоторого периода времени, лейцин также демонстрирует эффективность в увеличении мышечной массы у людей с низким потреблением белка и у пожилых людей (у которых, как правило, нарушен синтез мышечного белка в результате лечебной диеты). Воздействие лейцина на глюкозу до конца не выяснено. Лейцин обладает свойством снижать уровень сахара в крови (может выделять инсулин из поджелудочной железы, а также непосредственно стимулировать поглощение глюкозы клеткой без инсулина), но также имеет и противоположные свойства (ингибирует стимулируемое инсулином усвоение глюкозы, с помощью стимуляции киназы рибосомного белка S6). В культуре клеток лейцин стимулирует поглощение глюкозы до 45 минут. В живых системах воздействие небольших доз лейцина незначительно (по предварительным данным, лейцин обладает реабилитационными свойствами при сахарном диабете). Изолейцин является более мощным гипогликемическим препаратом, но с меньшим ингибированием собственного воздействия. Другие названия: L-лейцин Не путать с: АРЦ, лейциновая кислота (метаболит) Чем примечателен:
Лейцин не является стимулирующим препаратом
Порошок лейцина имеет горьковатый вкус, который можно ослабить посредством снижения температуры или добавления кислого ароматизатора.
Является:
Хорошо сочетается с
Не сочетается с:
- ароматическими аминокислотами (триптофан и L-тирозин)
Лейцин: инструкция по применению 2,000-5,000 мг лейцина принимают кратковременно натощак, либо во время приёма пищи с изначально низким содержанием белка (или источников белка с низким содержанием лейцина).
Биосинтез
Так как лейцин – незаменимая аминокислота, она не может быть синтезирована в организме животных. Следовательно, она должна поступать в организм, как правило, в качестве компонента белков. У растений и микроорганизмов лейцин синтезируется из пировиноградной кислоты с помощью ряда ферментов:
Ацетолактатсинтазы\\ Ацетогидроксикислотной изомероредуктазы\\ Дигидроксиацидной дегидратазы\\ Альфа- изопропилмалатной синтазы\\ Альфа-изопропилмалатной изомеразы\\ Лейциновой аминотрансферазы\\
Синтез небольшой гидрофобной аминокислоты валина также включает в себя начальную часть этого пути.
Биология
Лейцин перерабатывается в печени, в жировой и мышечной ткани. В жировой и мышечной ткани лейцин участвует в формировании стеринов, и в общем в этих двух тканях стерин задействован в семь раз больше, чем в печени. Лейцин является единственной диетической [[аминокислоты|аминокислотой]], способной стимулировать синтез белка (протеина). В качестве пищевой добавки лейцин способен замедлять деградацию мышечной ткани за счет увеличения синтеза мышечных белков у старых крыс. Хотя ранее лейцин включали в состав спортивных добавок, сейчас его применяют в качестве катализатора для роста мышц и для их страховки от повреждений. Компании, ранее выпускающие на рынок добавки для спортивного питания, рекомендовали «идеальное» соотношение лейцина, изолейцина и валина, равное 2:1:1. Однако в дальнейшем появились доказательства того, что лейцин является наиболее важной для наращивания мышечной массы аминокислотой, и с этих пор его популярность в качестве основного ингредиента биологически активных добавок существенно возросла. Лейцин мощно активирует рапамицин киназу у млекопитающих, которая, в свою очередь, регулирует рост клеток. После инфузии лейцина в головной мозг крыс благодаря активации пути МТор (мишени рапамицина в клетках) у них снижалось потребление пищи и вес тела. Токсичность Лейцина, заметная при валинолейцинурии, вызывает бред и неврологические нарушения и может быть опасна для жизни. В генах дрожжей, мутанты с дефектным геном, отвечающим за синтез лейцина (leu2), трансформируются плазмидой, содержащей рабочий ген синтеза лейцина (LEU2) и выращиваются на минимальной среде. Синтез лейцина является полезным селективным маркером.
В каких продуктах содержится лейцин
К пищевым источникам лейцина относятся (г/100 г):
Концентрат соевого белка 4,917
Соевые бобы, зрелые семена, сырые 2,97
Говядина, 1,76
Арахис 1,672
Салями, итальянская, свинина 1,63
Рыба, лосось, розовая, сырая 1,62
Зародыши пшеницы 1,571
Миндаль 1,488
Курица, бройлеры или цыплята, бедра, только мясо, сырые 1,48
Куриное яйцо, желток, сырой, свежий 1,40
Овес 1,284
Фасоль, бобы Пинто, приготовленные 0,765
Чечевица, приготовленная 0,654
Нут, приготовленный 0,631
Кукуруза, желтая 0,348
Молоко коровье, цельное, 3,25% молочного жира 0,27
Рис, коричневый, среднезерновой, приготовленный 0,191
Молоко человеческое 0.10
Химические свойства
Лейцин является аминокислотой с разветвленной цепью, поскольку имеет алифатическую боковую цепь, которая не является линейной. Для того, чтобы лучше понять происхождение биомолекулярной асимметрии, рацемический лейцин подвергался циркулярно поляризованному синхротронному излучению. Наблюдалось энантиомерное повышение на 2,6%, что указывает на возможное фотохимическое происхождение биомолекулярной гомохиральности.
Источники и структура
Источники
Лейцин (также известный как 2-амино-4-метилпентановая кислота) – важная аминокислота класса АРЦ (наряду с изолейцином и валином). Из этих трех аминокислот, лейцин является наиболее мощным активатором белка, известного как «мишень рапамицина в клетках» (его активация может положительно влиять на синтез протеина). Также лейцин — это исключительно кетогенная аминокислота 2), которая является катализатором кетоновых тел после процесса диссимиляции, тогда как валин – глюкогенная (катализатор глюкозы) аминокислота. Изолейцин, в свою очередь, имеет свойства обеих аминокислот. Лейцин иногда называют главной АРЦ. Это наиболее мощный стимулятор синтеза мышечного белка на молекулярном уровне, и также является кетогенным веществом (производит кетоны в процессе метаболизма).
Метаболизм
Лейцин обратимо метаболизируется в организме в первую очередь с помощью фермента аминотрансферазы разветвленной цепи (АТРЦ) в промежуточный продукт, известный как альфа-кетоизокапроат (КИК). КИК может метаболизироваться в несколько промежуточных продуктов, например, в β-гидроксиизовалерат (с помощью митохондриального фермента диоксигеназы КИК [3]), в изовалерил кофермент А (через дегидрогеназу альфа-кетокислот с разветвленной цепью (РЦKДГ), либо в гидроксиметилбутират моногидрат ( с помощью цитозольного фермента диоксигеназы КИК 3)). Последний этап метаболизма в гидроксиметилбутират моногидрат составляет примерно 5% потребляемого лейцина 4) и является единственным источником гидроксиметилбутират моногидрата в организме. Первый этап, который преобразовывает альфа-кетоизокапроат (КИК), в β- гидроксиизовалерат, также может трансформировать КИК в метаболит, известный как альфа-гидроксикапроновая кислота (лейциновая кислота или HICA). Лейцин метаболизируется в один из нескольких метаболитов, которые способствуют эффективному воздействию лейцина. Двое из них являются самостоятельными добавками (HMB (гидроксиметилбутират моногидрат) и HICA).
Фармакология
Механизм действия
Основной механизм действия лейцина – это активация мишени рапамицина (TOR), которая упоминается как «мишень рапамицина в клетках млекопитающих» (в частности, лейцин активизирует mTORC1, — одну из подгрупп комплекса 5)). Первый внутриклеточный мультимолекулярный сигнальный комплекс (mTORC1) состоит из нескольких белков: сам TOR, наряду с raptor (англ. regulatory-associated protein of TOR), белка GβL и PRAS40 (англ. proline-rich PKB/AKT substrate 40 kDa) 6). Этот комплекс активируется добавкой лейцина. Второй комплекс, содержащий такие белки, как rictor (англ. rapamycin-insensitive companion of TOR), protor (англ. protein observed with rictor), GβL, и белок, известный как mSin1 — от англ. mammalian stress-activated protein kinase (SAPK)-interacting protein 1, не активируется лейцином. TOR или mTOR — это белковый комплекс, который играет ключевую роль в регулировании клеточной связи. Лейцин способен активировать один из двух комплексов, в составе которых состоит, известного как mTORC1 (c1 понимают как «первый комплекс»). Сокращение «mTORC1» используется при упоминании mTOR, если не указано иное. Несмотря на то, что связь с помощью инсулинового рецептора может стимулировать mTOR (через 1 класс фосфоинозитол-3-киназы (PI3K) и серин-треониновой протеинкиназы Akt / РКВ, которые активируют Rheb (от англ. Ras homolog enriched in brain) и mTOR [8]), mTOR из лейцина возникает из-за белка, официально известного как белок вакуоли человека сортировки 34 (hVPS34), но иногда неофициально его называют PI3K класса 3 7). Деплеция hVPS34, как известно, снижает лейцин-индуцированную активацию mTOR, не препятствуя инсулин-индуцированной активации протеинкиназы В. Инкубация клетки с помощью лейцина активирует mTOR без активации протеинкиназы В 8), и это воздействие идентично общему увеличению содержания внутриклеточного кальция 9). Интересно, что лейцин, видимо, индуцирует активность mTOR посредством увеличения внутриклеточного кальция, так как увеличение кальция и связывание кальмодулина (белка, участвующего в гомеостазе кальция) с hVPS34 принципиально важно для лейцин-индуцированной активации mTOR. 10) Белок SHP-2 (тирозин фосфатазы) имеет решающее значение для синтеза мышечного белка 11) и, как известно, ограничивает рост мышц в периоды питательной депривации [18]. Он подает сигнал киназе рибосомного белка S6 (S6K1) посредством мобилизации внутриклеточного кальция в наивысшей точке фосфолипазы C гамма-4 и работает с помощью белка Rheb, который стимулирует mTOR. Белки Rheb, как известно, являются положительными модуляторами функций mTOR. 12) Лейцин и/или его метаболиты увеличивают внутриклеточный кальций, что похоже на мышечные сокращения. Увеличение кальция, в свою очередь, активирует белки типа mTOR, которые затем индуцируют синтез протеина в мышцах. В отличие от мышечных сокращений, данный процесс происходит во всех клетках и не только в скелетных мышцах. Другими словами, процесс происходит таким образом: SHP-2 (в настоящее время – самый дальний белок в цепи) → мобилизация кальция → связывание hVPS34 с кальмодулином → активация mTORC1 (возможно, с помощью Rheb) → активация S6K1 → синтез мышечного белка
Гипераминоацидемия
«Гипераминоацидемия» — это термин, используемый для обозначения избытка (гипер) аминокислот в крови (-emia), аналогично этому гиперлейцинемия означает избыток лейцина. Исследования показали, что у пожилых людей лейцин увеличивает синтез мышечного белка независимо от гипераминоацидемии, учитывая тот факт, что она сама по себе является независимым фактором синтеза мышечного белка. 13)
Продолжительность жизни
Сиртуин
Белок сиртуин (от англ. Silent Information Regulator Transcript (SIRT) – это NAD+ зависимые ферменты, чувствительные к клеточному коэффициенту NAD + / NADH и, таким образом, к энергетическому статусу клетки. 14) Из них SIRT1 является гистондеацетилазой, которая может изменять сигнализацию ядерных белков p53 (транскрипционный фактор, регулирующий клеточный цикл), NF-kB (ядерный фактор «каппа-би») и FOXO (транскрипционный факторы семейства forkhead box класса О) 15) и может вызвать митохондриальный фактор биогенеза PGC-1α. 16) Считается, что активация SIRT1 (чаще всего ресвератрол) положительно влияет на продолжительность жизни. Исследования на крысах показали, что лейцин обусловливает полезные свойства молочных белков, и это положительно сказывается на продолжительности жизни, укреплении здоровья и снижает риск преждевременной смерти 17). Результаты данных сыворотки крови пациентов, которые потребляли большое количество молочных продуктов, показали, что такая диета повышает активность SIRT1 на 13% (жировая ткань) и 43% (мышечная ткань). Оба метаболита лейцина (альфа-кетоизокапроновая кислота и гидроксиметилбутират моногидрат (HMB) являются активаторами SIRT1 в диапазоне 30-100%, что сравнимо с эффективностью ресвератрола (2-10мкM), но требует более высокой концентрации (0,5 мМ). Было отмечено, что митохондриальный биогенез и инкубация лейцина происходит в жировых и мышечных клетках, а разрушение SIRT1 уменьшает (но не устраняет) лейцин-индуцированный митохондриальный биогенез. Метаболиты лейцина способны стимулировать активность SIRT1, и этот механизм лежит в основе митохондриального биогенеза. Данный механизм имеет умеренную силу действия.
Взаимодействие с метаболизмом глюкозы
Усвоение глюкозы
Лейцин может способствовать активации инсулин-индуцированной протеинкиназы В (Akt), но для того чтобы сначала ослабить и ингибировать ее, необходима фосфоинозитол-3-киназа PI3K. Только так лейцин сохраняет инсулин-индуцированную активацию Akt). 18) Так как лейцин также стимулирует секрецию инсулина из поджелудочной железы (инсулин затем активирует PI3K), в сущности это не имеет практического значения. В условиях, когда инсулин отсутствует, 2 мМ лейцина и (в меньшей степени) его метаболит α-Кетоизокапроат, видимо, способствуют поглощению глюкозы через PI3K / aPKC (атипичная протеинкиназа С 19)) и независимо от mTOR (блокирование MTOR не влияет на производимый эффект). В этом исследовании стимуляция составляет лишь 2-2.5мМ для 15-45 минут (сопротивление вырабатывается при 60 мин) и по силе сопоставима с физиологическими концентрациями базального инсулина, но на 50% меньшей силой (100 нМ инсулина). Этот механизм действия аналогичен механизму действия изолейцина и имеет похожую силу. Тем не менее, лейцин также может помешать клеточному всасыванию глюкозы, что, как полагают, связано с активацией передачи сигнала mTOR, который подавляет сигнализацию АМФ-зависимой киназы (AMPK) 20) (сигнализация AMPK опосредует поглощение глюкозы в периоды низкой клеточной энергии и физических упражнений 21)) и действует вместе с сигнализацией mTOR, влияющей на киназу рибосомного белка S6 (S6K). Передача сигнала с помощью MTOR / S6K вызывает деградацию IRS-1 (первый белок, который несет «сигнал» инсулин-индуцированного эффекта), посредством активации протеасомной деградации IRS-1 или непосредственным связыванием с IRS-1. Это формирует негативную замкнутую систему управления с обратной связью сигнализации инсулина. 22) Минимизирование негативных последствий для IRS-1 способствует лейцин-индуцированному всасыванию глюкозы, и эта отрицательная обратная связь объясняет, почему глюкоза всасывается в течение 45-60 минут, а затем внезапно ингибируется. Так как изолейцин не так сильно влияет на активацию mTOR и, таким образом, это путь отрицательной обратной связи, именно изолейцин обеспечивает существенное всасывание глюкозы в мышечных клетках. Изначально лейцин способствует поглощению глюкозы в мышечных клетках в течение приблизительно 45 минут, а затем процесс резко прекращается, что несколько снижает общий эффект. Это внезапное прекращение является отрицательной обратной связью, что обычно происходит после активации MTOR. Изолейцин лучше, чем лейцин, содействует поглощению глюкозы из-за меньшей активации mTOR.
Секреция инсулина
Лейцин способен индуцировать секрецию инсулина из поджелудочной железы с помощью своего метаболита КИК. Это выделение инсулина подавляется другими АРЦ и двумя подобными аминокислотами: норвалином и норлейцином. Лейцин участвует в индукции секреции инсулина либо как добавка, либо в комбинации с глюкозой (например, при приеме лейцина и глюкозы соответственно наблюдается увеличение на 170% и на 240%, а при приеме комбинации наблюдается увеличение до 450%). Несмотря на сопоставимый потенциал лейцина и йохимбина, они не сочетаются из-за их параллельных механизмов действия. 23) Лейцин, как известно, стимулируют секрецию инсулина из поджелудочной железы и поэтому является самой сильной АРЦ. На эквимолярной основе (такой же концентрации молекулы внутри клетки), лейцин имеет примерно такую же силу, как йохимбин, и две трети потенциала глюкозы. Лейцин является положительным аллостерическим регулятором глутаматдегидрогеназы (GDH), 24) – фермента, который может преобразовать некоторые аминокислоты в кетоглутарат (α-кетоглутарат). Это увеличивает клеточную концентрацию АТФ (по отношению к АДФ). Увеличение уровня концентрации АТФ вызывает увеличение секреции инсулина посредством механизмов, которые не зависят от активации mTOR. 25) Метаболит KIC может подавлять KATФ каналы и вызывать колебания кальция 26) в панкреатических бета-клетках. Выделение кальция может также воздействовать на mTOR (стандартная цель лейцина), а активация mTOR может подавлять экспрессию α2A рецепторов. Так как α2A рецепторы подавляют секрецию инсулина при активации 27), а избыточная экспрессия индуцирует диабет, 28) меньшая экспрессия этих рецепторов вызывает относительное увеличение секреции инсулина. Такой путь, вероятно, наиболее важный с практической точки зрения, так как mTOR антагонист рапамицина может отменить лейцин-индуцированную секрецию инсулина и подавить саму секрецию инсулина. 29) Чтобы стимулировать секрецию инсулина из панкреатических бета-клеток, лейцин работает двумя путями, основным из которых является уменьшение влияния негативного регулятора (2а-рецепторов). Снижение влияния отрицательного регулятора вызывает не поддающееся лечению увеличение активности.
Лейцин в бодибилдинге
Синтез белка
Основной механизм действия лейцина – это стимуляция активности mTOR 30), а затем – стимуляция активности киназы p70S6 через PDK1 31). Киназа p70S6 затем положительно регулирует синтез протеина. Кроме того, лейцин способен индуцировать активность эукариотического фактора инициации (eIF, в частности, eIF4E) и подавляет его ингибирующий связывающий белок (4E-BP1), который повышает трансляцию белка 32), что было подтверждено после перорального приема лейцина. Модуляция eIF, таким образом, усиливает синтез белка мышц, вызванный киназой p70S6. Активация mTOR – это общеизвестный анаболический путь, действие которого связанно с выполнением физических упражнений (активация с 1-2 часовой задержкой по времени), 33) инсулином 34) и избытком калорий. 35) Как и другие АРЦ, но в отличие от инсулина, лейцин не стимулирует активность протеинкиназы В (Akt / РКВ), которая происходит между рецептором инсулина и mTOR, (Akt и протеинкиназа B / PKB являются взаимозаменяемыми терминами). 36) Akt способен усиливать eIF2B, что также положительно способствует синтезу белка в мышцах, вызванному киназой p70S6 и, судя по недостаточной активации Akt с помощью лейцина, является теоретически не такой сильной, как если бы сигнализация Akt активировалась так же, как инсулин. Активация mTOR с помощью лейцина в организме человека была подтверждена после перорального приема добавок, а также активации киназы p70S6K. Исследования активации Akt не смогли выявить каких-либо изменений в функциональности человеческих мышц, и это подразумевает, что высвобождение инсулина из поджелудочной железы, вызванное лейцином (данный процесс происходит в организме человека 37), а активация Akt происходит с помощью инсулина), не могут быть актуальны. Лейцин способен стимулировать активность mTOR и его последующую сигнализацию синтеза белка. Хотя Akt / PKB положительно влияет на активность mTOR (поэтому, когда активирована Akt, она активизирует mTOR), лейцин может воздействовать другим путем и активизирует mTOR, не влияя на Akt. Несмотря на это, все, что активизирует mTOR, будет также влиять на киназу p70S6, а затем и на синтез белка в мышцах. Этот анаболический эффект лейцина имеет большее влияние на скелетные мышцы, чем на ткань печени 38); физические упражнения (мышечные сокращения) дополняют его полезное воздействие. Согласно некоторым исследованиям, прием лейцина перед тренировкой является более эффективным, чем прием в другое время (для резкого увеличения синтеза белка). 39) Лейцин – наиболее сильная из всех аминокислот в стимулировании синтеза мышечного белка.
Атрофия / Катаболизм
Лейцин, как известно, способствуют синтезу белка мышц при низких концентрациях в лабораторных условиях, при приеме в более высоких концентрациях лейцин может ослабить атрофию мышц, даже несмотря на остановку скорости синтеза. Этот эффект сохраняется в мышцах и был отмечен при болезнях, оказывающих негативное влияние на мышцы, таких как рак, а также сепсис, ожоги и травмы. В этих случаях преимущества приема зависят от дозы.40)
Гипераминоацидемия
Гипераминоацидемия – это термин, используемый для обозначения избытка (гипер) аминокислот в крови (-emia), аналогично этому, гиперлейцинемия означает избыток лейцина. Исследования показали, что у пожилых людей лейцин увеличивает синтез мышечного белка независимо от гипераминоацидемии.
Саркопения
Саркопения характеризуется снижением содержания белка и увеличением содержания жира в скелетных мышцах, которое происходит с возрастом. Одной из причин возникновения саркопении является уменьшение метаболической реакции на сохранение мышечного эффекта L-лейцина, что возникает с клеточным старением. Негативное воздействие этого эффекта можно минимизировать путем добавления L-лейцина к продуктам, содержащим белок. 41)
Взаимодействие с питательными веществами
Карбогидрат (углевод)
Когда рецептор инсулина активирован, он может активировать mTOR косвенно через Akt. 42) В то время как Akt положительно влияет на синтез белка, вызванный киназой S6K1 (которая активируется во время активации mTOR), добавка лейцина напрямую не влияет на активацию Akt, как это делает инсулин в лабораторных условиях. Было отмечено, что инфузия лейцина у людей существенно не влияет на активацию Akt в скелетных мышцах, т.е., секреция инсулина, индуцированная лейцином, недостаточна для стимулирования Akt. Лейцин взаимодействует с усвоенной глюкозой и снижает уровень глюкозы в крови и затем влияет на секрецию инсулина из поджелудочной железы. 43) Интересно, что лейцин не сочетается с йохимбином в индукции секреции инсулина из-за параллельных механизмов действия. Лейцин взаимодействует с пищевыми углеводами и влияет на активность секреции инсулина из поджелудочной железы, а также взаимодействует с инсулином, что влияет на синтез мышечного белка.
Ресвератрол
Ресвератрол – фенольное вещество, которое, как известно, взаимодействует с сиртуином (главным образом с SIRT1), который идентичен лейцину. Метаболиты KIC и НМВ массой в 0,5 мМ могут индуцировать SIRT1 в 30-100% от исходного уровня, который сопоставим с активностью ресвератрола в 2-10 мкм. Это несмотря на то, что комбинация лейцина (0,5 мМ) или HMB (0,5 мкм) и ресвератрола (200 нм) способна синергически индуцировать активность SIRT1 и SIRT3 в адипоцитах (жировых клетках) и скелетных мышечных клетках 44). KIC — это более мощный стимулятор, чем HMB, и лучше взаимодействует с лейцином, чем с HMB (возможно, это указывает на метаболизм KIC). Когда крысам дают смесь лейцина (24 г / кг, до 200% главной диеты) или HMB (2 или 10 г / кг) с ресвератролом (12,5 или 225 мг / кг), а затем умерщвляют натощак, наблюдается уменьшение жировой массы и веса тела, также синергично. Было отмечено, что инкубация ресвератрола с лейцином или HMB фактически увеличивает активность АМФ-зависимой киназы (42-55%, соответственно) и способствует небольшому (18%) увеличению окисления жиров, несмотря на инкубацию 5 мкм глюкозы. Взаимодействие ресвератрола и лейцина (в состоянии инкубации или при приеме внутрь) посредством активации SIRT1 положительно влияет на митохондриальный биогенез.
Цитруллин
Цитруллин может восстанавливать скорость синтеза мышечного белка 45) и мышечную функцию 46) в процессе старения и плохого питания у крыс, что опосредуется через путь mTORC1 и разрушается ингибитором mTORC1, известным как рапамицин). 47) Не удалось значительно изменить скорость окисления лейцина или синтеза белка организма человека с помощью добавки 0,18 г / кг цитруллина в течение недели, но в других случаях та же доза улучшает баланс азота в организме человека в сытом состоянии. 48) Причина такого расхождения неизвестна. Существует не так уж много доказательств прямого активирующего воздействия цитруллина на mTOR, но он слабо индуцирует белки после активации mTOR (в том числе 4E-BP1) до уровня ниже лейцина. Клинически пока не доказано то, что цитруллин повышает сигнализацию mTOR, поскольку его преимущество зависит от mTOR, и в этом случае цитруллин должен быть синергичен с лейцином. Цитруллин может передавать сигналы лейцина через mTOR, что даёт основания предположить, что они синергичны. Еще не исследован эффект от применения этой смеси тяжелоатлетами, так что синергизм в настоящее время – это только неподтвержденная гипотеза.
Безопасность и токсичность
В небольшом исследовании, в котором 5 здоровых человек ступенчато принимали до 1,250 мг/кг лейцина (что в 25 раз превышает ожидаемую среднюю потребность организма в лейцине), было отмечено, что пероральный прием дозы в 500-1,250 мг вызывал увеличение в сыворотке аммиака, из-за чего верхний ограничительный порог был установлен на уровне в 500 мг / кг (для человека весом в 150 фунтов (68 кг) — 34 г) [93].
Пищевая добавка
Как пищевая добавка, L-лейцин имеет Е номер E641 и классифицируется как усилитель вкуса.
Доступность:
Список использованной литературы:
1) Nutr Metab (Lond). 2012 Aug 22;9(1):77. doi: 10.1186/1743-7075-9-77. Synergistic effects of leucine and resveratrol on insulin sensitivity and fat metabolism in adipocytes and mice. Bruckbauer A1, Zemel MB, Thorpe T, Akula MR, Stuckey AC, Osborne D, Martin EB, Kennel S, Wall JS. 2) Yeh YY. Ketone body synthesis from leucine by adipose tissue from different sites in the rat. Arch Biochem Biophys. (1984) 3) Nutraceutical Effects of Branched-Chain Amino Acids on Skeletal Muscle 4) Van Koevering M, Nissen S. Oxidation of leucine and alpha-ketoisocaproate to beta-hydroxy-beta-methylbutyrate in vivo. Am J Physiol. (1992) 5) Wullschleger S, Loewith R, Hall MN. TOR signaling in growth and metabolism. Cell. (2006) 6) Dann SG, Selvaraj A, Thomas G. mTOR Complex1-S6K1 signaling: at the crossroads of obesity, diabetes and cancer. Trends Mol Med. (2007) 7) Nobukuni T, et al. Amino acids mediate mTOR/raptor signaling through activation of class 3 phosphatidylinositol 3OH-kinase. Proc Natl Acad Sci U S A. (2005) 8) Greiwe JS, et al. Leucine and insulin activate p70 S6 kinase through different pathways in human skeletal muscle. Am J Physiol Endocrinol Metab. (2001) 9) Hannan KM, Thomas G, Pearson RB. Activation of S6K1 (p70 ribosomal protein S6 kinase 1) requires an initial calcium-dependent priming event involving formation of a high-molecular-mass signalling complex. Biochem J. (2003) 10) Mercan F, et al. Novel role for SHP-2 in nutrient-responsive control of S6 kinase 1 signaling. Mol Cell Biol. (2013) 11) Fornaro M, et al. SHP-2 activates signaling of the nuclear factor of activated T cells to promote skeletal muscle growth. J Cell Biol. (2006) 12) Inoki K, et al. Rheb GTPase is a direct target of TSC2 GAP activity and regulates mTOR signaling. Genes Dev. (2003) 13) Leucine supplementation improves muscle protein synthesis in elderly men independently of hyperaminoacidaemia 14) Verdin E, et al. Sirtuin regulation of mitochondria: energy production, apoptosis, and signaling. Trends Biochem Sci. (2010) 15) Guarente L, Picard F. Calorie restriction–the SIR2 connection. Cell. (2005) 16) Nemoto S, Fergusson MM, Finkel T. SIRT1 functionally interacts with the metabolic regulator and transcriptional coactivator PGC-1{alpha}. J Biol Chem. (2005) 17) Bruckbauer A, Zemel MB. Dietary calcium and dairy modulation of oxidative stress and mortality in aP2-agouti and wild-type mice. Nutrients. (2009) 18) Hinault C, et al. Amino acids and leucine allow insulin activation of the PKB/mTOR pathway in normal adipocytes treated with wortmannin and in adipocytes from db/db mice. FASEB J. (2004) 19) Uberall F, et al. Evidence that atypical protein kinase C-lambda and atypical protein kinase C-zeta participate in Ras-mediated reorganization of the F-actin cytoskeleton. J Cell Biol. (1999) 20) Du M, et al. Leucine stimulates mammalian target of rapamycin signaling in C2C12 myoblasts in part through inhibition of adenosine monophosphate-activated protein kinase. J Anim Sci. (2007) 21) O’Neill HM. AMPK and Exercise: Glucose Uptake and Insulin Sensitivity. Diabetes Metab J. (2013) 22) Tremblay F, Marette A. Amino acid and insulin signaling via the mTOR/p70 S6 kinase pathway. A negative feedback mechanism leading to insulin resistance in skeletal muscle cells. J Biol Chem. (2001) 23) Yang J, et al. Leucine stimulates insulin secretion via down-regulation of surface expression of adrenergic α2A receptor through the mTOR (mammalian target of rapamycin) pathway: implication in new-onset diabetes in renal transplantation. J Biol Chem. (2012) 24) Stanley CA. Hyperinsulinism/hyperammonemia syndrome: insights into the regulatory role of glutamate dehydrogenase in ammonia metabolism. Mol Genet Metab. (2004) 25) Yang J, et al. Leucine culture reveals that ATP synthase functions as a fuel sensor in pancreatic beta-cells. J Biol Chem. (2004) 26) Malaisse WJ, et al. The stimulus-secretion coupling of amino acid-induced insulin release: metabolism and cationic effects of leucine. Diabetes. (1980) 27) Devedjian JC, et al. Transgenic mice overexpressing alpha2A-adrenoceptors in pancreatic beta-cells show altered regulation of glucose homeostasis. Diabetologia. (2000) 28) Rosengren AH, et al. Overexpression of alpha2A-adrenergic receptors contributes to type 2 diabetes. Science. (2010) 29) Fraenkel M, et al. mTOR inhibition by rapamycin prevents beta-cell adaptation to hyperglycemia and exacerbates the metabolic state in type 2 diabetes. Diabetes. (2008) 30) Drummond MJ, et al. Rapamycin administration in humans blocks the contraction-induced increase in skeletal muscle protein synthesis. J Physiol. (2009) 31) Phosphorylation and Activation of p70s6k by PDK1 32) Kimball SR, Jefferson LS. Regulation of protein synthesis by branched-chain amino acids. Curr Opin Clin Nutr Metab Care. (2001) 33) Resistance Exercise Increases Muscle Protein Synthesis and Translation of Eukaryotic Initiation Factor 2Bϵ mRNA in a Mammalian Target of Rapamycin-dependent Manner 34) Vander Haar E, et al. Insulin signalling to mTOR mediated by the Akt/PKB substrate PRAS40. Nat Cell Biol. (2007) 35) Elmadhun NY, et al. Metformin alters the insulin signaling pathway in ischemic cardiac tissue in a swine model of metabolic syndrome. J Thorac Cardiovasc Surg. (2013) 36) Glass DJ. Signalling pathways that mediate skeletal muscle hypertrophy and atrophy. Nat Cell Biol. (2003) 37) Yang J, et al. Leucine metabolism in regulation of insulin secretion from pancreatic beta cells. Nutr Rev. (2010) 38) Anthony TG, et al. Oral administration of leucine stimulates ribosomal protein mRNA translation but not global rates of protein synthesis in the liver of rats. J Nutr. (2001) 39) Tipton KD, et al. Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise. Am J Physiol Endocrinol Metab. (2001) 40) Nicastro H, et al. An overview of the therapeutic effects of leucine supplementation on skeletal muscle under atrophic conditions. Amino Acids. (2011) 41) Rieu I, et al. Leucine-supplemented meal feeding for ten days beneficially affects postprandial muscle protein synthesis in old rats. J Nutr. (2003) 42) Samuel VT, Shulman GI. Mechanisms for insulin resistance: common threads and missing links. Cell. (2012) 43) Kalogeropoulou D, et al. Leucine, when ingested with glucose, synergistically stimulates insulin secretion and lowers blood glucose. Metabolism. (2008) 44) Bruckbauer A, et al. Synergistic effects of leucine and resveratrol on insulin sensitivity and fat metabolism in adipocytes and mice. Nutr Metab (Lond). (2012) 45) Osowska S, et al. Citrulline modulates muscle protein metabolism in old malnourished rats. Am J Physiol Endocrinol Metab. (2006) 46) Faure C, et al. Leucine and citrulline modulate muscle function in malnourished aged rats. Amino Acids. (2012) 47) Cynober L, de Bandt JP, Moinard C. Leucine and citrulline: two major regulators of protein turnover. World Rev Nutr Diet. (2013) 48) Rougé C, et al. Manipulation of citrulline availability in humans. Am J Physiol Gastrointest Liver Physiol. (2007)
лейцин.txt · Последние изменения: 2016/04/22 15:27 — jackhazer
воздействие на организм, лучшие производители и эффективность препарата (видео + 130 фото)
Атлетичное тело всегда привлекает внимание. К сожалению мышечная масса не растет так быстро, как бы хотелось. Для ее набора необходимы специальные вещества, важнейшее из которых — лейцин. Он поступает в организм вместе с едой или в виде БАДа для спортсменов. Но не будем торопиться, расскажем обо всем все по порядку.

Содержимое обзора:
Что это такое
L-Leucine наряду с валином и изолейцином относится к аминокислотам с разветвленной цепочкой. Он участвует в синтезе белка, построении, регенерации клеток, сжигании жира. Молекулы, входящие в состав лейцина, продуцируют больше энергии, чем глюкоза.

Выпускается в форме таблеток, капсул, белого порошка без специфического вкуса и аромата. Кристаллики плохо растворяются в воде, но легко усваиваются в щелочной и кислой средах. Переработка осуществляется в печени, жировой прослойке, поджелудочной железе. Излишки выводятся почками.

Долгое время L-лейцин использовался как усилитель вкусо-ароматических характеристик макаронных изделий, пюре, мясных блюд. Сейчас Е 641 официально запрещен.
Свойства
Добавка будет полезной не только для бодибилдеров, но и для тех, кто следит за своим здоровьем. Чтобы понять, для чего нужен лейцин, рассмотрим эффект от его приема:
- Рост мышц.
- Защита мышечных волокон от повреждений при физических нагрузках.
- Активизация жиросжигания.
- Нормализация уровня сахара в крови.
- Выработка инсулина.
- Уменьшение усталости.
- Укрепление суставов.

Все указанные свойства подтверждены клиническими исследованиями. В медицине лейцин назначают пациентам с онкологическими заболеваниями, ожирением. В косметологии его можно встретить в антивозрастных препаратах.
Где содержится
Самая высокая концентрация приходится на долю сывороточного протеина. В 23 г нутриента содержится до 3 г Leucine. Важно понимать, что кроме спортивного питания аминокислоту можно получить из обычной еды. Для этого необходимо знать, в каких продуктах есть лейцин.

В перерасчете на 100 г рекордсменами являются:
- икра красная зернистая — 3 г;
- свежие соевые бобы — 2,8 г;
- кальмар -1,9 г;
- арахис — 1,76 г;
- говяжье мясо, печенка — 1,7 г;
- сырой лосось — 1,7 г;
- курица — 1.5 г;
- молоко коровье — 0,3 г/100 мл.

Лейцином могут похвастаться злаки — пророщенная пшеница, овес, чечевица, рис. Чтобы лучше представлять масштабы цифр, следует познакомиться с нормой потребления.

Суточная потребность
Для взрослого стандартной считается суточная дозировка до 6 г. Чтобы получить столько аминокислоты лейцин, придется употребить пару яиц, 0,2 кг говядины, 0,1 кг творога, стакан кефира.

Для спортсменов и занятых физическим трудом установленная планка выше в 2 раза. В детском возрасте рекомендуемое значение зависит от веса ребенка. На каждый килограмм массы требуется 0,15 г.

Составляя рацион, учитывайте свои особенности. Так, при повышенном холестерине под запретом жирные сыры, молокопродукты, яичные желтки. В данном случае разумнее питаться другой лейцинсодержащей пищей: морепродуктами, орехами.
Вреден ли избыток
Результатом избыточного употребления может стать бессонница, депрессия, тремор, гипогликемия (падение глюкозы до 2,5 ммоль/л). Дело в том, что при чрезмерном приеме происходит ухудшение всасываемости других полезных веществ. Отсюда и возникают побочные реакции.

При индивидуальной непереносимости проявляется аллергия, сопровождающаяся кожными высыпаниями, зудом.

Чем чреват недостаток
Из-за дефицита возникают патологии внутренних органов — щитовидной железы, печени. Для детей существует риск торможения физического развития, истощения, быстрой утомляемости.

Как принимать
Производители указывают, что правила приема такие же, как и для остальных аминокислотных комплексов.

Инструкция по применению лейцина включает в себя следующие основные моменты:
- Биодобавку можно пить до, во время и после тренировки. У каждого действия есть своя цель. Предварительное употребление необходимо для стимуляции организма. Прием в течение занятия повышает выносливость. А использование в конце позволяет восполнить запас питательных веществ.
- В дни отдыха также можно подпитывать себя лейцином. Лучше всего его пить в утренние часы, сразу же после пробуждения.
- Оптимальная доза — 0,5 стандартной порции.
- При беременности, грудном вскармливании, повышенной чувствительности следует ограничить прием.
- Идеальный вариант разбавлять БАД жидкостью. Но можно положить порцию в рот и запить водой.
- Одновременно принимать лейцин с триптофаном или протеином нежелательно. Если необходимы оба средства, лучше сделать паузу 15-20 мин между приемами.
Подводя итоги, отметим, что лейцин напрямую влияет на самочувствие. Он не может синтезироваться самостоятельно. Поэтому необходимо постоянно подпитывать организм аминокислотой извне.

Фото лейцина

































Также рекомендуем просмотреть:
Просмотров: 202
в каких продуктах содержится, применение аминокислоты в бодибилдинге
В составе ВСАА лейцин занимает лидирующую позицию, его содержание вдвое, а то и вчетверо превышает содержание йзолейцина и валина. Этой незаменимой аминокислоте было отведено особое внимание, множество исследований подтвердило ее важность для человека, особенно, занимающегося спортом. Так почему именно лейцин стоит на пьедестале лучших спортивных добавок мира? Разберем его пользу для организма, возможный вред, содержание в продуктах и добавках спортивного питания.
Что такое L-лейцин, его роль в организме
L-лейцин – незаменимая аминокислота с разветвленными цепями, которая не синтезируется в организме самостоятельно. Это аминокислота – составляющая часть белковых молекул, которые участвуют в синтезе новых клеток. В медицине аминокислота применяется при лечении цирроза печени, анемии, дистрофии, полиомиелите, невритах, психических расстройствах. В пищевой промышленности Л-лейцин известен как E641 и является усилителем вкуса.
Основным преимуществом, сделавшим аминокислоту такой популярной, является повышение анаболизма. Дополнительный прием лейцина способствует наращиванию мышечной массы, также помогая быстрому восстановлению. Помимо этого, аминокислота способна усилить синтез коллагена, который сохраняет целостность тканей, предотвращая старение и увядание кожи и мышц, сохраняет целостность суставов. Именно потеря коллагена приводит к старению тканей, так как с 30 лет выработка коллагена постепенно начинает ухудшаться. Следовательно, прием аминокислоты еще будет способствовать сохранению красоты и здоровья.
Также было выявлено, что лейцин регулирует жировые отложения, а именно может их уменьшать. Это обусловлено стимуляцией производства гена разобщающего белка, способного сжигать жиры. Исследования показали ускорение обменных процессов, сжигание большего количества энергии, также аминокислота уменьшает количество накопленного жира, даже без изменения диеты.
В каких продуктах содержится лейцин
Поскольку лейцин не вырабатывается в организме человека самостоятельно, его обязательно следует приминать не только из добавок, но и продуктов питания.
Растительные источники лейцина:
- Кукурузная крупа.
- Пшенная крупа.
- Нешлифованный рис.
- Соя.
- Бобы.
- Горох.
- Орехи.
- Кунжут.
Источники животного происхождения:
- Молочные продукты.
- Яйца.
- Сыр.
- Рыба, кальмары и красная икра.
- Говядина, говяжья печень, баранина, свинина.
- Индейка, курица.
Для чего применяют аминокислоту лейцин в спорте
В спорте добавку лейцина принято получать из ВСАА. В правильном соотношении и при эффекте синергии с изолейцином и валином, лейцин становится мощным анаболиком, который участвует в процессе набора мышечной массы. Если говорить о бодибилдинге, где преимуществом является набор мышечной массы, то дополнительные строительные материалы из незаменимых аминокислот способны этот процесс ускорить в разы, а без них увеличение массы невозможно.
В то же время на сушке лейцин способен ускорить процесс жиросжигания и предотвратить катаболические эффекты. Поэтому аминокислота необходима на любом этапе подготовки. К тому же лейцин ускоряет процесс восстановления мышц после тренировок, а также скорее заживляет раны. А это качество необходимо абсолютно всем спортсменам, независимо от вида спорта. Еще он выступает источником энергии, следовательно, улучшает все спортивные показатели, как силу, так и выносливость.
Польза лейцина
- Участвует в синтезе белка, ускоряя процесс увеличения мышечной массы.
- Выступает источником энергии при нагрузках.
- Снижает катаболизм.
- Понижает уровень глюкозы в крови.
- Ускоряет восстановление и препятствует переутомлению.
- Укрепляет иммунитет.
- Способствует сжиганию лишнего жира, предупреждает ожирение.
- Улучшает качество кожи, благодаря усилению выработки коллагена, замедляет процесс старения.
- Ускоряет заживление ран.
Побочные эффекты и вред
Сама по себе аминокислота безвредна, тем более спортсменам она необходима в больших количествах. Тем не менее, высокая концентрация лейцина тоже вызывает побочные эффекты в виде гипогликемии, невралгии, депрессивных состояний, атрофии мышц.
Противопоказания к приему
- Болезнь Менкеса или лейциноз – врожденные нарушения обмена лейцина, изолейцина и валина.
- Изовалератацидемия – нарушение обмена лейцина.
При этих заболеваниях полностью противопоказан прием этих аминокислот, а также назначается диета, в которой исключены белковые продукты.
А также противопоказаниями являются беременность и грудное вскармливание.
Как принимать лейцин в бодибилдинге: инструкция по применению
Чтобы рассчитать индивидуальную потребность в лейцине, можно применить формулу:
33 мг * вес тела.
В среднем спортсмену необходимо от 4 до 6 грамм лейцина. Он встречается в порошковой и таблетированной форме, последняя запивается водой, а порошок разводится водой или соком.
В составе ВСАА лейцин составляет лидирующую позицию и содержится в два или четыре раза больше остальных кислот, этому свидетельствует соотношение на упаковке производителя, на которой указано – 2:1:1 или 4:1:1. Следовательно, и дозировки сильно отличаются, поэтому придерживайтесь рекомендаций по приему размещенных на этикетке.
Обычно ВСАА употребляются по 2 порции в день.
- В дни тренировок 1 порция употребляется перед тренировкой за полчаса, а вторая сразу после окончания. Если тренировки длительные, ВСАА можно принимать во время нагрузок.
- В дни отдыха 1 порция принимается сразу после сна, а вторая в течение дня между приемами пищи.
С каким спортпитом можно совмещать Л-лейцин
Лейцин, как соло, так и в составе ВСАА, совместим с аминокислотами полного цикла, протеинами, гейнерами. Также в медицине лейцин часто назначают с глютаминовой кислотой. А еще лейцин совместим с Л-карнитином.
Топ производителей
- Anderson Leucine.


- XPN Leucine-X.


- BPI sports Leucine AGMA.


- Wolf Sports Leucine Blend+HICA.


- Allmax Nutrition Leucine+.


- Singular sport Leucine.


В остальном, лейцин можно найти в топовых добавках ВСАА от лучших производителей спортивного питания.
Заключение
Лейцин – одна из аминокислот, которую точно нельзя переоценить. Ее эффект превосходит другие в анаболизме, предотвращении катаболизма, ускорении восстановления, и что поразительно, даже в жиросжигании. Поэтому неважно, набираете массу или сушитесь – без лейцина, а лучше ВСАА, не обойтись. И даже неважно, какой спорт выбираете, главное, что каждому спортсмену необходим качественный отдых и восстановление переутомленных мышц и ЦНС. Именно незаменимые аминокислоты, в том числе наш лидер, способствуют улучшению всех спортивных показателей.
А также читайте, какие аминокислоты существуют и зачем они нужны →
Незаменимые аминокислоты — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 сентября 2018; проверки требуют 60 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 сентября 2018; проверки требуют 60 правок.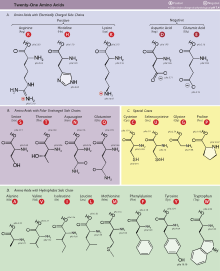 21 протеиногенная α-аминокислота эукариот, сгруппированные согласно радикалам.
21 протеиногенная α-аминокислота эукариот, сгруппированные согласно радикалам.Незаменимые аминокислоты — необходимые аминокислоты, которые не могут быть синтезированы в том или ином организме. Для разных видов организмов список незаменимых аминокислот различен. Все белки, синтезируемые организмом, собираются в клетках из 20 базовых аминокислот, только часть из которых может синтезироваться организмом. Невозможность сборки определённого белка организмом приводит к нарушению его нормальной работы, поэтому необходимо поступление незаменимых аминокислот в организм с пищей. [1]
Незаменимыми для взрослого здорового человека являются 8 аминокислот: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан и фенилаланин; также часто к незаменимым относят гистидин[2][3]; (F V T W M L I K H). Для детей также незаменимым является аргинин.
6 других аминокислот (R C G Q P Y) считаются условно незаменимыми в питании человека, что означает ограниченные возможности их синтеза в зависимости от состояния организма, например у новорожденных и больных людей.[4].
5 аминокислот (A D N E S) — заменимые у человека, означает что они могут синтезироваться в достаточных количествах в организме.[4]
Роль незаменимых для человека аминокислот[править | править код]
В результате дефицита необходимых аминокислот в организме человека нарушается синтез белков, что приводит к ослаблению функций памяти и умственных способностей, снижению иммунитета (сопротивляемости организма болезням). В то же время избыток потребления несбалансированного белка приводит к перегрузке работы органов, в первую очередь печени и почек. Ценность потребляемого с пищей белка для человека определяется его сбалансированностью по содержанию незаменимых аминокислот.[1]
Рассчитать требования к рекомендованной суточной норме достаточно сложно; эти значения претерпели значительные изменения за последние 20 лет. Следующая таблица представляет список рекомендованных ВОЗ и Национальной библиотекой медицины США суточных норм для взрослого человека.[5][6]
| Аминокислота(ы) | ВОЗ мг на 1 кг веса тела | ВОЗ мг для веса 70 кг | США мг на 1 кг веса тела | Кодирующий кодон генетического кода |
|---|---|---|---|---|
| H Гистидин | 10 | 700 | 14 | CAU, CAC |
| I Изолейцин | 20 | 1400 | 19 | AUU, AUC, AUA |
| L Лейцин | 39 | 2730 | 42 | UUA, UUG, CUU, CUC, CUA, CUG |
| K Лизин | 30 | 2100 | 38 | AAA, AAG |
| M Метионин + C Цистеин | 10,4 + 4,1 (15 всего) | 1050 всего | 19 всего | Метионин: AUG; Цистеин: UGU, UGC. |
| F Фенилаланин + Y Тирозин | 25 (всего) | 1750 всего | 33 всего | Фенилаланин: UUU, UUC; Тирозин: UAU,UAC . |
| T Треонин | 15 | 1050 | 20 | ACU, ACC, ACA, ACG |
| W Триптофан | 4 | 280 | 5 | UGG |
| V Валин | 26 | 1820 | 24 | GUU, GUC, GUA, GUG |
Рекомендованная суточная норма для детей от 3 лет и старше на 10-20 % выше, чем для взрослого.[5][7]
Продукты с повышенным содержанием отдельных незаменимых аминокислот[править | править код]
- Валин: зерновые, бобовые, арахис, грибы, молочные продукты, мясо.
- Изолейцин: миндаль, кешью, турецкий горох (нут), чечевица, рожь, большинство семян, соя, яйца, куриное мясо, рыба, печень, мясо.
- Лейцин: чечевица, орехи, большинство семян, овёс, бурый (неочищенный) рис, рыба, яйца, курица, мясо.
- Лизин: пшеница, орехи, амарант, молочные продукты, рыба, мясо, горох.
- Метионин: бобы, фасоль, чечевица, соя, молоко, яйца, рыба, мясо.
- Треонин: орехи, бобы, молочные продукты, яйца.
- Триптофан: бобовые, овёс, сушёные финики[источник не указан 1997 дней], арахис, кунжут, кедровые орехи, молоко, йогурт, творог, рыба, курица, индейка, мясо.
- Фенилаланин: бобовые, орехи, говядина, куриное мясо, рыба, яйца, творог, молоко. Также образуется в организме при распаде синтетического сахарозаменителя — аспартама, активно используемого в пищевой промышленности.
- Аргинин (частично-заменимая аминокислота, образуется из аминокислот, поступающих с пищей, не путать с условно-заменимыми, которые образуются из незаменимых кислот, не поступающих с пищей): семена тыквы, арахис, кунжут, йогурт, швейцарский сыр, свинина, говядина, горох.
- Гистидин (частично-заменимая аминокислота): соевые бобы, арахис, чечевица, тунец, лосось, куриные грудки, свиная вырезка, говяжье филе.
Компенсация незаменимых аминокислот[править | править код]
Несмотря на то, что самостоятельно организм не способен синтезировать незаменимые аминокислоты, их недостаток в некоторых случаях все же может быть частично компенсирован. Так, например, недостаток поступающего вместе с пищей незаменимого фенилаланина может быть частично замещен заменимым тирозином. Гомоцистеин вместе с необходимым количеством доноров метильных групп снижает потребности в метионине, а глутаминовая кислота частично замещает аргинин.
- ↑ 1 2 https://cyberleninka.ru/article/n/metodologiya-otsenki-sbalansirovannosti-aminokislotnogo-sostava-mnogokomponentnyh-pischevyh-produktov.pdf
- ↑ https://www.ncbi.nlm.nih.gov/pubmed/1123426 1975
- ↑ apps.who.int/iris/bitstream/10665/38133/1/9251030979_eng.pdf 1991
- ↑ 1 2 Dietary Reference Intakes: The Essential Guide to Nutrient Requirements Архивировано 5 июля 2014 года.. Institute of Medicine’s Food and Nutrition Board. usda.gov
- ↑ 1 2 FAO/WHO/UNU (2007), PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION, WHO Press, <http://whqlibdoc.who.int/trs/WHO_TRS_935_eng.pdf> , page 150
- ↑ Institute of Medicine (англ.)русск.. Protein and Amino Acids // Dietary Reference Intakes for Energy, Carbohydrates, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (англ.). — Washington, DC: The National Academies Press (англ.)русск., 2002. — P. 589—768.
- ↑ Imura K., Okada A. Amino acid metabolism in pediatric patients (неопр.) // Nutrition. — 1998. — Т. 14, № 1. — С. 143—148. — doi:10.1016/S0899-9007(97)00230-X. — PMID 9437700.
- Amino acids / MedlinePlus Encyclopedia, 2015: (англ.) «The 9 essential amino acids are: histidine, isoleucine, leucine, lysine, methionine, phenylalanine, threonine, tryptophan, and valine.»
- https://web.archive.org/web/20150226110517/http://www.uic.edu/classes/phar/phar332/Clinical_Cases/aa%20metab%20cases/PKU%20Cases/essential-nonessential.htm
- ESSENTIAL AMINO ACID REQUIREMENTS: A REVIEW / FAO, 1981
- Recommended Dietary Allowances: 10th Edition., National Research Council (US), National Academies Press 1989. Chapter 6 «Protein and Amino Acids» (англ.)
роль лейцина в организме и содержание в продуктах питания
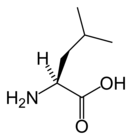
Лейцин – друг валина, входит в группу аминокислот с разветвленной цепью, куда также относится изолейцин. Это неразлучная тройка аминокислот со сходными функциями, живущая по принципу: мы такие друзья – куда они, туда и я. Данные аминокислоты входят в комплекс, известный как BCAA. Структурная формула лейцина похожа на формулу валина с добавлением еще одной углеродной группы.
структурная формула лейцина
Углеродный скелет на конце раздваивается, почему данные аминокислоты относят к классу «разветвленных». Раздваивание придает аминокислоте гидрофобные свойства, т.е. аминокислота отталкивает от себя воду.
Лейцин – это незаменимая протеиногенная аминокислота. Она входит в состав многих белков, особенно мышечной и соединительной ткани. Будучи незаменимым, он не синтезируется в организме и должен поступать с продуктами питания.
Путь лейцина такой же, как валина. В желудочно-кишечном тракте он всасывается в кровь и отправляется в печень, где, в отличии от многих аминокислот, но также как и другие разветвленные братья – валин и изолейцин – он не задерживается и не трансформируется, а как есть, в неизмененном виде выбрасывается в кровяное русло, чтобы попасть в мышечную ткань, где находится его точка приложения. Там лейцин включается в синтез белка мышц, что бы при физической работе быть извлеченным для расщепления в дыхательной цепи с получением энергии. Лейцин – мощный энергетик для мышц, в нем они черпают силы для совершения физической работы.
Потребность
Потребность в лейцине для взрослого человека не занимающегося спортом: 31 мг.\ на 1 кг. веса, т.е. на 60 кг. веса необходимо потреблять 1860 г. Правда, ВОЗ рекомендует потребление 6 г. в сутки, но это средне-потолочный показатель. Чем интенсивнее мышечная работа, чем больше требуется лейцина. Мужчинам его надо больше, чем женщинам просто потому, что у них больше мышечная масса.
Потребление лейцина должно быть сбалансировано с потреблением валина (и изолейцина) в соотношении 1:1 (2), т.е. если человек потребляет 3 г. валина, будь добр потреби 3 г. лейцина, иначе аминокислота, полученная в меньшей дозе, не даст усвоиться аминокислоте, полученной в большей дозе. Спортсмены – бодибилгеры считают, что эти сведения устарели, и можно и нужно принимать лейцин в повышенной дозе, по сравнению с валином. Вполне вероятно, что для них это так и есть, потому что они ставят особые цели и стремятся получить спортивный результат.
Для усвоения лейцина, как и всей разветвленной тройки, необходимо достаточное поступление в организм витаминов В5 (пантотеновая кислота), В6 (пиридоксин) и В7 (Н) (биотин).
Лейцин хорошо сочетается с медленными углеводами (цельнозерновые каши) и полиненасыщенными жирными кислотами (льняное масло, рыбий жир).
Функции
- Структурная
- Энергетическая
- Регуляторная
- Иммунологическая
Структурная функция
Лейцин составляет около 8% от всех аминокислот организма человека, и занимает четвертое место по концентрации в мышечных тканях. В первую очередь он является кирпичиком для строительства мышц, то также участвует в синтезе других белков, в частности коллагена, а коллаген – это белок, отвечающий за прочность связок, гибкость суставов и упругость кожи. Как источник для синтеза белка, лейцин используется для наращивания мышечной массы в спорте.
При физической нагрузке мышечный белок распадается, чтобы дать энергию для работы. Лейцин подавляет разрушение белковых молекул, способствуя сохранению мышечной ткани. Для того чтобы нарастить мышечную массу и повысить выносливость, необходимо сразу после тренировки дать организму белок, и что особенно важно, лейцин, ибо при недостатке лейцина белковый баланс останется отрицательным.
В процессе трансформаций на биохимическом конвейере лейцин превращается в ацетилКоА, промежуточное вещество, которое далее идет на синтез холестерина или жирных кислот. Однако не будем пугаться: оказалось, что он выступает в роли запала для ускоренной переработки жира в энергию.
Лейцин входит в состав белка коллагена, а это эластичные связки, гибкие суставы, упругая кожа. Он ускоряет заживление ран, усиливает регенеративные способности организма.
Разветвленные аминокислоты – валин, лейцин, изолейцин – поддерживают уровень альбумина – белка сыворотки крови, основного транспорта жирных кислот и регулятора онкотического давления. При падении уровня разветвленных братьев, снижается содержание альбумина в плазме крови, падает онкотическое давление, в результате чего жидкость из плазмы идет в ткани, возникают т.н. безбелковые отеки, вода уходит в межклеточное вещество, организм страдает от обезвоживания, заливаемый водой.
Энергетическая функция
Лейцин обеспечивает мышечную ткань энергией. В отличие от валина и изолейцина, которые запускают производство глюкозы, лейцин превращается в ацетилКоА, предшественника жирных кислот, который, сгорая в митохондриальной печке, дает больше энергии,. Так лейцин экономит гликоген, запасы которого в мышцах ограничены, косвенно повышая выносливость и сохраняя запас валина и изолейцина, т.е. препятствуя процессу распада мышечных белков.
Регуляция синтеза белка
Лейцин усиливает синтез мышечных белков в 10 раз интенсивнее по сравнению с другими аминокислотами. Оказалось, это происходит благодаря регуляторному воздействию на процессы усвоения белка в организме. Установлено, что лейцин стимулирует особый рецептор, который называется «мишень рапамицина в клетках млекопитающихся» или сокращенно белок mTOR. Этот самый белок – рецептор настроен, как радио на волну, на содержание лейцина в межклеточном пространстве. Концентрация лейцина снизилась? Значит, аминокислот для синтеза нет, и mTOR подает сигнал: «остановить белковый конвейер. Стройматериал не завезли». Что значит, не завезли? Валина и изолейцина, хоть лопатой греби! Но контролер строг и непреклонен: лейцина нет – стройматериала нет. Производства белка нет. Но вот появился лейцин, и контролер mTOR поднимает шлагбаум, запуская биохимическую фабрику. mTOR кроме концентрации лейцина чувствителен к концентрации АТФ, основного энергодающего вещества.
Активизируясь, mTOR запускает синтез белка посредством двух механизмов:
- Фосфорилируя, т.е. навешивая замок из фосфорной группы, на связывающий белок 4E-BP1, блокируя его работу. Активный белок 4E-BP1 работает тормозом белка elF4E (инициирующего фактора), не давая ему запускать конвейер синтеза белка. Проще говоря, mTOR выключает тормоз белковой фабрики, и она начинает работу: штамповку нового белка
- Активация рибосомного белка S6 (он же rpS6 или p70S6), который начинает усиленно штамповать новые конвейеры для сборки клеточных белков, т.е. он дает команду к производству средств производства.
Вывод из этой высокой науки таков: без лейцина синтез белка не пойдет и наращивания мышечной массы не будет, потому что именно лейцин сообщает синтезирующим механизмам клетки, что стройматериал завезен в достаточном количестве и надо бы из него строить что-то путное, а не спускать в унитаз в буквальном смысле этого слова, потому что неиспользованные в синтезе белка аминокислоты перерабатываются в мочевину и выделяются почками с мочой.
Даже высокобелковая диета при относительном недостатке лейцина не даст прирост мышечной массы, а лишь нагрузит почки избыточным аммиаком. Повышаете белок в рационе? Следите за адекватным повышением лейцина. 6 г. в сутки – это еще физиологическая норма, рекомендованная ВОЗ.
Регуляция углеводного обмена
Лейцин является мощным стимулятором β-клеток поджелудочной железы, синтезирующих инсулин, причем этот эффект у него выражен много сильнее, чем у разветвленных братьев валина и изолейцина. Выделяясь, инсулин способствует потреблению клетками глюкозы и аминокислот, т.е. обеспечение фабрики синтеза белка стройматериалом и горючкой. Повышение в плазме крови инсулина способствует уменьшению выброса стресс-гормонов кортизола и катехоламинов, усиливающих процессы распада белка, что важно не только для спортсменов, накачивающих мышечную массу, но и для людей, «заедающих» стресс сладким. Лейцин уберет эту патологическую тягу, а заодно, поможет с контролем веса.
Регуляция жирового обмена
Исследования на мышах показали, что мыши, потребляющие избыток жиров, толстеют меньше по сравнению с контрольной группой, если в их рационе присутствует избыток лейцина. Далее было обнаружено, что лейцин способствует ускорению обмена веществ и повышенному потреблению кислорода, в результате чего интенсивно сжигаются именно жиры. Лейцин усиливает синтез гена UCP3 (ген разобщающего белка 3), который перепрограммирует митохондриальную печку на утилизацию жира. Данный эффект получен при значительном избытке лейцина в рационе (мышей), при нормативном потреблении (не говоря о недостатке), ждать, что лейцин спалит жир не приходится.
Изучались влияние лейцина и на людях. В Иллинойсе была предложена диета для похудения, содержащая 125 г. белка в день при содержании лейцина 10 г. Диета оказалась весьма эффективной, ибо по сравнению с группой контроля показала наибольшее снижение веса, потерю жира при наилучшей сохранности мышечной массы.
Нервная регуляция
Лейцин воздействует на гипофиз, увеличивая выработку гормона роста, который запускает синтез белка в организме, способствует снижению уровня жира и продляет молодость, тормозит выработку жировой ткани. Он максимально вырабатывается ночью, во время глубокой фазы сна и в первые часы после засыпания. Синтез гормона роста запускается интенсивными аэробными тренировками, а сочетание с приемом разветвленных аминокислот в несколько раз повышает его образование.
Конкурируя с триптофаном за пропуск в головной мозг через гематоэнцефалический барьер, лейцин тормозит выработку серотонина, предотвращая наступление усталости.
Источники лейцина
Лейцин содержится во многих продуктах питания: в первую очередь это мясо, рыба, птица, а также орехи и бобовые.
Его содержание представлено в таблице. В третьей графе рассчитано количество продукта, необходимое для получения 3 г. лейцина в сутки, что соответствует его балансу с валином.
При расчете количества готового блюда учитывалось, что усваивается лишь 80% аминокислот из растительного белка, поэтому применялся повышающий коэффициент. В мясных блюдах при тушении количество аминокислоты повышается по сравнению с сырым или жареным продуктом, поэтому тушеного мяса для получения необходимого количества аминокислоты будет нужно несколько меньше, чем приведено в табличных данных.
Мясоеды получают лейцин из мяса при потреблении нормальных порций, из яиц получить лейцин сложно, но как дополнение к основному рациону – сойдет. Пить молоко по литру в день – наверное, тоже возможно, но не всем. Вегетарианцам просто необходимо потреблять по стакану орехов в день либо по 300 – 400 г каш из бобовых, впрочем, бобовые можно комбинировать с орехами, получится вполне приемлемый рацион. Однако веганы балансируют на самой грани дефицита лейцита, ибо если мясоед может увеличить потребление мяса раза в два, а то и в три, не выходя за физиологические пределы, то веган точно не сможет жрать по пол-кило гороха или фасоли, да и стакан орехов – это тоже из области фантастики.
Дефицит лейцина
Дефицит лейцина при обычном питании заполучить сложно, для этого надо придерживаться экстремальных диет с лютым ограничением животных продуктов и\или иметь гиповитаминоз по витаминаму В6. Проявляется он в отрицательном азотистом балансе: потеря мышечной массы, склонность к переломам, анемия (малокровие), нарушение обмена веществ, снижение уровня энергии, снижение уровня сахара в крови, а при полной недостаточности – гибель организма.
Избыток лейцина
При обычном питании избыток лейцина получить невозможно, однако в настоящее время существуют коммерческие препараты с высоким содержанием этой аминокилосты, и ими вполне можно обожраться, если не знать меры. Результатом будет не польза, а вред: избыток аммиака в организме с самоотравлением продуктами распада белков и нагрузкой на почки, которая будет пытаться вывести образовавшиеся токсины.
Применение
Как и другие аминокислоты с разветвленной цепью, лейцин применяется для следующих целей:
- В спорте, особенно бодибилдинге для наращивания мышечной массы
- Контроль веса для избавления от излишних жиров при сохранении мышечной ткани
- Для снижения сахара в крови, регуляции уровня инсулина
- Реабилитация после тяжелых операций, травм, ранений
- Усиление иммунитета во время сезонного подъема вирусных инфекций
- В комплексной терапии неврологических и психических заболеваний: бокового амиотрофического склероза, шизофрении, депрессии
- При заболеваниях печени
Как принимать лейцин
При дополнительном приеме лейцина, он обязательно должен быть сбалансирован с валином и изолейцином в соотношении 1:1:2, хотя в последнее время бодибилгеры в погоне за мышечной массой считают эту рекомендацию устаревшей.
Максимальная суточная доза – 10 г. Избыточная нагрузка на почки – не есть айс.
Не следует принимать лейцин изолированно несколько раз на дню.
Лейцин для наращивания мышечной массы в бодибилдинге рекомендуют принимать в комплексе с разветвленными аминокислотами не более чем за час перед тренировкой в количестве 5 г – 10 г. и\или не позднее 1 часа после тренировки в том же количестве. При приеме углеводов дозу лейцина следует понизить.
роль в организме, польза и вред, в каких продуктах содержится
Комплекс незаменимых аминокислот – одна из самых универсальных и необходимых спортивных добавок. В составе ВСАА содержится лейцин, его изомер – изолейцин и валин. На что же влияет эта аминокислота, и какова ее роль в организме. Во многих добавках именно изолейцина содержится меньше всего либо поровну с валином. Разберемся для чего принимать добавки с этой аминокислотой и какие есть противопоказания к приему.
Какую роль в организме выполняет аминокислота изолейцин
Изолейцин – незаменимая аминокислота с разветвленной боковой цепью, которая не синтезируется в организме самостоятельно, а только поступает из пищи, является компонентом многих белков и обладает анаболическими свойствами, участвуя в энергетическом обмене.
Благодаря особой структуре молекулы, наряду с лейцином и валином, аминокислота входит в состав комплексов ВСАА (в переводе аббревиатура означает «аминокислоты с разветвленными боковыми цепями»).
Если в организме не хватает лейцина и валина, Л-изолейцин способен превращаться в эти аминокислоты.
Л-изолейцин участвует в образовании эритроцитов в крови, энергетическом обмене и утилизации глюкозы. Аминокислота метаболизируется в мышцах.
В медицине Л-изолейцин в составе препаратов используется для:
- Лечения астении.
- Предотвращения болезни Паркинсона и заболеваний сердечно-сосудистой системы.
- Лечения мышечной дистрофии.
- Реабилитации после травм и операций.
- Лечения воспалительных и острых заболеваний кишечника.
В каких продуктах содержится изолейцин
Изолейцин в большом количестве содержится в животной пище:
- Мясо птицы, в том числе куриное мясо.
- Свинина, говядина, кролик.
- Морская рыба.
- Печень.
- Куриные и перепелиные яйца.
- Молоко, сметана, кефир, творог.
- Сыр твердых сортов.
А также аминокислоту можно получить из растительных источников:
- Миндаль, арахис, кешью, нут.
- Чечевица, хумус, кукуруза, соевые бобы.
- Рожь, гречка, рис.
- Капуста, зелень.
- Хлебобулочные изделия, в том числе Бородинский хлеб.
Для чего применяют L-изолейцин в спорте
Почему аминокислота так популярна в спорте и используется в комплексах ВСАА? Все потому, что аминокислота участвует в синтезе новых мышечных волокон, а значит, обладает анаболическим свойством. Благодаря тому, что аминокислота расщепляется в течение 20-30 минут и поступает сразу в мышцы, которым необходимо быстрое восстановление после тяжелых физических нагрузок, а не в печень. Это объясняет, почему после тренировки и во время ее для дальнейшего роста мышц и предотвращения катаболизма необходимы ВСАА, в том числе Л-изолейцин.
Польза аминокислоты
- Участвует в производстве гемоглобина, влияет на качество крови, нормализует давление.
- Способствует росту и образованию новых мышечных волокон.
- Снижает уровень сахара и холестерина в крови.
- Участвует в энергетическом обмене, служит источником энергии для мышц и мозга.
- Предупреждает разрушение мышечных волокон.
- Регенерирует поврежденные ткани.
- Повышает выносливость.
- Стимулирует работу ЦНС и ПНС.
- Повышает иммунитет, вырабатывая гормоны и ферменты.
- Способствует детоксикации организма.
Побочные эффекты и вред
- В редких случаях: аллергические реакции – экзема, дерматит, конъюнктивит.
- Непереносимость аминокислоты: тошнота, рвота, нарушение сна, головная боль, повышение температуры тела.
- При передозировке вещества появляется тошнота, рвота, органическая ацидемия, появляется специфический запах пота и мочи, судороги, нарушение дыхания и сердечного ритма, почечная недостаточность.
- Возможны апатия, сгущение крови, повышение уровня аммиака и общее отравление организма.
Противопоказания
- Нарушение выведения изолейцина.
- Ацидоз.
- Хронические заболевания почек.
- Заболевания кардиореспираторной системы и нарушение сердечного ритма.
При приеме изолейцина запрещается принимать витамин В9 (фолиевая кислота), аминокислота снижает концентрацию В9 в крови.
Хотя существует информация о том, что препараты с изолейцином безвредны для беременных и плода, все же необходимо в обязательном порядке принимать любые препараты строго по назначению врача!
Как принимать в бодибилдинге
Норма изолейцина для человека рассчитывается по формуле: 50-70 мг на каждый килограмм веса.
В составе ВСАА изолейцин содержится в среднем в количестве 1-2 грамм на порцию. Принимать комплекс необходимо по инструкции, не превышая максимальную дозировку.
При занятиях бодибилдингом потребность в изолейцине возрастает до 4-6 грамм в сутки.
- Рекомендуется принимать одну порцию ВСАА до тренировки за полчаса или во время, а вторую порцию сразу после завершения нагрузки.
- В дни отдыха принимать порцию ВСАА можно утром, а вторую в течение дня между приемами пищи.
С каким спортпитом можно совмещать
Изолейцин в порошковой форме в составе ВСАА можно добавлять в протеин и гейнер, так как соединение лучше усваивается с жирами.
Также можно принимать с комплексом аминокислот полного цикла в разное время.
Топ-3 добавки с Л-изолейцином
- Olimp Bcaa Xplode 1000 грамм – в одной порции порошковой добавки (10 г) содержится 1500 мг изолейцина, 3000 мг лейцина, 1500 мг валина в соотношении 2:1:1, а также 1000 мг глютамина и 2 мг витамина В6. Продукт содержит 100 порций.
- Optimum Nutrition BCAA 1000 – одна порция (2 капсулы) содержит: 500 мг лейцина, 250 мг изолейцина, 250 мг валина в соотношении 2:1:1. Принимать 1 порцию по 3 раза в день.
- Scitec Nutrition BCAA Xpress – порошковая форма в соотношении 2:1:1 (лейцин – 2500 мг, изолейцин – 1250 мг, валин – 1250 мг). Одна порция составляет 7 грамм – пол мерной ложки. Порция разводится в воде или соке.
Заключение
Помимо своего анаболического свойства при наборе мышечной массы, изолейцин необходим и тем, кто сушится. Здесь проявляется его антикатаболический эффект: при дефиците углеводов в диете, энергии и питательных веществ мышцам недостаточно, без дополнения аминокислотами, организм начинает разрушать собственные мышцы, именно этому и препятствует аминокислота. Поэтому добавка нужна как мужчинам, так и женщинам, которые набирают массу или сушатся.
А также читайте, зачем принимают аминокислоту триптофан →

 (
(