Лейцин и его эффективное использование для роста и восстановления мышц
Чтобы нарастить мышечную массу нужно усердно тренироваться, придерживаться сбалансированного питания, а также не забывать о пищевых добавках. Для того чтобы использование пищевых добавок было эффективным необходимо понимать, как в организме происходят отдельные химические процессы, влияющие на формирование мышц и уменьшение процента жира в организме. Мы поделимся с вами несколькими фактами о лейцине, аминокислоте, которая имеет решающее значение для синтеза белка.
Что такое лейцин?Лейцин является незаменимой аминокислотой, которую организм не может вырабатывать сам. Существует 9 незаменимых аминокислот, и лейцин является одним из наиболее важных, поэтому важно получать его из пищи или пищевых добавок.
Лейцин является частью BCAA, аминокислот с разветвленной цепью, о которых можно узнать больше в нашей статье о Действии BCAA на организм.
Лейцин считается основной и наиболее важной аминокислотой BCAA, поскольку он обладает множеством полезных свойств для организма. Он особенно популярен благодаря своему свойству наращивать мышцы и активировать белок, известный как mTOR, который запускает синтез мышечного белка. Конечно, изолейцин и валин также помогают активировать mTOR, 
Лейцин классифицируется в двух формах, таких как:
- L-лейцин – это естественная форма
- D-лейцин – это форма L-лейцина, которая производится в лабораториях, а также служит для приготовления пищевых добавок.
Преимущества лейцина включают более быстрое сжигание жира, улучшение регенерации мышц и физической работоспособности. В следующих строках мы подробнее расскажем о пользе лейцина. [1]
6 преимуществ использования лейцинаЛейцин обладает многими положительными свойствами, которые особенно важны для спортсменов
 Мы расскажем, как эффективно использовать лейцин для роста мышц и о его научно доказанных свойствах.1. Способствует росту мышц
Мы расскажем, как эффективно использовать лейцин для роста мышц и о его научно доказанных свойствах.1. Способствует росту мышцЛейцин пользуется большой популярностью в кругу спортсменов и культуристов благодаря его свойству значительно увеличить прирост мышечной массы
Как это работает? Было показано, что лейцин активирует mTOR, белок, который отвечает за синтез белка. MTOR действует как датчик энергии и питательных веществ из доступных аминокислот, а именно лейцина, который, в свою очередь, запускает синтез белка. Активация mTOR имеет решающее значение для увеличения мышечной массы. [22]
Это означает, что низкий уровень лейцина в кровообращении указывает на то, что в организме недостаточно белка для синтеза новых мышечных белков, а затем  С другой стороны, если уровень лейцина увеличивается, mTOR получает сигнал о том, что в организме достаточно белка, чтобы синтезировать новые белки мышечной ткани и таким образом запускается синтез белка.
С другой стороны, если уровень лейцина увеличивается, mTOR получает сигнал о том, что в организме достаточно белка, чтобы синтезировать новые белки мышечной ткани и таким образом запускается синтез белка.
Исходя из результатов исследований не совсем ясно, как лейцин может активировать mTOR. Однако подтверждено, что mTOR чувствителен к концентрации лейцина и уровням АТФ (аденозинтрифосфата). [23] [24] Роль лейцина в этом процессе не ограничивается активацией синтеза белка,
Эксперты провели исследование, где испытуемые провели 45-минутную силовую тренировку. Затем эти участники были разделены на 3 группы, каждая из которых принимала разные комбинации добавок. Одна группа употребляла только углеводы
Одна группа употребляла только углеводы
Исследование показало, что у третьей группы, которая принимала комбинацию углеводы–белки–лейцин, наблюдалось снижение расщепления белка и значительное увеличение синтеза белка, чем у группы, которая принимала комбинация углеводы–белки. В то же время результаты третьей группы были гораздо лучше, чем у первой группы, которая употребляла только углеводы. [25]
Возможное объяснение этому состоит в том, что белку требуется больше времени, чтобы из желудка попасть в кишечник, а в конечном итоге в кровообращение. Даже с быстро усваиваемым белком, таким как сывороточный белок, может потребоваться несколько часов для 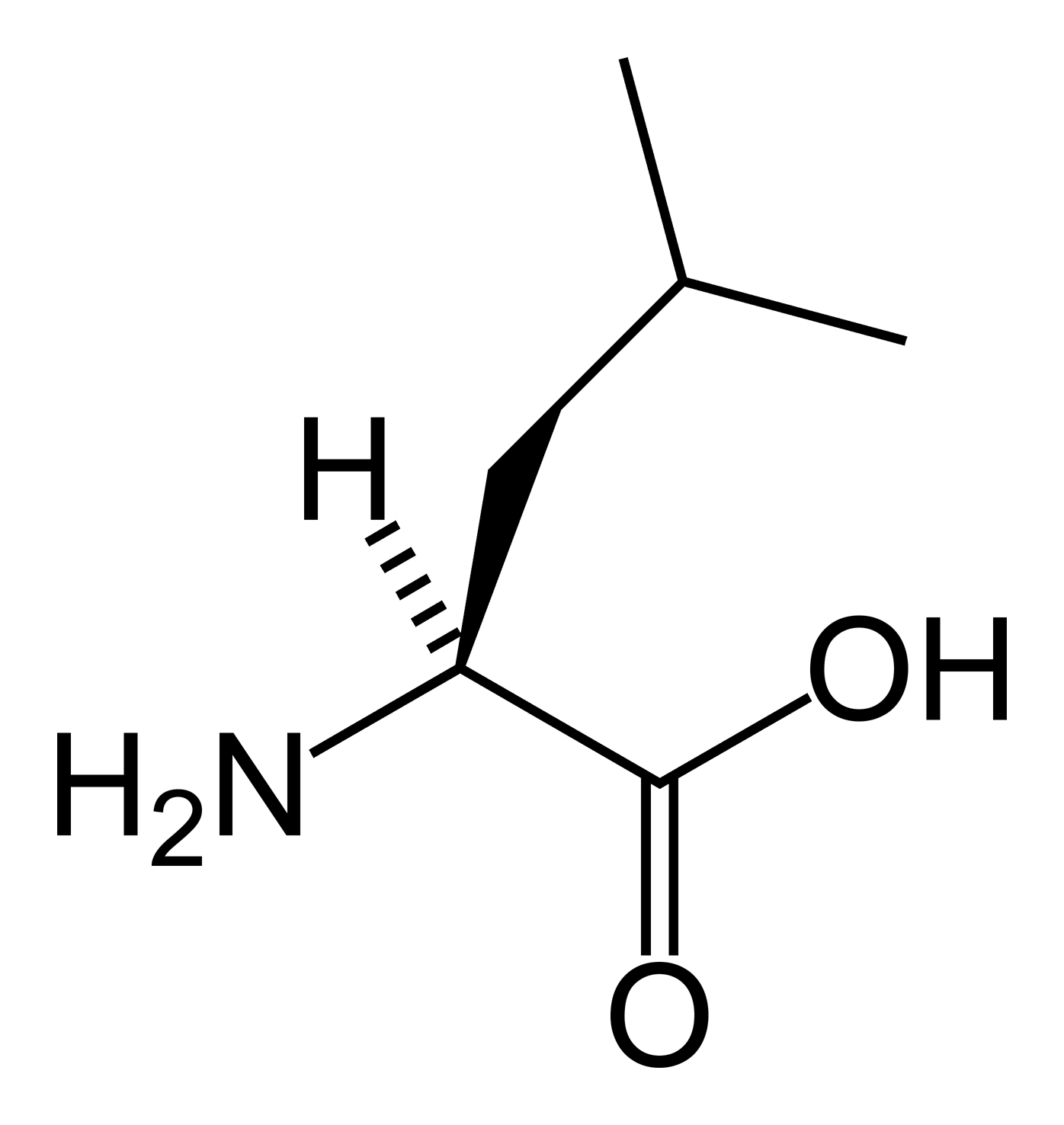 [25]
[25]
Другим примером является исследование 2017 года, в котором также проверялось влияние различных комбинаций добавок в разных дозах на увеличение синтеза белка. В исследовании участвовали
Результаты показали, что 6,25 г сывороточного протеина вместе с высокой дозой лейцина – 5 г повышали анаболизм лучше, чем та же доза протеина с меньшим количеством лейцина (3 г). Кроме того, такая доза была настолько же эффективна для увеличения синтеза белка, как и  Отсюда следует, что повышенная доза лейцина может компенсировать оптимальную дозу сывороточного протеина, и при этом синтез белка будет одинаково интенсивным. [21]
Отсюда следует, что повышенная доза лейцина может компенсировать оптимальную дозу сывороточного протеина, и при этом синтез белка будет одинаково интенсивным. [21]
Свойства и преимущества лейцина принесут пользу не только для бодибилдеров, но также и для опытных и начинающих спортсменов. Он улучшает физическую работоспособность даже во время аэробной физической активности. В одном исследовании выяснилось, что прием лейцина в течение шести недель
Если вы пытаетесь нарастить мышцы, и в тоже время сжечь жир на животе, лейцин – отличный выбор. Несколько исследований подтвердили, что лейцин эффективно помогает бороться с подкожным жиром. Опрос 2015 года показал, что аминокислота лейцин
Несколько исследований подтвердили, что лейцин эффективно помогает бороться с подкожным жиром. Опрос 2015 года показал, что аминокислота лейцин
Мышечная боль является естественным следствием хорошей тренировки. Однако после очень интенсивной физической активности, боль в мышцах может вывестиспортсмена из тренировочного режима. Тогда поможет лейцин.
Обнадеживающие результаты исследований показывают, что лейцин играет важную роль в восстановлении мышц. Одно исследование подтвердило, что потребление лейцина сразу после тренировки помогает восстановить мышцы и активировать синтез мышечного белка. Другое исследование показало, что добавки лейцина улучшают как регенерацию, так и выносливость даже в дни после тренировок. [15] [16]
5. Стабилизирует уровень сахара в крови
Стабилизирует уровень сахара в кровиГипергликемия или высокий уровень сахара в крови могут вызывать усталость, значительную потерю веса и повышенную жажду. Однако если не лечить повышенный уровень сахара, то это может привести к более серьезным последствиям, таким как повреждение нервов, проблемы с почками или риск кожных инфекций.
Некоторые исследования показывают, что лейцин может быть полезен для поддержания стабильного уровня сахара в крови. Исследование подтвердило, что лейцин, принимаемый с глюкозой, помогает стимулировать секрецию инсулина, тем самым снижая уровень сахара в крови. Другое исследование также предполагает, что лейцин способен облегчить передачу сигналов инсулина и потребление глюкозы, чтобы помочь стабилизировать уровень сахара в крови. [17] [18]
6. Предотвращает потерю мышц у пожилых людейВ организме происходит много изменений в процессе старения. Постепенное ухудшение состояния скелетных мышц, также называемое саркопенией, является одним из наиболее значимых симптомов пожилого возраста. Такое состояние может вызвать слабость и снижение выносливости, что приводит к снижению физической активности.
Постепенное ухудшение состояния скелетных мышц, также называемое саркопенией, является одним из наиболее значимых симптомов пожилого возраста. Такое состояние может вызвать слабость и снижение выносливости, что приводит к снижению физической активности.
Именно лейцин помогает замедлить повреждение мышц. Одно исследование показало, что лейцин улучшает синтез мышц у пожилых людей, которые также принимали достаточное количество белка с пищей. Дальнейшие исследования опубликовали аналогичные результаты. Было обнаружено, что употребление добавок лейцина помогает снизить потерю веса, вызванную недоеданием у пожилых людей. [8] [9]
Источники лейцинаДля того, чтобы получить максимальную пользу от лейцина следует внимательно следить за его потреблением. Лейцин содержится в обычных продуктах, так как он является неотъемлемой частью богатой белком пищи.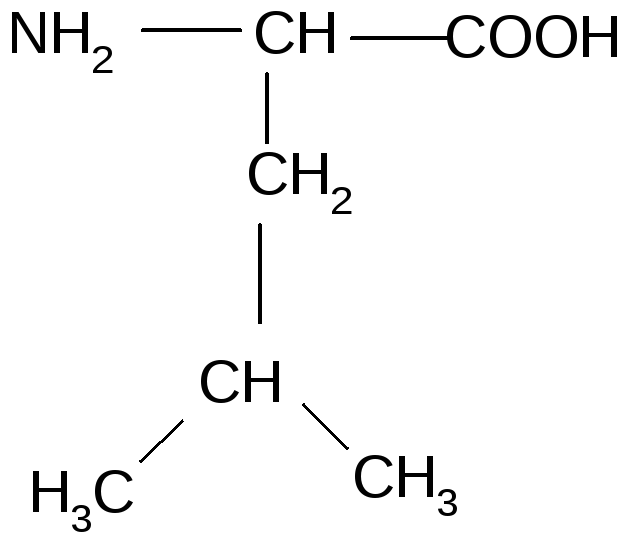 [3]
[3]
Если вы хотите узнать количество потребления лейцина из пищи, это будет довольно сложно, потому что на этикетках обычных продуктов можно найти только количество белка, но не лейцина. Однако специалисты в данной области утверждают, что количество лейцина, который содержится в белке, составляет около 5-10%. В следующей таблице приведены продукты с наибольшей долей лейцина. Большинство из них – это продукты, которые вы, вероятно, употребляете каждый день. [3]
| Продукты | Лейцин на 100 г |
|---|---|
Сывороточный протеин Whey | 10 – 12 г |
Соевый протеин | 7,5 – 8,5 г |
Соевые бобы | 2,87 г |
Говядина | 1,76 г |
Арахис | 1,67 г |
Лосось | 1,62 г |
Миндаль | 1,49 г |
Куриная грудка | 1,48 г |
Яйца | 1,4 г |
Чечевица | 0,65 г |
Нут (турецкий горох) | 0,63 г |
Оптимальная доза лейцина составляет 2000-5000 мг в день. Лейцин следует принимать натощак или вместе с едой с низким содержанием белка, которая, следовательно, содержит меньшее количество лейцина. [1]
Лейцин следует принимать натощак или вместе с едой с низким содержанием белка, которая, следовательно, содержит меньшее количество лейцина. [1]
Если вы занимаетесь спортом и хотите эффективно использовать лейцин для роста мышц и максимизировать его эффект, вам следует выполнить следующие шаги [4]:
- Потребляйте 2,5 г лейцина (или 5 г BCAA) за 30 минут до тренировки, чтобы поддержать анаболизм.
- Добавьте еще 5 г лейцина (или 10 г BCAA) к протеиновому коктейлю после тренировки. Добавление лейцина к сывороточному протеину может быть очень эффективным для дальнейшей стимуляции синтеза белка.
- Потребляйте 5 г лейцина перед сном, чтобы ускорить восстановление после тренировки.
- Потребляйте лейцин между приемами пищи, так как он может помочь быстро восстановить мышцы. Поэтому люди, которые соблюдают диету и пытаются нарастить мышечную массу, должны включать в свой рацион 2-3 г лейцина. Таким образом удастся побороть катаболизм и предотвратить распад мышц.

В основном, лейцин не вызывает серьезных побочных эффектов, если не потреблять избыточное количество. Одно исследование, с участием 5 здоровых мужчин, которые принимали 1250 мг лейцина на килограмм массы тела, что в 25 раз превышало среднюю дневную норму, показало, что такие высокие дозы лейцина вызывали увеличение концентрации аммиака в организме. В результате этого исследования, выявили максимальную дозу потребления лейцина – 500 мг / кг массы тела в день. [12]
Однако лейцин может влиять на действие некоторых лекарств. Например, доза 30 г лейцина в день оказывает неблагоприятное воздействие на витамин В6 и В3. Избыток лейцина не позволяет организму вырабатывать эти витамины, которые могут привести к заболеваниям из-за их недостатка. Одним из таких заболеваний является пеллагра, симптомом которой являются поражения кожи, выпадение волос и проблемы с желудком. [7] [13]
[7] [13]
Потребление лейцина с источником глюкозы повышает уровень инсулина и снижает уровень сахара в крови. Потребление лейцина наряду с диабетическим лечением, таким как инъекции инсулина, может удерживать сахар на очень низком уровне. Поэтому пациентам с гипогликемией не следует принимать лейцин. Все пациенты с диабетом должны проконсультироваться с врачом перед приемом лейцина. [7] Также, лейцин в качестве пищевой добавки не следует принимать беременным и кормящим женщинам.
Мы надеемся, что мы помогли Вам узнать о том, как сделать потребление лейцина еще более эффективным для роста мышц и быстрой регенерации. Напишите нам в комментарий используете ли Вы добавки лейцина и каков Ваш опыт их потребления. Если вам понравилась статья и она была полезной, поддержите нас репостом.
Источники:[1] Kamal Patel – Leucine – https://examine. com/supplements/leucine/
com/supplements/leucine/
[2] Shimomura Y, Yamamoto Y, Bajotto G, Sato J, Murakami T? Shimomura N, Kobayoshi H, Mawatari K – Nutraceutical effects of branched-chain amino acids on skeletal muscle. – https://www.ncbi.nlm.nih.gov/pubmed/16424141
[3] Malia Frey – What is leucine? A guide to leucine foods and leucine supplements – https://www.verywellfit.com/how-to-use-leucine-for-weight-loss-3495727
[4] Jonathan Mike – Supplemental leucine: How it powers muscle growth – https://www.bodybuilding.com/fun/supplemental-leucine-how-it-powers-muscle-growth.html
[5] Mero A – Leucine supplementation and intensive training – https://www.ncbi.nlm.nih.gov/pubmed/10418071
[6] Balage M, Dardevet D – Long-term effects of leucine supplementation on body composition – https://www.ncbi.nlm.nih.gov/pubmed/20110810
[7] Leucine – dosage, benefits and side effects – https://us.myprotein.com/thezone/supplements/leucine-dosage-benefits-side-effects/
[8] Casperson SL, Sheffield-Moore M, Hewlings SJ, Paddon-Jones D – Leucine supplementation chronically improves muscle protein synthesis in older adults consuming the RDA for protein.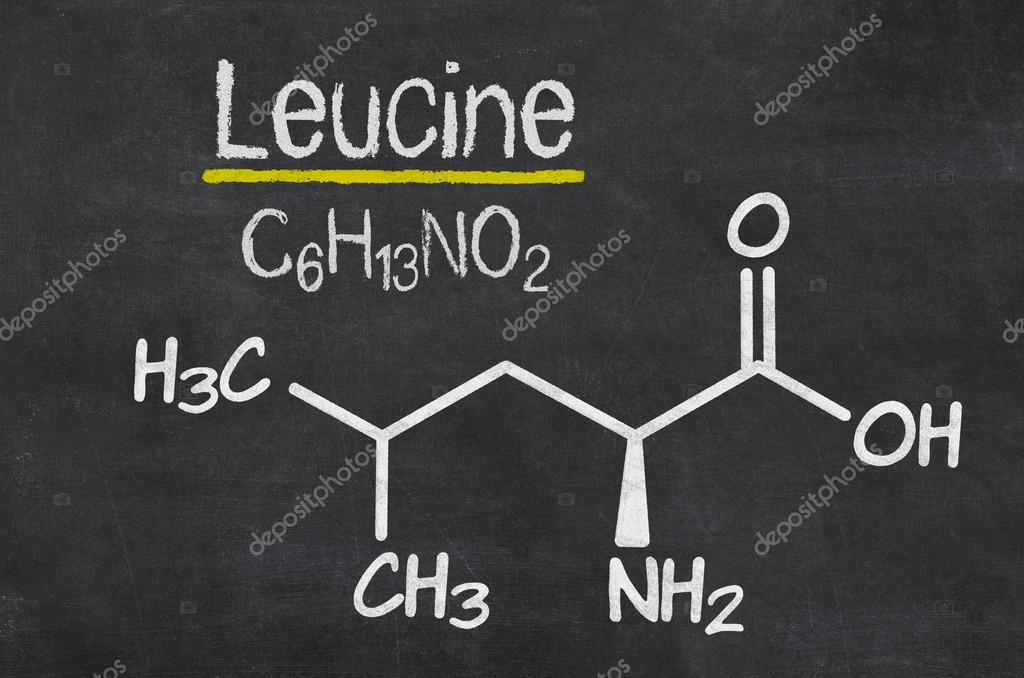 – https://www.ncbi.nlm.nih.gov/pubmed/22357161
– https://www.ncbi.nlm.nih.gov/pubmed/22357161
[9] Rachael Link – Leucine: The muscle-building amino acid your body needs – https://draxe.com/leucine/
[10] Dontao J Jr, Pedrosa RG, Cruzat VF, Pires IS, Tirapegui J – Effects of leucine supplementation on the body composition and protein status of rats submitted to food restriction. – https://www.ncbi.nlm.nih.gov/pubmed/16600817/
[11] Joao A. B. Pedroso, Thais T: Zampieri, Jose Donato Jr. – Reviewing the effects of l-leucin supplementation in the regulation of food intake, energy balance and glucose homeostasis – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4446786/
[12] Elango R, Chapman K, Rafi M, Ball RO, Pencharz PB – Determination of the tolerable upper intake level of leucine in acute dietary studies in young men. – https://www.ncbi.nlm.nih.gov/pubmed/22952178
[13] University Rochester medical center – Leucine – https://www.urmc.rochester.edu/encyclopedia/content. aspx?contenttypeid=19&contentid=Leucine
aspx?contenttypeid=19&contentid=Leucine
[14] Joao A. B. Pedroso, Thais T: Zampieri, Jose Donato Jr. – Reviewing the effects of l-leucin supplementation in the regulation of food intake, energy balance and glucose homeostasis – https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4446786/
[15] Layman DK – Role of leucine in protein metabolism during exercise and recovery. – https://www.ncbi.nlm.nih.gov/pubmed/12501002
[16] Thomson JS, Ali A, Rowlands DS – Leucine-protein supplemented recovery feeding enhances subsequent cycling performance in well-trained men. – https://www.ncbi.nlm.nih.gov/pubmed/21609286
[17] Kalogeropoulou D, Lafave L, Schweim K, Gannon MC, Nuttall FQ – Leucine, when ingested with glucose, synergistically stimulates insulin secretion and lowers blood glucose. – https://www.ncbi.nlm.nih.gov/pubmed/19013300
[18] Liu H, Liu R, Li X, Wang X, May Y, Guo H, Hao L, Yao P, Liu L, Wang D, Yang X – Leucine facilitates the insulin-stimulated glucose uptake and insulin signaling in skeletal muscle cells: involving mTORC1 and mTORC2.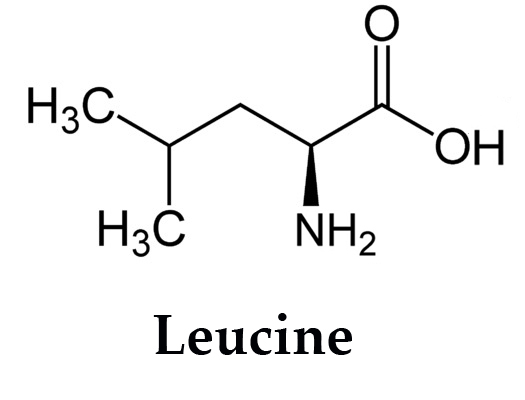 – https://www.ncbi.nlm.nih.gov/pubmed/24806638
– https://www.ncbi.nlm.nih.gov/pubmed/24806638
[19] Joe Cohen – Top 7 health benefits of leucine + side effects – https://selfhacked.com/blog/leucine-health-benefits-side-effects/
[20] Buse MG, Reid SS – Leucine. A possible regulator of protein turnover in muscle. – https://www.ncbi.nlm.nih.gov/pubmed/1237498
[21] Churchward-Venne TA, Breen L, Di Donato DM, Hector AJ, Mitchell CJ, Moore DR? Stellingwerff T, Breuille D, Offord EA, Baker SK, Phillips SM – Leucine supplementation of a low-protein mixed macronutrient beverage enhances myofibrillar protein synthesis in young men: a double-blind, randomized trial. – https://www.ncbi.nlm.nih.gov/pubmed/24284442
[22] Anthony JC, Yoshizawa F, Anthony TG, Vary TC, Jefferson LS, Kimball SR – Leucine stimulates translation initiation in skeletal muscle of postabsorptive rats viac a rapamycin-sensitive pathway. – https://www.ncbi.nlm.nih.gov/pubmed/11015466
[23] Crozier SJ, Kimball SR, Emmert SW, Anthony JC, Jefferson LS – Oral leucine administration stimulates protein synthesis in rat skeletal muscle. – https://www.ncbi.nlm.nih.gov/pubmed/15735066
– https://www.ncbi.nlm.nih.gov/pubmed/15735066
[24] Bolster DR, Crozier SJ, Kimball SR, Jefferson LS – AMP-activated protein kinase supresses protein synthesis in rat skeletal muscle through down-regulated mammalian target of rapamycin (mTOR) signaling. – https://www.ncbi.nlm.nih.gov/pubmed/11997383
[25] Koopman R, Wagenmakers AJ, Manders RJ, Zorenc AH, Senden JM, Gorselink M, Keizer HA, van Loon LJ – Combined ingestion of protein and free leucine with carbohydrate increases postexercise muscle protein synthesis in vivo in male subjects. – https://www.ncbi.nlm.nih.gov/pubmed/15562251
Аминокислота лейцин – ее важность и роль в спорте
Лейцин, это незаменимая алифатическая аминокислота с разветвленной цепочкой, а за своим объемом одна из самых больших аминокислот.Для всех природных белков, основной составляющей является Лейцин, который также принимает активное участие в распаде и синтезе протеина. Что касается человеческого организма, то в нем лейцин содержится в существенных количествах в почках, печени, селезенке, поджелудочной железе, в мышечных тканях и клетках, а также в составе белков сыворотки крови.
Лейцин является незаменимой аминокислотой, которая не синтезируется клетками организма, а в организм поступает исключительно с белками, которые входят в состав натуральной пищи. Нехватка или отсутствие лейцина в организме человека может привести к снижению массы тела, остановке развития и роста, а также к нарушению обмена веществ.
Пищевыми источниками лейцина являются: лесные орехи, бобы, соевая мука, коричневый рис, яичные белки, мясо (куриные грудки, лосось, говяжье филе) и цельная пшеница.
В зависимости от уровня нагрузок и образа жизни, потребность организма человека в лейцине может составлять от 6 до 15 г в сутки.
Биологическая роль лейцина
- снижает в крови уровень сахара;
- обеспечивает азотистый баланс;
- предотвращает появление усталости;
- необходим для нормального развития и построения мышечных тканей;
- защищает ткани и клетки мышц от постоянно распада;
- на клеточном уровне, является специфическим источником энергии;
- способствует укреплению иммунной системы и быстрому заживлению ран.

Применение
На сегодняшний день лейцин в сочетании с метионином, глютаминовой кислотой и другими аминокислотами, активно используют для лечения болезней печени, мышечной дистрофии, анемии, при синдроме Менкеса и некоторых формах токсикоза.
Лейцин и спортивное питание
Лейцин относится к «BCAA аминокислотам» (изолейцин, лейцин и валин). Благодаря множеству исследований доказано, что из всех аминокислотой, самой эффективной является лейцин. Благодаря именно подъему уровня этого вещества, после приема пищи он и выступает неким сигналом для соединения белков с мышечными клетками.
Существует множество научных доказательств того, что у спортсменов при приеме таких аминокислот, во время тренировок снижается уровень расщепления мышечного белка, при этом лейцин оказывает мощное влияние в скелетных мышцах на анаболизм. Помимо того, BCAA способствуют ослаблению мышечной утомляемости после тренировок и способствуют быстрому восстановлению организма после выматывающих тренировок в зале.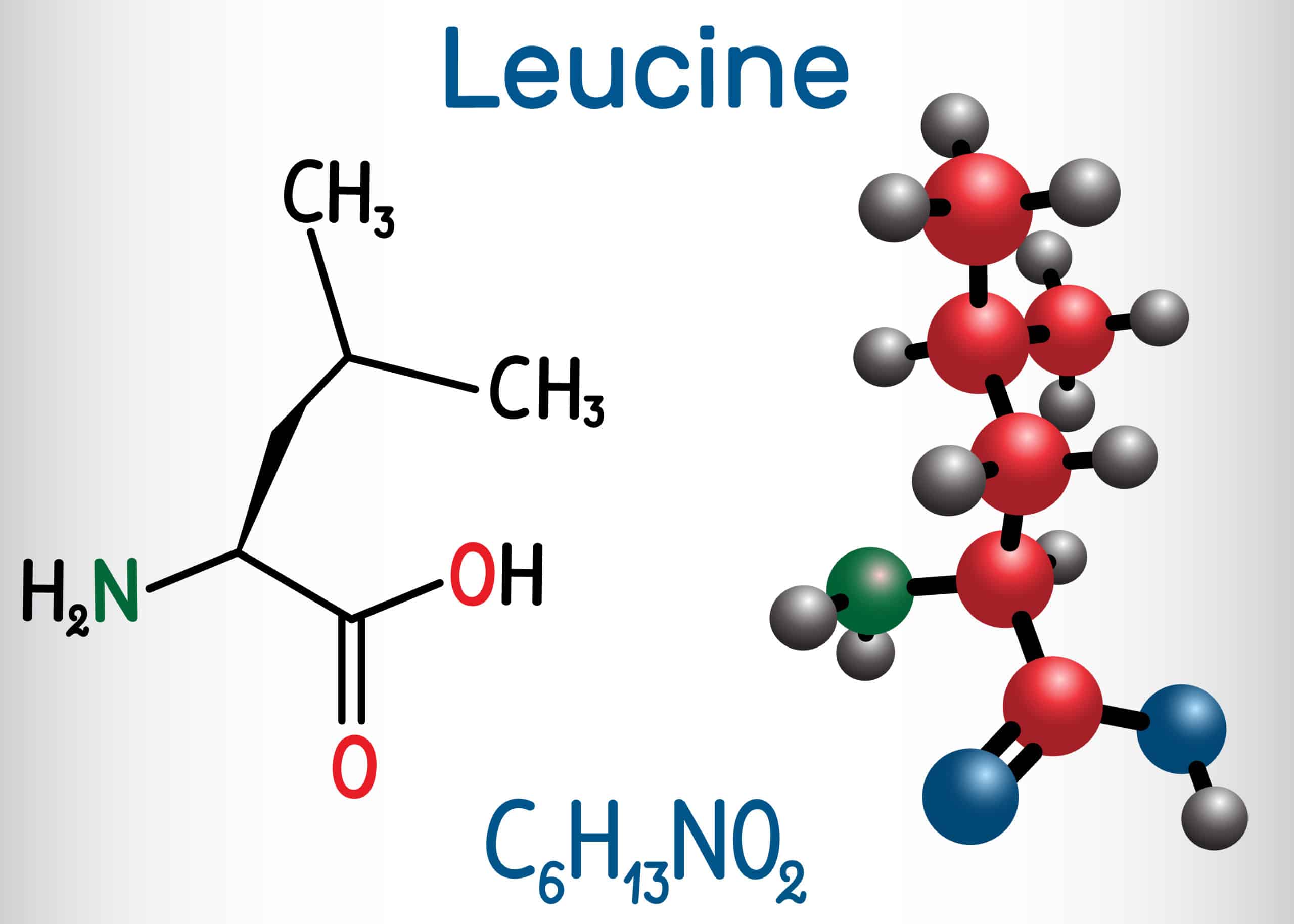
Регулирование уровня глюкозы
К образованию аминокислот аланина и глютамина (которые являются важными элементами в процессе поддержки в организме уровня глюкозы), приводит распад лейцина в скелетной мышце.
Благодаря довольно таки продолжительному циклу в организме человека образуется печеночная глюкоза, где этот элемент является исходным материалом для ее образования. А это означает, что человек с помощью лейцина может садиться на любую низко углеводную диету с целью поддержания в крови здорового уровня глюкозы.
Выводы
В итоге мы можем сделать вывод, что лейцин, это эффективное вспомогательное средство, которое во время разных диет повышает работоспособность человека. А также прием его и других аминокислот, таких как BCAA помогает спортсменам не только увеличивать мышечную массу или уменьшать жировые отложения, но и повышает выносливость и улучшает качество выполнения упражнений в процессе тренировки.
Лейцин | Химия онлайн
Лейцин – одна из незаменимых аминокислот, которые не синтезируются клетками животных и человека и поступают в организм в составе белков пищи. Лейцин входит в состав всех природных белков.
Лейцин входит в состав всех природных белков.
Лейцин относится к трем разветвленным аминокислотам.
Лейцин является одним из самых крупных среди аминокислот. Он относится к неполярным гидрофобным аминокислотам.
По строению соединений, получающихся при расщеплении углеродной цепи протеиногенных аминокислот, различают глюкопластичные (глюкогенные) и кетопластичные (кетогенные) аминокислоты. Единственной кетопластичной аминокислотой является лейцин.
Лейцин, является строительным материалом белковой молекулы, построенной из остатков аминокислот, связанных в полимерные цепи. В человеческом организме 5 миллионов белков, причем ни один из белков человека не идентичен с белком любого другого живого организма.
Лейцин входит в состав всех белков животных и растений, а также является одним из промежуточных продуктов синтеза и распадения белковых веществ. Широко распространен в животных организмах и в растениях; у человека, встречается в поджелудочной железе, селезенке, печени, почках, в составе белков сыворотки крови, в мышечной ткани.
Лейцин — 2-амино-4-метилпентановая или α-амино-изокапроновая кислота.
Лейцин (Лей, Leu, L) — алифатическая аминокислота с химической формулой HO2CCH (NH2) CH2CH (CH3)2.
Алифатическая цепь разветвлена, в ней 3 звена. Лейцин не имеет заряда и ароматического ядра.
Лейцин выделен в 1820 году из мышечной ткани А. Браконно.
Суточная потребность человека в лейцине составляет 4-6 грамм.
Физические свойстваЛейцин представляет собой белые кристаллы или кристаллический порошок с перламутровым блеском, без запаха и со слегка ощущаемым вкусом. Ограниченно растворяется в воде, плохо в этаноле, растворяется в водных растворах кислот и щелочей, не растворяется в диэтиловом эфире. Температура плавления 293-2950C (с разл.).
Основные функцииЛейцин участвует в обеспечении азотистого равновесия, в обмене белков и углеводов. Предохраняет мышцы и другие ткани, за исключением костной, от постоянного распада. Служит специфическим источником энергии для мышц на клеточном уровне.
Предохраняет мышцы и другие ткани, за исключением костной, от постоянного распада. Служит специфическим источником энергии для мышц на клеточном уровне.
Лейцин необходим для построения и развития мышечной ткани, синтеза протеина организмом, для укрепления иммунной системы. Понижает содержание сахара в крови и способствует быстрейшему заживлению ран и срастанию костей.
Лейцин предотвращает перепроизводство серотонина и наступление усталости, связанное с этим процессом.
МетаболизмМетаболизм лейцина играет важнейшую роль в цепи превращений свободных аминокислот в организме человека. В отличие от других аминокислот, метаболизируемых главным образом в печени, лейцин утилизируется в мышцах и почках.
Метаболизм лейцина стимулирует рост мышц и одновременно подавляет дальнейшую потерю мышечной массы.
Биологическая рольДействуя вместе с валином и изолецином он защищает мышечные ткани и является источниками энергии, а также способствует восстановлению костей, кожи, мышц, поэтому его прием рекомендуют в восстановительный период после травм и операций.
Лейцина способен стимулировать секрецию инсулина.
Инсулин –гормон, напрямую участвующий в транспорте глюкозы и аминокислот в клетки. Таким образом, поступление достаточного количества аминокислот напрямую усиливает синтез белка и стимулирует рост клеток.
Лейцин участвует в секреции гормона роста. Секреция гормона роста особенно высока в период полового созревания. Гормон роставлияет на рост костей, хрящей, сухожилий, связок и мышц, в меньшей степени — висцеральных органов. Он также тормозит рост жировой клетчатки. Выделяется гормон роста особенно интенсивно ночью, во время глубокой фазы сна, и в первые несколько часов после засыпания.
Природные источникиКоричневый рис, бобы, лесные орехи, соя, сыр (твердый, моцарелла), яйца, пшеница, мясо (говядина, свинина, индейка, курица), печень говяжья, рыба (семга, кета, лосось), кальмар филе, чечевица, фасоль белая, маш, горох.
Избыток лейцина может увеличить количество аммиака в организме. Также избыток лейцина способен нарушать метаболизм белков, чем негативно влияет на увеличение мышечной массы.
Также избыток лейцина способен нарушать метаболизм белков, чем негативно влияет на увеличение мышечной массы.
Недостаток лейцина может быть обусловлен либо неудовлетворительным питанием, либо нехваткой витамина B6. Отсутствие или недостаток лейцина приводит к отрицательному балансу азота и прекращению роста у детей. к падению массы тела, нарушениям обмена веществ, при острой недостаточности — к гибели организма. Его дефицит может спровоцировать гипогликемию у младенцев.
Области примененияЛейцин вместе с глутаминовой кислотой, метионином и др. аминокислотами применяется при лечении заболеваний печени, анемии, токсикозах, невритах, мышечной дистрофии, полиомиелите, а также при некоторых психических заболеваниях.
Способствует лечению костей, кожи и мышечной ткани и рекомендуется в период восстановления после хирургических операций и травм.
Лейцин используется для понижения уровня сахара в крови и стимуляции выделения гормона роста. Как противошоковое средство, т.к. лейцин одна из трех аминокислот которые, не изменяясь, проходят через печень и поступают в мозг.
Как противошоковое средство, т.к. лейцин одна из трех аминокислот которые, не изменяясь, проходят через печень и поступают в мозг.
Лейцин необходим для роста как стимулятор синтеза белка в мышцах, людям страдающим алкогольной и наркотической зависимостью.
В сельском хозяйстве кормовой лейцин используется в качестве добавки к основному корму с целью его влияния на увеличение привеса животных.
Лейцин в спортеЛейцин для спортсменов играет особую роль. Лейцин выполняет важную роль в создании новых мышечных тканей в организме, способствует увеличению синтеза белка. В то же время лейцин подавляет разрушение белковых молекул, что очень важно для мышечного роста.
Таким образом, можно уменьшить распад белков после интенсивных тренировок при увеличении потребления лейцина.
Лейцин немаловажен и в процессах получения энергии. Он косвенно экономит запасы глюкозы и подавляет их разрушение. Лейцин предотвращает мышечный катаболизм (разрушение). Комбинированный прием всех трех аминокислот с разветвленными боковыми цепями (лейцин, изолейцин и валин (ВСАА)) особенно эффективен.
Комбинированный прием всех трех аминокислот с разветвленными боковыми цепями (лейцин, изолейцин и валин (ВСАА)) особенно эффективен.
Биологически активные пищевые добавки, содержащие лейцин, применяются в комплексе с валином и изолейцином (BCAA). Их следует принимать с осторожностью, чтобы не вызвать гипогликемии.
Прием лейцина лишь в изолированном виде, разделенный на несколько порций в течение дня, не имеет смысла.
Избыток лейцина способен нарушать метаболизм белков, чем негативно влияет на увеличение мышечной массы. Поэтому рекомендуется принимать лейцин в сочетании с другими аминокислотами или белками пищи, сывороточным протеином, или просто овсяной кашей.
Чтобы лейцин, изолейцин и валин усваивались полностью, в организм должно быть обеспечено достаточное поступление витаминов из группы В. Прежде всего, это витамины В5 и В6. Без этих двух витаминов оптимальный белковый обмен в печени не может быть осуществлен в полной мере.
Заметные практически сразу результаты могут быть достигнуты с BCAA или лейцином только в случае использования их как лекарство для лечения некоторых болезней. Положительное действие BCAA оказывают при заболеваниях печени (цирроз, дистрофия), при фенилкетонурии, при психических болезнях (шизофрения).
Уровень белка плазмы крови альбумина зависит от концентрации ВСАА в крови. Уменьшение концентрации лейцина, изолейцина и валина приводит к падению в плазме уровня альбумина. Это, в свою очередь, означает, что осмотическое давление крови падает. Такая ситуация может привести к задержке жидкости и отекам. Таким образом, BCAA поддерживают и водный обмен в организме.
Лекарственные препаратыЛейцин
Лейцин оказывает иммуностимулирующее действие, активирует процессы биосинтеза аминокислот, их предшественников и метаболитов. Ослабляет нарушения обмена веществ, возникающие при стрессе. Является исходным веществом для синтеза белка.
Аминокислоты
Классификация аминокислот
Пищевые аминокислоты — Компания НЕО Кемикал
Аминокислоты — основной элемент построениях всех белков. Они делятся на заменимые, незаменимые и условно незаменимые.
Незаменимые аминокислоты – те аминокислоты, которые не могут быть синтезированы в организме человека и должны поступать в организм с пищей.
Условно незаменимыми кислотами называются аминокислоты, которые синтезируются организмом человека при определенных условиях. Часто организм испытывает недостаток этих аминокислот.
К заменимым относятся аминокислоты, которые наш организм способен синтезировать самостоятельно.
ВСАА — это комплекс из трех незаменимых аминокислот: L-лейцин, L-изолейцин и L-валин, основной материал для построения новых мышц. Составляют 35% всех аминокислот в мышцах и принимают важное участие в процессах анаболизма и восстановления, обладают антикатаболическим действием. BCAA не могут синтезироваться в организме, поэтому получать человек их может только с пищей и специальными добавками. BCAA в первую очередь метаболируются в мышцах, их можно рассматривать как основное «топливо» для мышц, которое повышает спортивные показатели, улучшает состояние здоровья, к тому же они абсолютно безопасны.
BCAA не могут синтезироваться в организме, поэтому получать человек их может только с пищей и специальными добавками. BCAA в первую очередь метаболируются в мышцах, их можно рассматривать как основное «топливо» для мышц, которое повышает спортивные показатели, улучшает состояние здоровья, к тому же они абсолютно безопасны.
L — Валин — Один из главных компонентов в росте и синтезе тканей тела. Вместе с лейцином и изолейцином служит источником энергии в мышечных клетках, а также препятствует снижению уровня серотонина. Также необходим для поддержания нормального обмена азота в организме, входит в состав практически всех известных белков, является незаменимой аминокислотой не синтезируется в организме человека и поэтому должен поступать с пищей. Входит в состав ВСАА.
L — Лейцин — Лейцин входит в состав природных белков, применяется для лечения болезней печени, анемий и других заболеваний. В среднем суточная потребность организма в лейцине для здорового человека составляет 4-6 грамм. Входит в состав ВСАА и многих БАД
Входит в состав ВСАА и многих БАД
L — Изолейцин — это аминокислота входящая в состав всех природных белков. Является незаменимой аминокислотой, что означает, что изолейцин не может синтезироваться в организме человека и должен поступать в него с пищей. Участвует в энергетическом обмене..
L — Глутамин – одна из 20 стандартных аминокислот, входящих в состав белка. Самая распространенная аминокислота организма, мышцы состоят из неё на 60%. Широко используется в спортивном питании и при производстве БАД.
Креатин – Креатин чаще всего используется для повышения эффективности физических нагрузок и увеличения мышечной массы у спортсменов. Существуют научные исследования, поддерживающие использование креатина для улучшения спортивной активности молодых и здоровых людей во время кратковременной интенсивной активности и нагрузки
Незаменимые аминокислоты. Справка — РИА Новости, 28.02.2011
Валин необходим для метаболизма в мышцах, он активно участвует в процессах восстановления поврежденных тканей.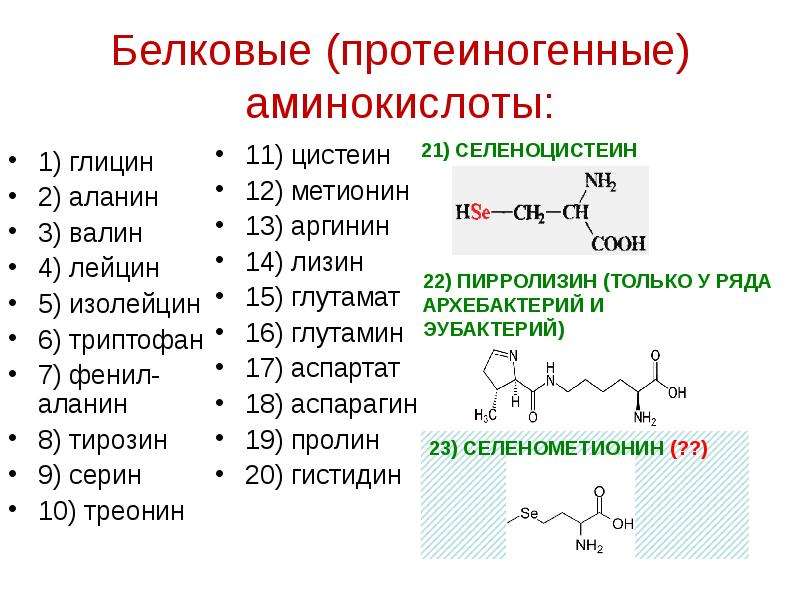 Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Помимо этого, он может быть использован мышцами в качестве дополнительного источника энергии. Валином богаты зерновая пища, мясо, грибы, молочные продукты, а также арахис.
Лизин необходим для нормального формирования костей и роста детей, способствует усвоению кальция и поддержанию нормального обмена азота у взрослых. Лизин участвует в синтезе антител, гормонов, ферментов, формировании коллагена и восстановлении тканей. Пищевыми источниками лизина являются сыр, яйца, рыба, молоко, картофель, красное мясо, соевые и дрожжевые продукты.
Лейцин защищает мышечные ткани и может являться источником энергии. Его наличие способствует восстановлению костей, кожи, мышечной ткани. Снижает уровень холестерина. К пищевым источникам лейцина относятся бурый рис, бобовые, мясо, орехи.
Изолейцин необходим для синтеза гемоглобина, увеличивает выносливость и способствует восстановлению мышц. К пищевым источникам изолейцина относятся куриное мясо, кешью, яйца, рыба, чечевица, мясо, рожь, миндаль, нут (турецкий горох), печень, соя.
Треонин способствует поддержанию нормального белкового обмена в организме, помогая при этом работе печени. Необходим организму для правильной работы иммунной системы. Содержится в яйцах, молочных продуктах, бобах и орехах.
Метионин способствует нормальному пищеварению, сохранению здоровой печени, участвует в переработке жиров, защищает от воздействия радиации. Метионин содержится в бобовых, яйцах, чесноке, луке, йогурте мясе.
Фенилаланин является нейромедиатором для нервных клеток головного мозга. Эффективно помогает при депрессии, артрите, мигрени, ожирении. Не усваивается организмом, которому не хватает витамина С. Содержится в говядине, курином мясе, рыбе, соевых бобах, яйцах, твороге, молоке, а также является составной частью синтетического сахарозаменителя — аспартама.
Триптофан используется организмом для синтеза в головном мозге серотонина, который в свою очередь является важнейшим нейромедиатором. Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Необходим при бессоннице, депрессии и для стабилизации настроения. Снижает вредное воздействие никотина. В пище эта аминокислота находится в буром рисе, деревенском сыре, мясе, бананах, йогурте, сушеных финиках, курице, кедровых орехах и арахисе.
Потребность человека в незаменимых аминокислотах составляет от 250 до 1100 миллиграммов в сутки. Существуют биологически активные добавки, содержащие необходимые дозы этих веществ. Особо внимание восполнению их в организме рекомендуется уделять вегетарианцам (поскольку некоторые незаменимые аминокислоты в необходимых количествах содержатся только в продуктах животного происхождения), беременным женщинам и спортсменам.
Материал подготовлен на основе информации открытых источников
Смотрите полный выпуск программы «Сытые и стройные» с Маргаритой Королевой: «Пища для мозга, или Что надо есть, чтобы ничего не забывать» >>
Аминокислоты для мозга — Золотой Кубок
Белок является важнейшей частью тканей
организма. Белки состоят из аминокислот, которые крайне важны для нормального
функционирования внутренних органов, в том числе головного мозга. Аминокислоты
поддерживают работу ЦНС, контролируют настроение, эмоции. Достаточное
количество этих элементов улучшает память, повышает умственные способности,
восприимчивость к информации.
Белки состоят из аминокислот, которые крайне важны для нормального
функционирования внутренних органов, в том числе головного мозга. Аминокислоты
поддерживают работу ЦНС, контролируют настроение, эмоции. Достаточное
количество этих элементов улучшает память, повышает умственные способности,
восприимчивость к информации.
Чтобы все органы и системы работали исправно, требуется достаточно много различных аминокислот, но для мозга необходимы лишь некоторые из них, а именно глутаминовая кислота, тирозин, триптофан и глицин, о котором слышали многие. Их называют нейромедиаторами, поскольку они являются передатчиками нервных импульсов в мозге, отвечают за работу ЦНС и память.
Есть и другие элементы, отвечающие за состояние психики и эмоции. От них зависит настроение человека в конкретный момент, а также внимание. Часть из них участвуют в производстве нейромедиаторов.
Также существуют аминокислоты, которые
позволяют человеку переносить эмоциональные нагрузки, стрессы, то есть отвечают
за способность нервной системы противостоять негативным факторам.
Незаменимые аминокислоты для мозга
Аминокислоты делят на заменимые и незаменимые. Вторые не производятся в организме. Для того, чтобы поддерживать их достаточное количество, нужно правильно питаться, принимать специальные добавки при необходимости. Эти аминокислоты стоит рассмотреть отдельно.
Изолейцин
Эта аминокислота имеет разветвленное строение молекулы. Изолейцин играет важную роль для поддержания психической и физической выносливости организма. Также среди функций этого элемента поддержание в норме уровня гемоглобина в крови и регуляция уровня глюкозы.
Изолейцин крайне важен как при высоких
физических нагрузках, так и при стрессах, психических заболеваниях. Его
применяют при лечении болезни Паркинсона. Дефицит изолейцина проявляется в виде
тревожности, обмороков и головокружения, беспричинного беспокойства, усталости,
тахикардии, повышенной потливости. Также человек начинает быстро терять
мышечную массу. Избыток может привести к аллергическим реакциям, сгущению
крови.
Организм нуждается в изолейцине (3-4 г в сутки). Содержится эта аминокислота в миндале и кешью, курице, яйцах, бобовых, сое, рыбе, печени. Большое количество изолейцина содержится в молочных продуктах, морепродуктах, мясе.
Лейцин
Данная аминокислота не оказывает прямого воздействия на работу мозга, но играет важную роль для поддержания психического равновесия, а также отвечает за восстановление мышечной и костной ткани. Часто эту аминокислоту рекомендуют принимать после травм. Лейцин содержится в рисе, бобовых, сое, пшенице, мясных продуктах.
Лизин
Эта аминокислота входит в состав
практически всех белков в человеческом организме. Для восстановления тканей она
необходима. Человек, который страдает от дефицита лизина, испытывает раздражительность,
плаксивость, слабость, плохо ест, у него выпадают волосы, нарушается внимание,
замечается снижение веса, появляются проблемы с репродуктивной функцией. Также
лизин играет важную роль в создании гормонов, ферментов в организме,
поддерживает иммунитет.
Особенно важен лизин для детей, у которых растут кости. Аминокислота улучшает усвоение кальция в организме. Богаты лизином яйца, молочные продукты, картофель, дрожжи, соя, говядина.
Метионин
Эта аминокислота крайне важна для здоровых суставов и выведения вредных веществ из организма. Метионин рекомендуют принимать при интоксикации (алкогольной или химической). Также аминокислоту назначают женщинам при сильном токсикозе.
Для здоровья организма необходимо получать по 2-4 г метионина в сутки. Дефицит этого элемента приведет к отекам, слабости мышечных тканей, проблемам с органами ЖКТ, печенью, задержке развития плода во время беременности.
Содержат метионин бобы, куриные яйца, мясные продукты, кисломолочные продукты, лук и чеснок.
Фенилаланин
Особенность этой аминокислоты в том,
что в организме она способна преобразовываться и принимать участие в синтезе
нейромедиатора. Поэтому можно сказать, что фенилаланин оказывает воздействие на
настроение человека, его восприимчивость к боли, способность обучаться и
запоминать. Недостаток этой аминокислоты может привести к сильнейшим депрессии,
гормональным сбоям, снижению умственных способностей. Синтетический фенилаланин
назначают людям с артритом, депрессией, болезненными месячными, мигренями и
ожирением, так как этот элемент способен снижать аппетит.
Недостаток этой аминокислоты может привести к сильнейшим депрессии,
гормональным сбоям, снижению умственных способностей. Синтетический фенилаланин
назначают людям с артритом, депрессией, болезненными месячными, мигренями и
ожирением, так как этот элемент способен снижать аппетит.
Можно найти фенилаланин в следующих продуктах: говядина, курица, морепродукты, молочные продукты.
Треонин
Эта аминокислота играет очень важную роль в белковом и жировом обмене, стимулирует работу иммунной системы. Для взрослого достаточной дозой треонина является 0,5 г в сутки. Если аминокислоты недостаточно, это приводит к слабости мышц и уменьшению мышечной массы, депрессивным состояниям, снижению внимания.
Достаточно большое количество треонина содержится в куриных яйцах, молочных продуктах, говядине. В зерновых его мало, поэтому люди, отказывающиеся от употребления мяса, страдают от дефицита треонина гораздо чаще.
Триптофан
В организме эта аминокислота
превращается в важный нейромедиатор, отвечающий за состояние эмоционального
благополучия. При недостатке триптофана развивается депрессивное состояние,
подавленность, беспричинная тревожность, мигрень. Если у человека есть
бронхиальная астма, дефицит этой аминокислоты усилит приступы.
При недостатке триптофана развивается депрессивное состояние,
подавленность, беспричинная тревожность, мигрень. Если у человека есть
бронхиальная астма, дефицит этой аминокислоты усилит приступы.
Триптофан часто используют и как снотворное. Его желательно принимать с пищей. Аминокислоты достаточно много в молочных продуктах, растительных маслах, бананах. Поэтому сложилось мнение, что стакан молока на ночь помогает заснуть. Также эта аминокислота содержится в овсянке, арахисе, морепродуктах, курице, индейке.
Прием триптофана в синтетическом виде давно запрещен, так как он был признан опасным для сердца.
Валин
Данная аминокислота играет важную роль
в стимуляции умственной деятельности и поддержании координации. Валин способствует
скорому заживлению поврежденных тканей. Дефицит валина становит заметен по
причине повышения чувствительности кожи и нарушения координации движения. У
людей с недостатком этого элемента часто развиваются кожные заболевания,
например, дерматит. Суточная норма аминокислоты 3-4 г.
Суточная норма аминокислоты 3-4 г.
Чтобы восполнить недостаток валина в организме, нужно есть больше сыра и творога, орехов, мяса и яиц.
Заменимые аминокислоты для мозга
Эта разновидность аминокислот синтезируется организмом самостоятельно, а также поступает с пищей.
Аланин
Мозгу для работы требуется много энергии, а данная аминокислота является ее источником. Также аланин поддерживает работу иммунитета и регулирует уровень глюкозы. Эта аминокислота очень часто используется в психиатрии, так как способствует снижению раздражительности и апатии, а также избавляет от мигреней. Способность аланина регулировать уровень глюкозы позволяет долго не ощущать голод.
Пища, богатая аланином, поможет восполнить дефицит: мясо, яйца, желатин, молочные продукты.
Аспарагин
Аминокислота выводит аммиак из
организма и защищает ЦНС от его токсического воздействия. Аспарагин регулирует
все процессы ЦНС, предотвращая ее излишнее возбуждение или торможение. Также
есть мнение, что этот элемент играет важную роль в сопротивлении организма усталости,
то есть повышает выносливость. Наибольшее количество аспарагина содержится в
мясе.
Также
есть мнение, что этот элемент играет важную роль в сопротивлении организма усталости,
то есть повышает выносливость. Наибольшее количество аспарагина содержится в
мясе.
Дефицит аминокислоты приводит к мышечным болям, заметному снижению работоспособности, ухудшению памяти. Однако избыток тоже опасен. Он может спровоцировать агрессию, проблемы со сном, головным болям.
Аргинин
Этот элемент участвует в синтезе инсулина и гормона роста, а также стимулирует защитные функции организма. Он очень важен для роста мышц, а также поддержания здоровья психики. Из-за активного воздействия на выработку гормона роста детям принимать аргинин не рекомендуется, чтобы не спровоцировать гигантизм. Также избыток аргинина вызывает проблемы с кожей и аллергические реакции, провоцирует тошноту и диарею.
Чтобы восполнить дефицит аргинина, необходимо есть горький шоколад, молочные продукты, пшеницу, орехи, желатин, овсянку.
Глицин
Глицин является ноотропом и известен
многим как средство от депрессии. Он способен нормализовать психоэмоциональное
состояние, улучшить память и способность к обучению. Дефицит глицина приводит в
первую очередь к недостатку энергии и хронической усталости. Люди с недостатком
этой аминокислоты часто испытывают проблемы с работой кишечника, плохо спят.
Он способен нормализовать психоэмоциональное
состояние, улучшить память и способность к обучению. Дефицит глицина приводит в
первую очередь к недостатку энергии и хронической усталости. Люди с недостатком
этой аминокислоты часто испытывают проблемы с работой кишечника, плохо спят.
Глицин применяют в синтетическом виде. В природе он содержится в говядине, печени, овсянке. Столкнуться с переизбытком глицина очень трудно, так как в организме он не скапливается, а свободно выводится.
Цистеин
Данная аминокислота защищает клетки мозга от токсического воздействия этилового спита и никотина, а также других вредных химических веществ. Также цистеин замедляет процессы старения в организме, облегчает клиническое проявление заболеваний. Недостаток может спровоцировать снижение иммунитета, кожные заболевания, выпадение волос, ломкость ногтей.
Цистеин присутствует в куриных яйцах, чесноке, луке, орехах и овсянке.
ГАМК
Содержание этой аминокислоты в тканях
головного мозга очень велико. Она оказывает противосудорожное и успокаивающее
действие. Часто назначается при патологиях головного мозга, снижении умственной
активности, хронической и тяжелой депрессии. К недостатку АМК приводит избыток
физической нагрузки в сочетании с неправильным питанием и низким количеством
питательных веществ в еде. Для восполнения дефицита этой аминокислоты
рекомендуют пить чай.
Она оказывает противосудорожное и успокаивающее
действие. Часто назначается при патологиях головного мозга, снижении умственной
активности, хронической и тяжелой депрессии. К недостатку АМК приводит избыток
физической нагрузки в сочетании с неправильным питанием и низким количеством
питательных веществ в еде. Для восполнения дефицита этой аминокислоты
рекомендуют пить чай.
Гистидин
Данная аминокислота полезна для восстановления тканей, роста организма. Она помогает бороться со стрессами, нормализует работу ЖКТ, защищает от инфекций, выводит тяжелые металлы из организма.
Избыток гистидина ведет к возникновению психозов и прочих психических недугов. Также эта аминокислота влияет на половое возбуждение. При дефиците гистидина половое влечение снижается, помимо этого могут возникнуть проблемы со слухом и усилиться тромбообразование. Гистидин содержится в рыбе, красном мясе, злаковых.
Глутаминовая кислота
Это важный нейромедиатор, оказывающий
ноотропный эффект и необходимый для нормальной работы головного мозга. Глютаминовая кислота служит источником энергии для клеток мозга. В
синтетическом виде ее назначают при эпилептических припадках, проблемах с
умственным развитием у детей. Дефицит глутаминовой кислоты может привести к
ранней седине, плохому настроению, снижению иммунитета. Глютаминовая кислота
содержится в мясных продуктах, знаковых, натуральном молоке.
Глютаминовая кислота служит источником энергии для клеток мозга. В
синтетическом виде ее назначают при эпилептических припадках, проблемах с
умственным развитием у детей. Дефицит глутаминовой кислоты может привести к
ранней седине, плохому настроению, снижению иммунитета. Глютаминовая кислота
содержится в мясных продуктах, знаковых, натуральном молоке.
Глютамин
Данная аминокислота выводит из организма аммиак и снижает его токсическое воздействие на организм. Он улучшает работу мозга, поэтому рекомендуется людям с эпилепсией, импотенцией, страдающим шизофренией.
Глютамин выпускают в синтетическом виде, однако такие препараты должны храниться как можно дальше от влаги, иначе будет выделяться аммиак. При серьезных заболеваниях печени такие препараты не назначаются.
Аминокислота содержится во многих пищевых продуктах, однако при термической обработке разрушается. Чтобы восполнить дефицит глютамина, рекомендуют есть сырую петрушку и шпинат.
Таурин
Защищает мозг от вредного воздействия. При гиперактивности у детей довольно часто назначают синтетический таурин.
Также он является частью лечения эпилепсии и беспричинного беспокойства.
Организм способен сам производить эту аминокислоту, если в организме нет
дефицита витамина В6. Также много таурина в мясных и молочных продуктах,
морепродуктах.
При гиперактивности у детей довольно часто назначают синтетический таурин.
Также он является частью лечения эпилепсии и беспричинного беспокойства.
Организм способен сам производить эту аминокислоту, если в организме нет
дефицита витамина В6. Также много таурина в мясных и молочных продуктах,
морепродуктах.
Аминокислоты (32 показателя) сдать в Подольске и Королёве
ОписаниеАминокислоты — это органические соединения, являющиеся строительным материалом для белков и мышечных тканей. Нарушение обмена аминокислот является причиной многих заболеваний (печени и почек). Анализ аминокислот (мочи и крови) является основным средством оценки степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических нарушений.
ПАланин (ALA), Аргинин (ARG), Аспарагиновая кислота (ASP), Цитруллин (CIT),
Глутаминовая кислота (GLU), Глицин (GLY),
Метионин (MET), Орнитин (ORN),
Фенилаланин (PHE), Тирозин (TYR), Валин
(VAL), Лейцин (LEU), Изолейцин (ILEU),
Гидроксипролин (HPRO), Серин (SER),
Аспарагин (ASN), a-аминоадипиновая к-та
(AAA), Глутамин (GLN), b-аланин (BALA),
Таурин (TAU), Гистидин (HIS), Треонин
(THRE), 1-метилгистидин (1MHIS),
3-метилгистидин (3MHIS), y-аминомасляная к-та (GABA), b-аминоизомасляная к-та (BAIBA), a-аминомасляная к-та (AABA),
Пролин (PRO), Цистатионин (CYST), Лизин
(LYS), Цистин (CYS), Цистеиновая кислота
(CYSA) — в крови
Аминокислоты представляют собой структурные химические единицы, образующие белки. В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей.
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них:
выполняют роль нейромедиаторов (биологически активные химические вещества, посредством которых осуществляется передача электрического импульса от нервной клетки) или являются их предшественниками;
способствуют тому, что витамины и минералы адекватно выполняют свои функции;
непосредственно снабжают энергией мышечную ткань;
участвуют в ферментативных реакциях, метаболизме многих биологических веществ, иммунных реакциях, процессах детоксикации, выполняют регуляторную функцию и многое другое.
Если человеческий организм испытывает нехватку одной из обязательных аминокислот, начинаются серьёзные проблемы – депрессия, ожирение, проблемы с пищеварением и так далее, вплоть до замедления роста.
В организме человека многие из аминокислот синтезируются в печени. Однако некоторые из них не могут быть синтезированы в организме, поэтому человек обязательно должен получать их с пищей.
Помимо того, что аминокислоты образуют белки, входящие в состав тканей и органов человеческого организма, некоторые из них:
выполняют роль нейромедиаторов (биологически активные химические вещества, посредством которых осуществляется передача электрического импульса от нервной клетки) или являются их предшественниками;
способствуют тому, что витамины и минералы адекватно выполняют свои функции;
непосредственно снабжают энергией мышечную ткань;
участвуют в ферментативных реакциях, метаболизме многих биологических веществ, иммунных реакциях, процессах детоксикации, выполняют регуляторную функцию и многое другое.
Если человеческий организм испытывает нехватку одной из обязательных аминокислот, начинаются серьёзные проблемы – депрессия, ожирение, проблемы с пищеварением и так далее, вплоть до замедления роста. Находятся в группе риска и спортсмены, поддерживающие положительный азотный баланс в организме искусственными средствами (анаболитическими препаратами), и вегетарианцы, и худеющие при помощи диет – в силу того, что они исключают из рациона многие необходимые продукты.
Анализ аминокислот (мочи и плазмы крови) является незаменимым средством оценки достаточности и степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических заболеваний почек, печени, сердечно-сосудистой системы, дыхательных органов и т.д.
Функция основных аминокислот:
Аминокислоты (12 показателей): Аланин, аргинин, аспарагиновая кислота, цитруллин, глутаминовая кислота, глицин, метионин, орнитин, фенилаланин, тирозин, валин, отношение – лейцин/изолейцин.
Аланин-нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота (витамин B5) и коэнзим А (производит энергию, необходимую для любого вида мышечной деятельности).
Находятся в группе риска и спортсмены, поддерживающие положительный азотный баланс в организме искусственными средствами (анаболитическими препаратами), и вегетарианцы, и худеющие при помощи диет – в силу того, что они исключают из рациона многие необходимые продукты.
Анализ аминокислот (мочи и плазмы крови) является незаменимым средством оценки достаточности и степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических заболеваний почек, печени, сердечно-сосудистой системы, дыхательных органов и т.д.
Функция основных аминокислот:
Аминокислоты (12 показателей): Аланин, аргинин, аспарагиновая кислота, цитруллин, глутаминовая кислота, глицин, метионин, орнитин, фенилаланин, тирозин, валин, отношение – лейцин/изолейцин.
Аланин-нормализует метаболизм углеводов. Является составной частью таких незаменимых нутриентов как пантотеновая кислота (витамин B5) и коэнзим А (производит энергию, необходимую для любого вида мышечной деятельности). Аланин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток, сигнализируют о начале синтазе антител). Он способствует детоксикационным процессам в печени (прежде всего обезвреживанию аммиака).
Аргинин — важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аспараги?н- амид аспарагиновой кислоты. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Аспарагиновая кислотаприсутствует в организме в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований, мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС и др.
Аланин замедляет рост опухолей, в том числе раковых, за счет стимуляции иммунной системы организма. Он повышает активность и увеличивает размер вилочковой железы, которая вырабатывает Т-лимфоциты (защищают организм от опухолевых клеток, сигнализируют о начале синтазе антител). Он способствует детоксикационным процессам в печени (прежде всего обезвреживанию аммиака).
Аргинин — важный компонент обмена веществ в мышечной ткани. Он способствует поддержанию оптимального азотного баланса в организме, так как участвует в транспортировке и обезвреживании избыточного азота в организме.
Аспараги?н- амид аспарагиновой кислоты. Путем образования аспарагина из аспарагиновой кислоты в организме связывается токсический аммиак.
Аспарагиновая кислотаприсутствует в организме в составе белков и в свободном виде. Играет важную роль в обмене азотистых веществ. Участвует в образовании пиримидиновых оснований, мочевины. Биологическое действие аспарагиновой кислоты: иммуномодулирующее, повышающее физическую выносливость, нормализующее баланс возбуждения и торможения в ЦНС и др. Цитруллин — аминокислота, не входящая в состав белков; вырабатывается печенью в качестве побочного продукта в процессе биосинтеза аргинина и превращения аммиака в мочевину. При паталогически повышенном содержании оказывает токсическое действие. Дети с врожденным недостатком одного из ферментов, служащих для химического расщепления белков в моче (вследствие этого в крови происходит накопление аммиака и аминокислоты цитруллина) плохо развиваются, кроме того, у них ярко выражена задержка умственного развития.
Глутаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер. Глутаминовая кислота может использоваться клетками головного мозга в качестве источника энергии.
Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты — глутамина. Этот процесс — единственный способ обезвреживания аммиака в головном мозге.
Цитруллин — аминокислота, не входящая в состав белков; вырабатывается печенью в качестве побочного продукта в процессе биосинтеза аргинина и превращения аммиака в мочевину. При паталогически повышенном содержании оказывает токсическое действие. Дети с врожденным недостатком одного из ферментов, служащих для химического расщепления белков в моче (вследствие этого в крови происходит накопление аммиака и аминокислоты цитруллина) плохо развиваются, кроме того, у них ярко выражена задержка умственного развития.
Глутаминовая кислота является нейромедиатором, передающим импульсы в центральной нервной системе. Эта аминокислота играет важную роль в углеводном обмене и способствует проникновению кальция через гематоэнцефалический барьер. Глутаминовая кислота может использоваться клетками головного мозга в качестве источника энергии.
Она также обезвреживает аммиак, отнимая атомы азота в процессе образования другой аминокислоты — глутамина. Этот процесс — единственный способ обезвреживания аммиака в головном мозге. Глицин- замедляет дегенерацию мышечной ткани, так как является источником креатина — вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК.
Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме. Он выполняет функцию тормозного нейромедиатора и таким образом может предотвратить эпилептические судороги.
Метионин– незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и в стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает детоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Орнитин-помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином.
Глицин- замедляет дегенерацию мышечной ткани, так как является источником креатина — вещества, содержащегося в мышечной ткани и используемого при синтезе ДНК и РНК.
Глицин необходим для синтеза нуклеиновых кислот, желчных кислот и заменимых аминокислот в организме. Он выполняет функцию тормозного нейромедиатора и таким образом может предотвратить эпилептические судороги.
Метионин– незаменимая аминокислота, помогающая переработке жиров, предотвращая их отложение в печени и в стенках артерий. Синтез таурина и цистеина зависит от количества метионина в организме. Эта аминокислота способствует пищеварению, обеспечивает детоксикационные процессы (прежде всего обезвреживание токсичных металлов), уменьшает мышечную слабость, защищает от воздействия радиации, полезна при остеопорозе и химической аллергии.
Орнитин-помогает высвобождению гормона роста, который способствует сжиганию жиров в организме. Этот эффект усиливается при применении орнитина в комбинации с аргинином и карнитином. Орнитин также необходим для иммунной системы и работы печени, участвуя в детоксикационных процессах и восстановлении печеночных клеток.
Фенилаланин– это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту – тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона.
Тирозин-является предшественником нейромедиаторов норадреналина и дофамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина (он борется со старением и отвечает за здоровый сон) и улучшает функции надпочечников, щитовидной железы и гипофиза.
Орнитин также необходим для иммунной системы и работы печени, участвуя в детоксикационных процессах и восстановлении печеночных клеток.
Фенилаланин– это незаменимая аминокислота. В организме она может превращаться в другую аминокислоту – тирозин, которая, в свою очередь, используется в синтезе двух основных нейромедиаторов: допамина и норадреналина. Поэтому эта аминокислота влияет на настроение, уменьшает боль, улучшает память и способность к обучению, подавляет аппетит. Фенилаланин используют в лечении артрита, депрессии, болей при менструации, мигрени, ожирения, болезни Паркинсона.
Тирозин-является предшественником нейромедиаторов норадреналина и дофамина. Эта аминокислота участвует в регуляции настроения; недостаток тирозина приводит к дефициту норадреналина, что, в свою очередь, приводит к депрессии. Тирозин подавляет аппетит, способствует уменьшению отложения жиров, способствует выработке мелатонина (он борется со старением и отвечает за здоровый сон) и улучшает функции надпочечников, щитовидной железы и гипофиза. Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода.
Валин— незаменимая аминокислота, оказывающая стимулирующее действие. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме. Относится к разветвленным аминокислотам, и это означает, что он может быть использован мышцами в качестве источника энергии. Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Чрезмерно высокий уровень валина может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Изолейцин— одна из незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.
Метаболизм изолейцина происходит в мышечной ткани. Изолейцин — одна из трех разветвленных аминокислот.
Тирозин также участвует в обмене фенилаланина. Тиреоидные гормоны образуются при присоединении к тирозину атомов йода.
Валин— незаменимая аминокислота, оказывающая стимулирующее действие. Валин необходим для метаболизма в мышцах, восстановления поврежденных тканей и для поддержания нормального обмена азота в организме. Относится к разветвленным аминокислотам, и это означает, что он может быть использован мышцами в качестве источника энергии. Валин часто используют для коррекции выраженных дефицитов аминокислот, возникших в результате привыкания к лекарствам. Чрезмерно высокий уровень валина может привести к таким симптомам, как парестезии (ощущение мурашек на коже), вплоть до галлюцинаций.
Изолейцин— одна из незаменимых аминокислот, необходимых для синтеза гемоглобина. Также стабилизирует и регулирует уровень сахара в крови и процессы энергообеспечения.
Метаболизм изолейцина происходит в мышечной ткани. Изолейцин — одна из трех разветвленных аминокислот. Изолейцин необходим при многих психических заболеваниях; дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Лейцин— незаменимая аминокислота, относящаяся к трем разветвленным аминокислотам. Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Избыток лейцина может увеличить количество аммиака в организме.
Дефицит аминокислот ведет к недостаточности всех синтетических процессов в организме, особенно страдают быстрообновляющиеся системы (половая система, гуморальные системы, красный костный мозг и др.).
Наследственные нарушения, реализующиеся изменением концентраций аминокислот и ацилкарнитинов, представляют собой одну из самых многочисленных и гетерогенных групп болезней метаболизма (ФКУ, тирозинемия, гистидинемия, гиперглицинемия и многое другое).
Изолейцин необходим при многих психических заболеваниях; дефицит этой аминокислоты приводит к возникновению симптомов, сходных с гипогликемией.
Лейцин— незаменимая аминокислота, относящаяся к трем разветвленным аминокислотам. Действуя вместе, они защищают мышечные ткани и являются источниками энергии, а также способствуют восстановлению костей, кожи, мышц, поэтому их прием часто рекомендуют в восстановительный период после травм и операций. Лейцин также несколько понижает уровень сахара в крови и стимулирует выделение гормона роста. Избыток лейцина может увеличить количество аммиака в организме.
Дефицит аминокислот ведет к недостаточности всех синтетических процессов в организме, особенно страдают быстрообновляющиеся системы (половая система, гуморальные системы, красный костный мозг и др.).
Наследственные нарушения, реализующиеся изменением концентраций аминокислот и ацилкарнитинов, представляют собой одну из самых многочисленных и гетерогенных групп болезней метаболизма (ФКУ, тирозинемия, гистидинемия, гиперглицинемия и многое другое). Значение точной лабораторной диагностики данных заболеваний определяется тем, что часто их различные формы имеют сходную клиническую картину, что усложняет диагностику на клиническом этапе.
Избыточное накопление (вследствие нарушения метаболизма или других причин) многих аминокислот имеет токсический эффект: гомоцистеин, цитруллин, фенилаланин, валин и др.
Значение точной лабораторной диагностики данных заболеваний определяется тем, что часто их различные формы имеют сходную клиническую картину, что усложняет диагностику на клиническом этапе.
Избыточное накопление (вследствие нарушения метаболизма или других причин) многих аминокислот имеет токсический эффект: гомоцистеин, цитруллин, фенилаланин, валин и др.
Диета, богатая лейцином, вызывает сдвиг в метаболизме опухоли от гликолитического к окислительному фосфорилированию, уменьшая потребление глюкозы и метастазирование у крыс с опухолью Walker-256
In vivo экспериментовЖивотные и диета
Взрослых самок крыс линии Wistar (возраст примерно 90 ± 10 дней, полученные из помещений для животных при Государственном университете Кампинаса, UNICAMP, Бразилия) содержали в коллективных клетках в контролируемых условиях окружающей среды ( светлый и темный 12/12 часов, температура 22 ± 2 ° C, влажность 50–60%). За животными ежедневно наблюдали, взвешивали три раза в неделю и давали пищу и воду ad libitum. Полуочищенные диеты были составлены в соответствии с Американским институтом питания (AIN-93 22 ) со следующими компонентами: Контрольный рацион (W) содержал 18% белка и 20% казеина (в качестве источника белка). , 39,7% кукурузного крахмала, 13,2% декстрина и 10% сахара (в качестве источников углеводов), 7% соевого масла (в качестве источника жира), 5% целлюлозного микроволокна (в качестве источника волокна), 3,5% солевой смеси, 1.0% смесь витаминов, 0,3% цистеина и 0,25% холина. Диета, богатая лейцином (LW), также содержала 18% белка и состояла из того же количества казеина, жира, клетчатки, соли, витаминной смеси, цистеина и холина, что и контрольная диета, в дополнение к 3% лейцину и 38,7% кукурузы. крахмал, 12,2% декстрина и 9% сахара (в качестве источников углеводов). Диеты были нормопротеическими, изокалорийными и нормолипидными.
За животными ежедневно наблюдали, взвешивали три раза в неделю и давали пищу и воду ad libitum. Полуочищенные диеты были составлены в соответствии с Американским институтом питания (AIN-93 22 ) со следующими компонентами: Контрольный рацион (W) содержал 18% белка и 20% казеина (в качестве источника белка). , 39,7% кукурузного крахмала, 13,2% декстрина и 10% сахара (в качестве источников углеводов), 7% соевого масла (в качестве источника жира), 5% целлюлозного микроволокна (в качестве источника волокна), 3,5% солевой смеси, 1.0% смесь витаминов, 0,3% цистеина и 0,25% холина. Диета, богатая лейцином (LW), также содержала 18% белка и состояла из того же количества казеина, жира, клетчатки, соли, витаминной смеси, цистеина и холина, что и контрольная диета, в дополнение к 3% лейцину и 38,7% кукурузы. крахмал, 12,2% декстрина и 9% сахара (в качестве источников углеводов). Диеты были нормопротеическими, изокалорийными и нормолипидными.
Прививка опухоли Walker-256
Опухоль Walker-256 — хорошо зарекомендовавшая себя экспериментальная модель раковой кахексии 23,24,25,26 . Клетки Walker-256 (2,5 × 10 6 жизнеспособных клеток) вводили подкожно в правый бок крыс. Общие руководящие принципы Координационного комитета Соединенного Королевства по исследованиям рака, 1998 г. (UKCCCR) 27 в отношении благополучия животных были соблюдены, и экспериментальный протокол был одобрен Институциональным комитетом по этике в исследованиях на животных (Comissão de Ética no Uso de Animais, Instituto de Biologia, Universidade de Campinas, Бразилия — CEEA / IB / UNICAMP, протокол № 4289-1).
Клетки Walker-256 (2,5 × 10 6 жизнеспособных клеток) вводили подкожно в правый бок крыс. Общие руководящие принципы Координационного комитета Соединенного Королевства по исследованиям рака, 1998 г. (UKCCCR) 27 в отношении благополучия животных были соблюдены, и экспериментальный протокол был одобрен Институциональным комитетом по этике в исследованиях на животных (Comissão de Ética no Uso de Animais, Instituto de Biologia, Universidade de Campinas, Бразилия — CEEA / IB / UNICAMP, протокол № 4289-1).
Протокол эксперимента
Животных случайным образом распределяли на две экспериментальные группы (минимум восемь животных в группе). Контрольная группа (W) получала контрольную диету (18% белка), а группа лейцина (LW) кормилась диетой, богатой лейцином (18% белка + 3% лейцина). В предагонный момент (примерно через двадцать дней после инокуляции опухоли) животным проводили ПЭТ-КТ-визуализацию 18F-FDG (по четыре животных на группу для этой процедуры). После 20 дней развития опухоли крыс умерщвляли. Опухоль удалили и взвесили. Некоторые фрагменты опухоли немедленно помещали в ледяной буфер, содержащий 10 мМ Ca-EGTA буфер для измерения потребления кислорода. Другие фрагменты опухоли замораживали непосредственно в жидком азоте и хранили при -80 ° C для проведения полимеразной цепной реакции (ПЦР) и вестерн-блоттинга в реальном времени, а дополнительные фрагменты опухоли немедленно фиксировали в 2,5% глютаральдегиде и 2,5% параформальдегиде в какодилате натрия. буфер (0,1 М) при pH 7,4 и CaCl2 (3 мМ) в течение 24 ч на льду перед обработкой для анализа с помощью электронной микроскопии.
Опухоль удалили и взвесили. Некоторые фрагменты опухоли немедленно помещали в ледяной буфер, содержащий 10 мМ Ca-EGTA буфер для измерения потребления кислорода. Другие фрагменты опухоли замораживали непосредственно в жидком азоте и хранили при -80 ° C для проведения полимеразной цепной реакции (ПЦР) и вестерн-блоттинга в реальном времени, а дополнительные фрагменты опухоли немедленно фиксировали в 2,5% глютаральдегиде и 2,5% параформальдегиде в какодилате натрия. буфер (0,1 М) при pH 7,4 и CaCl2 (3 мМ) в течение 24 ч на льду перед обработкой для анализа с помощью электронной микроскопии.
FDG-PET / CT изображение
Животные голодали в течение 6 часов перед сканированием PET / CT. Для точной инъекции 18 F-FDG и получения изображения крыс анестезировали путем внутрибрюшинной инъекции кетамина (100 мг / кг веса тела) и ксилазина (12,5 мг / кг веса тела) 18 .F-FDG (37MBq [ 1mC]) примерно в 0,5 мл 0,9% раствора NaCl вводили через хвостовую вену. Радиоактивную активность измеряли перед инъекцией. Через шестьдесят минут после инъекции 18 F-FDG каждая крыса подвергалась ПЭТ / КТ-визуализации в положении лежа.Сканирование проводилось на системе визуализации ПЭТ / КТ (Siemens — Biograph mCT40). Условия сбора КТ были установлены на 70 кВ, 155 мА и толщину среза 0,5 мм. Каждую кровать сканировали в течение 20 минут от головы до хвоста. Для анализа использовалась трехмерная (3D) модель реконструкции: OSEM 3D с 24 подмножествами и двумя взаимодействиями. Для этого изображения ПЭТ и КТ были объединены с помощью программного обеспечения True D (Siemens). Области интереса (ROI) были нарисованы с использованием полуколичественного метода (Isocontour), таким образом мы могли определить максимальное поглощение 18 F-FDG (SUV max ) в областях опухоли и других тканях.Внедорожник определяется как (A * W) / A ing , в котором A (Бк / мл) — это радиоактивность, измеренная в ROI, W (г) — это вес животного, а A ing (Бк) — это активность вводимого 18 Ф-ФДГ. SUV max является более точным для оценки истинного внедорожника, чем среднее значение SUV для такого анализа.
Через шестьдесят минут после инъекции 18 F-FDG каждая крыса подвергалась ПЭТ / КТ-визуализации в положении лежа.Сканирование проводилось на системе визуализации ПЭТ / КТ (Siemens — Biograph mCT40). Условия сбора КТ были установлены на 70 кВ, 155 мА и толщину среза 0,5 мм. Каждую кровать сканировали в течение 20 минут от головы до хвоста. Для анализа использовалась трехмерная (3D) модель реконструкции: OSEM 3D с 24 подмножествами и двумя взаимодействиями. Для этого изображения ПЭТ и КТ были объединены с помощью программного обеспечения True D (Siemens). Области интереса (ROI) были нарисованы с использованием полуколичественного метода (Isocontour), таким образом мы могли определить максимальное поглощение 18 F-FDG (SUV max ) в областях опухоли и других тканях.Внедорожник определяется как (A * W) / A ing , в котором A (Бк / мл) — это радиоактивность, измеренная в ROI, W (г) — это вес животного, а A ing (Бк) — это активность вводимого 18 Ф-ФДГ. SUV max является более точным для оценки истинного внедорожника, чем среднее значение SUV для такого анализа.
Подготовка образца ткани Walker-256 для измерения потребления кислорода
Потребление кислорода было произведено в соответствии с предыдущим исследованием, проведенным Бусанелло и его коллегами 28 .Вкратце, ткани Walker-256 собирали у крыс Wistar и помещали в ледяной буфер, содержащий 10 мМ Ca-этиленгликоль-бис (B-аминоэтиловый эфир) -N’N’N’N’-тетрауксусную кислоту (EGTA) буфер (EGTA) ( 2,77 мМ CaK 2 EGTA + 7,23 мМ K 2 EGTA, свободная концентрация кальция 0,1 ммоль / л), 20 ммоль / л имидазол, 50 ммоль / лк + /4-морфолиноэтансульфоновая кислота, 0,5 ммоль / L дитиотреитол, 7 ммоль / л MgCl 2 , 5 ммоль / л АТФ, 15 ммоль / л фосфокреатин, pH 7,1. Отдельные пучки от восьми до одиннадцати мг опухолевой ткани отделяли щипцами.Образцы проницались в ледяном буфере, содержащем сапонин (50 мкг / мл), в течение 30 мин, осторожно перемешивали и трижды промывали средой MiR05 (60 ммоль / л лактобионата калия, 0,5 ммоль / л EGTA, 3 ммоль / л MgCl . 2 , 20 ммоль / л таурин, 10 ммоль / л KH 2 PO 4 , 20 ммоль / л HEPES, 110 ммоль / л сахароза, 1 г / л бычий сывороточный альбумин [BSA], pH 7,1) при 4 ° С. Образцы сушили фильтровальной бумагой и весили 29,30 .
Потребление кислорода оценивалось согласно 29 и 28 .Проницаемые ткани добавляли к среде MiR05, содержащей EGTA (500 мМ), при 37 ° C с добавлением 10 мМ глутамата плюс 5 мМ малата на оксиграфе Oroboros (Инсбрук, Австрия). В ходе экспериментов добавляли АДФ (1 мМ) и карбоксиатрактилоид (CAT, 12 мкМ).
Световая и просвечивающая электронная микроскопия
Образцы тканей были взяты у животных и погружены в фиксирующий раствор (4% параформальдегид в 0,1 М фосфатно-солевом буфере [PBS]), pH 7,4, на 24 часа при 4 ° C.Затем ткани дегидратировали в спирте с разной концентрацией, заливали гисторезином (Leica Microsystems, Гейдельберг, Германия) и делали срезы шириной 3 мкм. Срезы помещали на предметные стекла и окрашивали гематоксилином и эозином. Затем срезы исследовали для анализа изображений апоптотических ядер с использованием светового микроскопа Nikon Eclipse E800 (Nikon Corporation, Токио, Япония). Ядра апоптоза подсчитывали с использованием программного обеспечения Image Pro-Plus Premium (v.3.01, Media Cybernetics, Silver Spring, MD, USA) после получения изображения на микроскопе Leica (Leica DMLM, Wetzlar, Германия) с 40-кратным увеличением.Количество апоптозных клеток определяли путем подсчета 20 полей на одном слайде, по меньшей мере, из трех образцов в каждой группе (W и LW).
Для ПЭМ ткань погружали в фиксирующий раствор, состоящий из 2,5% глутарового альдегида и 2,5% параформальдегида в какодилатном буфере натрия (0,1 М) при pH 7,4 и CaCl 2 (3 мМ) на 24 часа на льду. Затем образцы тканей промывали какодилатным буфером / CaCl 2 и затем фиксировали в 1% OsO 4 в буфере какодилата натрия (0.1M), CaCl 2 (3 мМ) и раствор ферроцианида калия (0,8%) в течение 1 ч на льду. После этого этапа образцы ткани промывали водой milli-Q и окрашивали уранилацетатом (2%) в течение ночи при 4 ° C. На следующее утро образцы тканей промывали водой milli-Q и обезвоживали с использованием градиента этанола. Образцы залили смолой Epon 812. Полимеризацию смолы контролировали в инкубаторе (60 ° C) в течение 72 ч. Ультратонкие срезы окрашивали уранилацетатом и цитратом свинца, а затем наблюдали на TEM LEO 906 (Zeiss), работающем при 60 кВ.
Количественная RT-PCR
Суммарную РНК из опухолевой ткани и клеток Walker-256 экстрагировали с помощью реагента TRIZOL ® (Invitrogen), следуя инструкциям производителя. Качество образцов РНК проверяли при 260/280 нм и 260/230 нм с помощью УФ-спектрофотометра (Nanovue Spectrophotometer 28
5 Ge BioSciences, США). кДНК получали с использованием набора для обратной транскрипции кДНК высокой емкости (Applied Biosystems®, США), содержащего обратную транскриптазу Multiscribetm.Синтез кДНК проводили на 1 мкг РНК при 42 ° C. Наконец, кДНК разводили 1: 2 перед использованием в кПЦР. Реакции в реальном времени выполняли с использованием стандартных методов (система определения последовательности ABI Prism 7500; Applied Biosystems, Фостер-Сити, США), и количественный анализ ПЦР был нормализован по бета-актину. Гены, оцениваемые с помощью кПЦР, включали PGC-1α (прямой праймер 5′-GACCACAAACGATGACCCTC-3 ‘и обратный праймер 5′-TGTTGCGACTGCGGTTGT-3′), COX5A (прямой праймер 5’-TGTTGGCTATGATCTGGTTCCGTCC-3 ‘ 3 ‘), NRF-1 (прямой праймер 5′-TGCCCAAGTGAATTACTCTGC-3′ и обратный праймер 5’-TCGTCTGGATGGTCATTTCAC-3 ‘), CS (прямой праймер 5′-TATGGCATGACGGAGATGAA-3′ и обратный праймер 5′-CATGCCGACT ), ATP5a (прямой праймер 5’-TGTTGCTTACCGCCAGATGT-3 ‘и обратный праймер 5′-AGCAGGCGAGAGTGTAGGTA-3′), Cytc (прямой праймер 5’-AGGCAAGCATAAGACTGGAC-3 ‘и обратный праймер 5′-ACTCCATCCAGGTChydase и succin (SDH) (прямой праймер 5’-ACCCCTTCTCTCTCTACCG-3 ‘и обратный праймер 5′-AATGCCCGCTTCTCCTTGTAG-3’).
Вестерн-блоттинг
Образцы культивируемых опухолевых клеток и биоптаты опухолей от крыс с опухолью Walker-256 лизировали в буфере RIPA (150 мМ NaCl, 25 мМ Tris-Cl, pH 7,4, 0,1% SDS, 1 % NP-40, 0,5% дезоксихолат натрия) с добавлением коктейля ингибиторов протеаз (Complete ® , Roche), и концентрацию белка измеряли по методу Брэдфорда 3 . Белки разделяли электрофорезом, переносили на нитроцеллюлозные мембраны, а затем мембраны инкубировали с первичными антителами против Ldha (CellSignaling, 1: 1000), α-тубулина (Sigma-Aldrich, 1: 5000), OXPHOS (Abcam 1: 1000). ), Цитрат-синтаза (CellSignaling 1: 1000), p53 (CellSignaling 1: 1000) и винкулин (CellSignaling 1: 1000) в качестве контроля загрузки.После этого мембраны зондировали вторичными антителами, конъюгированными с пероксидазой, и визуализировали полосы с помощью хемилюминесцентного реагента (ThermoFisher Scientific). Изображения мембран были получены с использованием системы изображений (Amersham Imager 600, GE Healthcare), а количественное определение интенсивности полос было выполнено с использованием программного обеспечения Gel Pro.
Окислительный стресс опухоли
Образцы опухолевой ткани взвешивали, гомогенизировали в фосфатно-солевом буфере (PBS) и центрифугировали в течение 15 минут при 10000 g.Супернатант собирали, хранили на льду и анализировали в двух экземплярах. Опухолевую активность GST (нмоль * мин -1 * мкг белка -1 ) определяли после конъюгации 1-хлор-2,4-динитробензола (CDNB) с глутатионом 31 . Продукт перекисного окисления липидов опухоли MDA был количественно определен с использованием субстрата н-метил-2-фенилиндол (MPO) 32 . После определения активности GST и содержания MDA было рассчитано соотношение MDA / GST, показывающее интенсивность окислительного процесса по сравнению с антиоксидантной реакцией.
In vitro экспериментыПотребление глюкозы и выработка лактата
Для исследований in vitro клетки животных с опухолью Walker-256 выделяли из внутрибрюшинного имплантата и поддерживали в культуре. Вкратце, асцитную жидкость из опухолевого внутрибрюшинного имплантата собирали, эритроциты лизировали 55 мМ Nh5Cl, 12 мМ NaHCO3 и 0,1 мМ ЭДТА, а суспензию клеток центрифугировали при 500 × g в течение 5 мин, 4 ° C. .Супернатант удаляли, а осадок, содержащий опухолевые клетки, засевали в среду 199 (Sigma-Aldrich) с добавлением 10% бычьей телячьей сыворотки (Lonza) и 1% пенициллина / стрептомицина (Lonza) и поддерживали при 37 ° C и 95%. O 2 –5% CO 2 атмосфера с относительной влажностью 85%. Производство лактата и потребление глюкозы. in vitro. анализов проводили для измерения концентрации лактата, высвобождаемого в среде, а потребляемую глюкозу измеряли в соответствии с инструкциями производителя (Bioclin, Бразилия).Вкратце, клетки культивировали в 12-луночных планшетах и обрабатывали 50 мкМ L-лейцином (Sigma, США) в течение 24 часов. Среду удаляли и анализировали на продукцию лактата 1 и потребление глюкозы 2 . Дополнительные клетки Walker-256 высевали в 12-луночный планшет и обрабатывали 50 мкМ L-лейцина (Sigma, США) в течение 24 часов для анализа функции дыхания митохондрий (морской конек), экстракции белка (вестерн-блоттинг) и экстракции РНК (qPCR). .
Митохондриальная респираторная функция
Анализ морского конька (XF24; Agilent Technologies Inc., Санта-Клара, Калифорния, США) была проведена в соответствии с предыдущим исследованием, проведенным Лимой и его коллегами 33 . Скорость потребления кислорода (OCR) измеряли в соответствии с инструкциями производителя. Олигомицин (1 мкМ) использовали для ингибирования АТФ-синтазы, а протонофор карбонилцианид м-хлорфенилгидразон (CCCP) (2 мкМ) использовали для разделения митохондриального OXPHOS и ротенона (гниль) / антимицина (AA) (1 мкМ) для блокировать митохондриальное дыхание и определять немитохондриальный OCR.АТФ-связанный OCR был рассчитан путем вычитания несвязанного OCR (после добавления олигомицина) из базального OCR. Резервная емкость была определена путем вычитания базального OCR из CCCP-индуцированного OCR. Значения немитохондриального OCR вычитали из всех данных перед использованием для анализа. Все измерения морских коньков были нормализованы по количеству белка, определенному с помощью анализа Брэдфорда.
Жизнеспособность клеток и производство супероксида
Жизнеспособность клеток оценивали с помощью поглощения нейтрального красного, как описано Репетто и его коллегами 34 .Вкратце, клетки Walker-256 высевали в 96-луночные планшеты из расчета 1 × 10 3 клеток на лунку и оставляли для прикрепления в течение ночи. На следующий день клетки обрабатывали 50 мкМ L-лейцином в течение 24 или 96 часов, как указано в подписях к фигурам. Добавляли нейтральный красный раствор (40 мкг × мл) и клетки инкубировали еще 2 часа. После этого среду, содержащую окрашивающий раствор, удаляли, и клетки дважды промывали PBS. Пятно экстрагировали изнутри клеток, добавляя раствор 50% этанола, 49% H 2 O и 1% ледяной уксусной кислоты.Оптическую плотность считывали при 540 нм.
Для получения супероксида использовали дигидроэтидиум (DHE, ThermoFisher Scientific). Клетки Walker-256 высевали в 96-луночные планшеты из расчета 1 × 10 3 клеток на лунку и оставляли для прикрепления в течение ночи. На следующий день клетки обрабатывали 50 мкМ L-лейцином в течение 24 или 96 часов, как указано в подписях к фигурам. К среде добавляли раствор DHE (10 мкМ), и клетки инкубировали при 37 ° C в течение 30 минут в инкубаторе для клеток. После этого добавляли раствор Hoechst 33342 (1 мкг × мл -1 ) (HO, ThermoFisher Scientific), и клетки инкубировали в течение 15 мин в инкубаторе для клеток.Затем клетки дважды промывали PBS и измеряли флуоресценцию DHE, используя возбуждение / испускание 518/605 нм; Флуоресценцию HO измеряли с использованием возбуждения / испускания 350/461 нм.
Статистический анализ
Статистический анализ выполняли с использованием программного обеспечения Graph Pad Prism 6.0 (Graph-Pad Software, Inc). Данные выражены как среднее значение ± стандартное отклонение (s.d.) и проанализированы с помощью t-критерия. P ≤ 0,05 считалось значимым.
Роль лейцина в регуляции белкового обмена | Журнал питания
РЕФЕРАТ
Исследования как in vivo, так и in vitro показали, что лейцин в очень высоких дозах может стимулировать синтез мышечного белка, эффект, который усиливается in vivo инсулином, секретируемым в ответ на дозу лейцина.Высокий уровень лейцина также может ингибировать деградацию белка в скелетных мышцах, а также в печени. Напротив, при нормальных физиологических уровнях увеличение концентрации лейцина путем инфузии стимулирует синтез мышечного белка за счет повышения его чувствительности к инсулину. Сделан вывод о том, что роль лейцина in vivo заключается в предоставлении сигнала о доступности аминокислот, который в сочетании с сигналом доступности энергии от инсулина стимулирует синтез мышечного белка.
В 1970-х годах ряд лабораторий проводили in vitro исследования факторов, контролирующих обмен белка в тканях.Среди этих факторов были гормоны, например, инсулин, и сами субстраты для синтеза белка, аминокислоты. Эти исследования показали, что высокие концентрации всех аминокислот стимулировали синтез белка и ингибировали деградацию белка, особенно в скелетных мышцах (1–3), но также и в сердечной мышце (4). В частности, на сердце было показано, что стимуляция аминокислотами может быть воспроизведена только с 3 аминокислотами с разветвленной цепью (BCAA; лейцин, изолейцин и валин) (5), тогда как в изолированной мышце диафрагмы только лейцин, как а также полная смесь аминокислот стимулировала синтез белка (2).Эта группа исследований из нескольких лабораторий положила начало непрерывной серии исследований роли лейцина в контроле массы тканевого белка, его механизма действия и его возможного значения для увеличения отложения мышечного белка у здоровых субъектов или замедления потери мышечного белка. в катаболических состояниях.
Попытки продемонстрировать действие лейцина in vivo
Исходя из того, что если лейцин стимулирует синтез мышечного белка и ингибирует деградацию, тогда добавки лейцина могут быть эффективными для ограничения потери белка у людей с патологическими состояниями, потенциал дополнительного лейцина для улучшения баланса белка во время голодания был исследован в нескольких лабораториях.Несколько групп показали, что введение лейцина или кетокислотных аналогов BCAA голодающим пациентам улучшает азотный баланс (6–8), предполагая, что лейцин действительно может экономить белок организма. Однако этот эффект, по-видимому, не был результатом улучшения белкового баланса в скелетных мышцах у голодных субъектов, поскольку отток из ног аминокислот фенилаланина и тирозина не изменился у субъектов с бедренными артериальными и венозными катетерами (9). Эти аминокислоты не метаболизируются в скелетных мышцах, поэтому их отток является индикатором чистого отрицательного белкового баланса в ткани.Тем не менее, эти первые результаты у людей, предполагающие, что добавка BCAA может сдерживать потерю белка, которая происходит при многих патологических состояниях, привели к большому количеству исследований их эффективности у пациентов, страдающих такими состояниями, как сепсис и травмы, а также для улучшения мышечной массы. функции у спортсменов.
Исследования эффектов лейцина или BCAA на интактных крысах не дали результатов. Buse et al. (10) вводили голодным крысам лейцин плюс глюкозу плюс инсулин и наблюдали стимуляцию агрегации мышечных полирибосом, что указывало на увеличение синтеза мышечного белка.Однако в серии исследований на растущих крысах, которым вводили только лейцин (1 ммоль / кг), не было обнаружено изменений в синтезе белка в икроножной мышце, сердце, серозной оболочке тощей кишки, слизистой оболочке тощей кишки или печени (11). В этих исследованиях синтез белка измеряли путем внутривенной инъекции избыточной дозы [ 3 H] фенилаланина (12) с последующим умерщвлением крыс через 10 минут; лейцин (или физиологический раствор) вводили вместе с изотопом. Отдельные группы крыс либо кормили, либо лишали пищи на 2 дня, либо получали безбелковую диету в течение 9 дней, но ни в одной группе не было обнаружено изменений в синтезе мышечного белка.В дополнительном эксперименте, разработанном для того, чтобы показать, требуется ли более 10 минут для демонстрации изменения синтеза белка, двумерным крысам, лишенным пищи, внутрибрюшинно вводили лейцин, и синтез белка измеряли через 30 минут. Как и прежде, никаких изменений не обнаружено. В целом, эти исследования показали, что введение лейцина в дозе 1 ммоль / кг (что приводит к концентрации в плазме ~ 1 ммоль / л; примерно в 8 раз выше, чем у крыс, которым кормили) растущим крысам не оказывало заметного воздействия на мышечный белок. синтез.
Лейцин и реакция на питание в мышцах растущих крыс
В естественном состоянии лейцин не назначается отдельно, а входит в состав еды и, таким образом, сопровождается сбалансированной смесью других аминокислот и повышенными концентрациями глюкозы и инсулина. Измерения на молодых крысах (масса тела ~ 100–150 г) показали, что синтез мышечного белка стимулируется поступлением питательных веществ внутрижелудочно или внутривенно (13). Внутривенное вливание инсулина и глюкозы для предотвращения гипогликемии также стимулировало синтез мышечного белка у крыс, лишенных пищи, но только тогда, когда концентрация инсулина в плазме была выше, чем обычно наблюдается у кормленных крыс (14).Более того, кормление крыс антиинсулиновой сывороткой не увеличивало синтез мышечного белка (13), показывая, что инсулин необходим для ответа на синтез белка. Точно так же инфузия полной смеси аминокислот не усиливала синтез мышечного белка, если, кроме того, концентрация инсулина не была повышена инфузией глюкозы, что привело к гипотезе о том, что увеличение синтеза белка после кормления является результатом повышения чувствительности тканей. к инсулину, вызванному аминокислотами (13).Эта гипотеза была подтверждена измерением доза-ответ синтеза мышечного белка на инфузию инсулина в присутствии и в отсутствие инфузии полной смеси аминокислот [рис. 1, исх. (15)]. Из кривых видно, что без аминокислот синтез белка возрастал криволинейно, но не достиг максимума при самой высокой скорости инфузии инсулина, что дало концентрацию инсулина в плазме ~ 160 мкЕд / мл. Это резко контрастировало с кривой у крыс, которым вводили вливания смеси аминокислот в дополнение к инсулину.Эта кривая была максимальной при гораздо более низкой концентрации инсулина, которая была аналогична таковой у крыс, получавших корм (~ 15-25 мкЕд / мл).
РИСУНОК 1
Дозозависимая реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот. Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
РИСУНОК 1
Доза-реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот.Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
В описанном выше исследовании (15) были проведены дополнительные эксперименты для характеристики специфичности повышения чувствительности к инсулину для отдельных аминокислот или групп аминокислот. Концентрация инсулина около 20 мкЕд / мл, которая недостаточна для стимуляции синтеза белка сама по себе, была достигнута инфузией глюкозы с низкой скоростью во всех группах. На рисунке 2 показано, что по сравнению с одной инфузией глюкозы синтез белка стимулировался в равной степени всей смесью, только незаменимыми аминокислотами и только BCAA (15).Это демонстрирует, что именно BCAA повышают чувствительность синтеза мышечного белка к инсулину. Этот вывод был подтвержден в эксперименте, показанном на рисунке 3, который показывает, что смесь аминокислот без BCAA не эффективна для стимуляции синтеза белка. Более того, как показано на Рисунке 4, действие BCAA можно полностью объяснить лейцином, который имел тот же эффект, что и 3 BCAA вместе, тогда как изолейцин и валин не имели никакого эффекта.
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только несущественные аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только заменимые аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полная смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полную смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
Заключение вышеупомянутых исследований заключалось в том, что во время кормления лейцин повышает чувствительность синтеза белка к инсулину, вызывая стимуляцию синтеза мышечного белка. Последующее исследование проверило гипотезу о том, что притупленная реакция синтеза мышечного белка на кормление у старых крыс может быть восстановлена путем кормления диеты с добавлением лейцина (16).Взрослых и старых крыс лишали пищи, а затем снова кормили нормальной диетой в течение 1 часа или диетой с добавлением лейцина. При обычном питании взрослые крысы ответили на кормление увеличением синтеза мышечного белка, тогда как старые крысы — нет. Однако, когда еда содержала дополнительный лейцин, в обеих группах наблюдалось аналогичное увеличение синтеза белка. В последующем исследовании (17) было показано, что это преимущество для старых крыс сохранялось после 10 дней кормления диетой с добавлением лейцина.
Недавние исследования лейцина как регулятора синтеза мышечного белка
В последние годы вопрос о лейцине и его способности изменять синтез белка был повторно исследован и привел к прогрессу в понимании механизмов пищевой регуляции синтеза белка на молекулярном уровне. При исследовании снижения синтеза мышечного белка после тренировки у крыс было замечено, что введение лейцина восстанавливало синтез белка до той же величины, что и у нетренированных крыс (18).Более того, этот эффект был таким же, когда глюкоза вводилась вместе с лейцином, что позволяет предположить, что эффект не зависел от инсулина. Заметным различием между этим и предыдущими исследованиями была доза лейцина, которая вводилась через желудочный зонд, а не внутривенно, и была в 10 раз выше (10 ммоль / кг), чем в более ранних исследованиях (11). Последующие исследования выявили взаимодействие между лейцином и секрецией инсулина в этих более высоких дозах. После перорального введения лейцина (10 ммоль / кг) крысам, лишенным пищи, скорость синтеза белка увеличивалась более чем на 50%, возвращаясь к исходным уровням только через 2 часа (19).Также было отмечено, что уровень инсулина временно повышался, достигая пика примерно в 3 раза по сравнению с базальным уровнем через 30 минут (19). Это привело к эксперименту, в котором секреция инсулина подавлялась инфузией соматостатина, что приводило к отмене влияния лейцина на синтез белка (19). Это означало, что ответ на лейцин инсулино-зависимый. Однако в другом исследовании было показано, что введение лейцина стимулирует синтез белка у крыс с диабетом, предполагая, что лейцин может оказывать прямое влияние на синтез белка в дополнение к инсулинозависимой стимуляции (20).Наблюдение за тем, что лейцин стимулирует синтез мышечного белка в перфузируемой задней конечности крысы (21), также свидетельствует о существовании инсулинозависимого механизма.
Эти исследования также объясняют, почему некоторые из более ранних исследований влияния лейцина на синтез мышечного белка не смогли обнаружить стимуляции [например, исх. (11)]. Дозы лейцина, хотя и достаточно велики, чтобы вызвать повышение концентрации лейцина в плазме, как при приеме пищи, были слишком малы, чтобы усилить синтез белка сами по себе, и слишком малы, чтобы вызвать секрецию инсулина.Напротив, в исследовании Buse et al. (10), лейцин давали вместе с глюкозой и инсулином, которые, как описано выше, усиливают действие лейцина.
Работа, описанная выше, привела к значительному прогрессу в понимании путей передачи сигнала, участвующих в контроле синтеза мышечного белка с помощью аминокислот и инсулина. Детали этих достижений изложены в недавнем обзоре (22) и здесь не будут описаны.
Другие эффекты лейцина
Большинство исследований влияния лейцина на метаболизм белков сосредоточено на синтезе белка в скелетных мышцах.Однако есть также доказательства того, что лейцин ингибирует деградацию белка в мышцах (2), которая в этой ткани происходит в основном через убиквитин-протеасомный путь (23). В отличие от мышц, в печени лейцин не влияет на общий синтез белка, хотя есть стимуляция синтеза рибосомального белка (24). Основное влияние лейцина на печень, по-видимому, связано с протеолизом, который в этой ткани преимущественно лизосомный (23,25). Однако, в отличие от мышц, лейцин не уникален, но является наиболее сильнодействующим из группы из 8 аминокислот, которые называются «регуляторными» (25).В эту группу также входят тирозин, фенилаланин, глутамин, пролин, гистидин, триптофан и метионин (25).
Выводы: роль лейцина
Очень высокие концентрации лейцина обладают способностью стимулировать синтез белка и подавлять деградацию белка в скелетных мышцах интактных крыс. Этот эффект на синтез белка может быть усилен кратковременным, но небольшим повышением уровня инсулина в сыворотке, вызванным дозой лейцина. Однако в пределах нормального физиологического диапазона концентраций лейцина и инсулина у крыс, лишенных пищи и кормленных, чувствительность синтеза мышечного белка к инсулину усиливается инфузией лейцина, так что синтез белка стимулируется умеренно повышенными концентрациями инсулина и лейцина. которые типичны для откормленных крыс.Следовательно, физиологическая роль лейцина состоит в том, чтобы работать с инсулином, чтобы активировать переключатель, который стимулирует синтез мышечного белка, когда становятся доступными аминокислоты и энергия из пищи. Преимущество этого режима регулирования заключается в том, что для переключения требуется одновременное присутствие как аминокислот (лейцин), так и энергии (инсулин), поэтому он активируется только при идеальных условиях.
Роль лейцина как усилителя чувствительности к инсулину также подразумевает возможность того, что длительное очень высокое потребление лейцина может привести к инсулинорезистентности аналогично инсулинорезистентности, возникающей в результате продолжительной гипергликемии.В конечном итоге это может привести к подавлению стимуляции синтеза мышечного белка при приеме пищи. Более того, поскольку части сигнальных путей от инсулина к синтезу белка являются общими с теми, которые участвуют в регуляции метаболизма глюкозы, как обсуждалось ранее (26), существует вероятность того, что чрезмерная стимуляция лейцином может привести к нарушениям метаболизма глюкозы. Таким образом, поиск «верхнего уровня» диетического лейцина может включать в себя исследование эффектов длительного высокого потребления лейцина на гомеостаз и метаболизм глюкозы.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.Fulks
,R.H.
,Li
,J. B.
иGoldberg
,A. L.
(1975
)Влияние инсулина, глюкозы и аминокислот на обмен белков в диафрагмах крыс
.J. Biol. Chem.
250
:290
—298
. 2.Buse
,M. G.
иReid
,S. S.
(1975
)Лейцин: возможный регулятор белкового обмена в мышцах
.J. Clin. Вкладывать деньги.
56
:1250
—1261
.3.Li
,J. B.
иJefferson
,L. S.
(1978
)Влияние доступности аминокислот на обмен белка в перфузируемых скелетных мышцах
.Биохим. Биофиз. Acta.
544
:351
—359
. 4.Morgan
,H. E.
,Earl
,D.C.N.
,Broadus
,E.B.
,Giger
,K. E.
иJefferson
,L. S.
(1971
)Регуляция синтеза белка в сердечной мышце. I. Влияние уровня аминокислот на синтез белка
.J. Biol. Chem.
246
:2152
—2162
. 5.Rannels
,D. E.
,Hjalmarson
,A. C.
иMorgan
,H. E.
(1974
)Влияние неуглеводных веществ на синтез белка в мышцах
.Am J. Physiol.
226
:528
—539
.6.Sherwin
,R. S.
(1978
)Влияние голодания на обмен и метаболический ответ на лейцин
.J. Clin. Вкладывать деньги.
61
:1471
—1481
.7.Sapir
,D. G.
иWalser
,M.
(1977
)Сбережение азота при голодании путем инфузии кетокислот с разветвленной цепью
.Metab. Clin. Exp.
26
:301
—308
.8.Mitch
,WE
,Walser
,M.
иSapir
,DG
(1981
)Сбережение азота, вызванное лейцином, по сравнению с его кето-аналогом, μ-кетоизокапроатом, Человек с ожирением голодания
.J. Clin. Вкладывать деньги.
67
:553
—562
.9.Hagenfeldt
,L.
,Eriksson
,S.
иWahren
,J.
(1980
)Влияние лейцина на артериальные концентрации и региональный обмен аминокислот у здоровых субъектов
.Clin. Sci.
59
:173
—181
.10.Buse
,MG
,Atwell
,R.
иMancusi
,V.
(1979
)Влияние аминокислот с разветвленной цепью на рибосомный цикл в мышцах голодных крыс in vitro
.Horm. Метаб. Res.
11
:289
—292
. 11.McNurlan
,M.A.
,Папоротник
,E.B.
иGarlick
,P. J.
(1982
)Неспособность лейцина стимулировать синтез белка in vivo
.Biochem. J.
204
:831
—838
. 12.Гарлик
,П. Дж.
,МакНурлан
,М.A.
иPreedy
,V. R.
(1980
)Быстрый и удобный метод измерения скорости синтеза белка в тканях путем инъекции ( 3 H) фенилаланина
.Biochem. J.
192
:719
—723
. 13.Preedy
,V. R.
иGarlick
,P. J.
(1986
)Реакция синтеза мышечного белка на потребление питательных веществ у постабсорбтивных крыс: роль инсулина и аминокислот
.Biosci. Представитель
6
:177
—183
. 14.Garlick
,P.J.
,Fern
,M.
иPreedy
,V. R.
(1983
)Влияние инфузии инсулина и приема пищи на синтез мышечного белка у постабсорбтивных крыс
.Biochem. J.
210
:669
—676
. 15.Garlick
,P.J.
иGrant
,I.
(1988
)Инфузия аминокислот увеличивает чувствительность синтеза мышечного белка in vivo к инсулину
.Biochem J.
254
:579
—584
. 16.Dardevet
,D.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
иGrizard
,J.
(2002
)Постпрандиальная стимуляция синтеза мышечного белка у старых крыс может быть восстановлена приемом пищи с добавлением лейцина
.J. Nutr.
132
:95
—100
. 17.Rieu
,I.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
,Balage
,M.
,Papet
,I.
,Grizard
,J.
иDardevet
,D.
(2003
)Десятидневное кормление с добавлением лейцина благотворно влияет на мышцы после еды Синтез белка у старых крыс
.J. Nutr.
133
:1198
—1205
. 18.Anthony
,J. C.
,Anthony
,T. G.
иLayman
,D. K.
(1999
)Прием лейцина улучшает восстановление скелетных мышц у крыс после выполнения упражнения
.J. Nutr.
129
:1102
—1106
.19.Энтони
,Дж. К.
,Ланг
,К.H.
,Crozier
,SJ
,Anthony
,TG
,MacLean
,DA
,Kimball
,SR
иJefferson
,LS
(2002
) Вклад инсулина в трансляционный контроль синтеза белка в скелетных мышцах лейцином.г. J. Physiol. Эндокринол. Метаб.
282
:E1092
—E1101
.20.Энтони
,Дж.C.
,Reiter
,AK
,Anthony
,TG
,Crozier
,SJ
,Lang
,CH
,MacLean
,DA
,Kimball
, иJefferson
,LS
(2002
)Пероральный лейцин усиливает синтез белка в скелетных мышцах крыс с диабетом в отсутствие увеличения фосфорилирования 4E-BP1 или S6K1
.Диабет
51
:928
—936
. 21.Bolster
,DR
,Vary
,TC
,Kimball
,SR
иJefferson
,LS
(2004
)Лейцин регулирует инициацию трансляции в скелетных мышцах крысы с помощью улучшенного elF4G Фосфорилирование
.J. Nutr.
134
:1704
—1710
. 22.Kimball
,S.R.
иJefferson
,L. S.
(2004
)Молекулярные механизмы, посредством которых аминокислоты опосредуют передачу сигналов через мишень рапамицина
млекопитающих.Curr. Мнение. Clin. Nutr. Метаб. Уход
7
:39
—44
. 23.Kadowaki
,M.
иKanazawa
,T.
(2003
)Аминокислоты как регуляторы протеолиза
.Дж.Nutr.
133
:2052S
—2056
S.24.Энтони
,TG
,Энтони
,JC
,Йошизава
,F.
,Кимбалл
,SR
иДжефферсон
,LS
(2001 Орал администрация)
лейцина стимулирует трансляцию мРНК рибосомного белка, но не общие скорости синтеза белка в печени крыс
.J. Nutr.
131
:1171
—1176
0,25.Mortimore
,G. E.
&Pösö
,A. R.
(1987
)Катаболизм внутриклеточного белка и его контроль во время дефицита питательных веществ и снабжения
.Ann. Rev. Nutr.
7
:539
—564
0,26.Layman
,D. K.
&Baum
,J. I.
(2004
)Влияние диетического белка на гликемический контроль во время потери веса
.J Nutr.
134
:968S
—973
S.© 2005 Американское общество диетологии
Роль лейцина в регуляции метаболизма белков | Журнал питания
РЕФЕРАТ
Исследования как in vivo, так и in vitro показали, что лейцин в очень высоких дозах может стимулировать синтез мышечного белка, эффект, который усиливается in vivo инсулином, секретируемым в ответ на дозу лейцина.Высокий уровень лейцина также может ингибировать деградацию белка в скелетных мышцах, а также в печени. Напротив, при нормальных физиологических уровнях увеличение концентрации лейцина путем инфузии стимулирует синтез мышечного белка за счет повышения его чувствительности к инсулину. Сделан вывод о том, что роль лейцина in vivo заключается в предоставлении сигнала о доступности аминокислот, который в сочетании с сигналом доступности энергии от инсулина стимулирует синтез мышечного белка.
В 1970-х годах ряд лабораторий проводили in vitro исследования факторов, контролирующих обмен белка в тканях.Среди этих факторов были гормоны, например, инсулин, и сами субстраты для синтеза белка, аминокислоты. Эти исследования показали, что высокие концентрации всех аминокислот стимулировали синтез белка и ингибировали деградацию белка, особенно в скелетных мышцах (1–3), но также и в сердечной мышце (4). В частности, на сердце было показано, что стимуляция аминокислотами может быть воспроизведена только с 3 аминокислотами с разветвленной цепью (BCAA; лейцин, изолейцин и валин) (5), тогда как в изолированной мышце диафрагмы только лейцин, как а также полная смесь аминокислот стимулировала синтез белка (2).Эта группа исследований из нескольких лабораторий положила начало непрерывной серии исследований роли лейцина в контроле массы тканевого белка, его механизма действия и его возможного значения для увеличения отложения мышечного белка у здоровых субъектов или замедления потери мышечного белка. в катаболических состояниях.
Попытки продемонстрировать действие лейцина in vivo
Исходя из того, что если лейцин стимулирует синтез мышечного белка и ингибирует деградацию, тогда добавки лейцина могут быть эффективными для ограничения потери белка у людей с патологическими состояниями, потенциал дополнительного лейцина для улучшения баланса белка во время голодания был исследован в нескольких лабораториях.Несколько групп показали, что введение лейцина или кетокислотных аналогов BCAA голодающим пациентам улучшает азотный баланс (6–8), предполагая, что лейцин действительно может экономить белок организма. Однако этот эффект, по-видимому, не был результатом улучшения белкового баланса в скелетных мышцах у голодных субъектов, поскольку отток из ног аминокислот фенилаланина и тирозина не изменился у субъектов с бедренными артериальными и венозными катетерами (9). Эти аминокислоты не метаболизируются в скелетных мышцах, поэтому их отток является индикатором чистого отрицательного белкового баланса в ткани.Тем не менее, эти первые результаты у людей, предполагающие, что добавка BCAA может сдерживать потерю белка, которая происходит при многих патологических состояниях, привели к большому количеству исследований их эффективности у пациентов, страдающих такими состояниями, как сепсис и травмы, а также для улучшения мышечной массы. функции у спортсменов.
Исследования эффектов лейцина или BCAA на интактных крысах не дали результатов. Buse et al. (10) вводили голодным крысам лейцин плюс глюкозу плюс инсулин и наблюдали стимуляцию агрегации мышечных полирибосом, что указывало на увеличение синтеза мышечного белка.Однако в серии исследований на растущих крысах, которым вводили только лейцин (1 ммоль / кг), не было обнаружено изменений в синтезе белка в икроножной мышце, сердце, серозной оболочке тощей кишки, слизистой оболочке тощей кишки или печени (11). В этих исследованиях синтез белка измеряли путем внутривенной инъекции избыточной дозы [ 3 H] фенилаланина (12) с последующим умерщвлением крыс через 10 минут; лейцин (или физиологический раствор) вводили вместе с изотопом. Отдельные группы крыс либо кормили, либо лишали пищи на 2 дня, либо получали безбелковую диету в течение 9 дней, но ни в одной группе не было обнаружено изменений в синтезе мышечного белка.В дополнительном эксперименте, разработанном для того, чтобы показать, требуется ли более 10 минут для демонстрации изменения синтеза белка, двумерным крысам, лишенным пищи, внутрибрюшинно вводили лейцин, и синтез белка измеряли через 30 минут. Как и прежде, никаких изменений не обнаружено. В целом, эти исследования показали, что введение лейцина в дозе 1 ммоль / кг (что приводит к концентрации в плазме ~ 1 ммоль / л; примерно в 8 раз выше, чем у крыс, которым кормили) растущим крысам не оказывало заметного воздействия на мышечный белок. синтез.
Лейцин и реакция на питание в мышцах растущих крыс
В естественном состоянии лейцин не назначается отдельно, а входит в состав еды и, таким образом, сопровождается сбалансированной смесью других аминокислот и повышенными концентрациями глюкозы и инсулина. Измерения на молодых крысах (масса тела ~ 100–150 г) показали, что синтез мышечного белка стимулируется поступлением питательных веществ внутрижелудочно или внутривенно (13). Внутривенное вливание инсулина и глюкозы для предотвращения гипогликемии также стимулировало синтез мышечного белка у крыс, лишенных пищи, но только тогда, когда концентрация инсулина в плазме была выше, чем обычно наблюдается у кормленных крыс (14).Более того, кормление крыс антиинсулиновой сывороткой не увеличивало синтез мышечного белка (13), показывая, что инсулин необходим для ответа на синтез белка. Точно так же инфузия полной смеси аминокислот не усиливала синтез мышечного белка, если, кроме того, концентрация инсулина не была повышена инфузией глюкозы, что привело к гипотезе о том, что увеличение синтеза белка после кормления является результатом повышения чувствительности тканей. к инсулину, вызванному аминокислотами (13).Эта гипотеза была подтверждена измерением доза-ответ синтеза мышечного белка на инфузию инсулина в присутствии и в отсутствие инфузии полной смеси аминокислот [рис. 1, исх. (15)]. Из кривых видно, что без аминокислот синтез белка возрастал криволинейно, но не достиг максимума при самой высокой скорости инфузии инсулина, что дало концентрацию инсулина в плазме ~ 160 мкЕд / мл. Это резко контрастировало с кривой у крыс, которым вводили вливания смеси аминокислот в дополнение к инсулину.Эта кривая была максимальной при гораздо более низкой концентрации инсулина, которая была аналогична таковой у крыс, получавших корм (~ 15-25 мкЕд / мл).
РИСУНОК 1
Дозозависимая реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот. Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
РИСУНОК 1
Доза-реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот.Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
В описанном выше исследовании (15) были проведены дополнительные эксперименты для характеристики специфичности повышения чувствительности к инсулину для отдельных аминокислот или групп аминокислот. Концентрация инсулина около 20 мкЕд / мл, которая недостаточна для стимуляции синтеза белка сама по себе, была достигнута инфузией глюкозы с низкой скоростью во всех группах. На рисунке 2 показано, что по сравнению с одной инфузией глюкозы синтез белка стимулировался в равной степени всей смесью, только незаменимыми аминокислотами и только BCAA (15).Это демонстрирует, что именно BCAA повышают чувствительность синтеза мышечного белка к инсулину. Этот вывод был подтвержден в эксперименте, показанном на рисунке 3, который показывает, что смесь аминокислот без BCAA не эффективна для стимуляции синтеза белка. Более того, как показано на Рисунке 4, действие BCAA можно полностью объяснить лейцином, который имел тот же эффект, что и 3 BCAA вместе, тогда как изолейцин и валин не имели никакого эффекта.
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только несущественные аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только заменимые аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полная смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полную смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
Заключение вышеупомянутых исследований заключалось в том, что во время кормления лейцин повышает чувствительность синтеза белка к инсулину, вызывая стимуляцию синтеза мышечного белка. Последующее исследование проверило гипотезу о том, что притупленная реакция синтеза мышечного белка на кормление у старых крыс может быть восстановлена путем кормления диеты с добавлением лейцина (16).Взрослых и старых крыс лишали пищи, а затем снова кормили нормальной диетой в течение 1 часа или диетой с добавлением лейцина. При обычном питании взрослые крысы ответили на кормление увеличением синтеза мышечного белка, тогда как старые крысы — нет. Однако, когда еда содержала дополнительный лейцин, в обеих группах наблюдалось аналогичное увеличение синтеза белка. В последующем исследовании (17) было показано, что это преимущество для старых крыс сохранялось после 10 дней кормления диетой с добавлением лейцина.
Недавние исследования лейцина как регулятора синтеза мышечного белка
В последние годы вопрос о лейцине и его способности изменять синтез белка был повторно исследован и привел к прогрессу в понимании механизмов пищевой регуляции синтеза белка на молекулярном уровне. При исследовании снижения синтеза мышечного белка после тренировки у крыс было замечено, что введение лейцина восстанавливало синтез белка до той же величины, что и у нетренированных крыс (18).Более того, этот эффект был таким же, когда глюкоза вводилась вместе с лейцином, что позволяет предположить, что эффект не зависел от инсулина. Заметным различием между этим и предыдущими исследованиями была доза лейцина, которая вводилась через желудочный зонд, а не внутривенно, и была в 10 раз выше (10 ммоль / кг), чем в более ранних исследованиях (11). Последующие исследования выявили взаимодействие между лейцином и секрецией инсулина в этих более высоких дозах. После перорального введения лейцина (10 ммоль / кг) крысам, лишенным пищи, скорость синтеза белка увеличивалась более чем на 50%, возвращаясь к исходным уровням только через 2 часа (19).Также было отмечено, что уровень инсулина временно повышался, достигая пика примерно в 3 раза по сравнению с базальным уровнем через 30 минут (19). Это привело к эксперименту, в котором секреция инсулина подавлялась инфузией соматостатина, что приводило к отмене влияния лейцина на синтез белка (19). Это означало, что ответ на лейцин инсулино-зависимый. Однако в другом исследовании было показано, что введение лейцина стимулирует синтез белка у крыс с диабетом, предполагая, что лейцин может оказывать прямое влияние на синтез белка в дополнение к инсулинозависимой стимуляции (20).Наблюдение за тем, что лейцин стимулирует синтез мышечного белка в перфузируемой задней конечности крысы (21), также свидетельствует о существовании инсулинозависимого механизма.
Эти исследования также объясняют, почему некоторые из более ранних исследований влияния лейцина на синтез мышечного белка не смогли обнаружить стимуляции [например, исх. (11)]. Дозы лейцина, хотя и достаточно велики, чтобы вызвать повышение концентрации лейцина в плазме, как при приеме пищи, были слишком малы, чтобы усилить синтез белка сами по себе, и слишком малы, чтобы вызвать секрецию инсулина.Напротив, в исследовании Buse et al. (10), лейцин давали вместе с глюкозой и инсулином, которые, как описано выше, усиливают действие лейцина.
Работа, описанная выше, привела к значительному прогрессу в понимании путей передачи сигнала, участвующих в контроле синтеза мышечного белка с помощью аминокислот и инсулина. Детали этих достижений изложены в недавнем обзоре (22) и здесь не будут описаны.
Другие эффекты лейцина
Большинство исследований влияния лейцина на метаболизм белков сосредоточено на синтезе белка в скелетных мышцах.Однако есть также доказательства того, что лейцин ингибирует деградацию белка в мышцах (2), которая в этой ткани происходит в основном через убиквитин-протеасомный путь (23). В отличие от мышц, в печени лейцин не влияет на общий синтез белка, хотя есть стимуляция синтеза рибосомального белка (24). Основное влияние лейцина на печень, по-видимому, связано с протеолизом, который в этой ткани преимущественно лизосомный (23,25). Однако, в отличие от мышц, лейцин не уникален, но является наиболее сильнодействующим из группы из 8 аминокислот, которые называются «регуляторными» (25).В эту группу также входят тирозин, фенилаланин, глутамин, пролин, гистидин, триптофан и метионин (25).
Выводы: роль лейцина
Очень высокие концентрации лейцина обладают способностью стимулировать синтез белка и подавлять деградацию белка в скелетных мышцах интактных крыс. Этот эффект на синтез белка может быть усилен кратковременным, но небольшим повышением уровня инсулина в сыворотке, вызванным дозой лейцина. Однако в пределах нормального физиологического диапазона концентраций лейцина и инсулина у крыс, лишенных пищи и кормленных, чувствительность синтеза мышечного белка к инсулину усиливается инфузией лейцина, так что синтез белка стимулируется умеренно повышенными концентрациями инсулина и лейцина. которые типичны для откормленных крыс.Следовательно, физиологическая роль лейцина состоит в том, чтобы работать с инсулином, чтобы активировать переключатель, который стимулирует синтез мышечного белка, когда становятся доступными аминокислоты и энергия из пищи. Преимущество этого режима регулирования заключается в том, что для переключения требуется одновременное присутствие как аминокислот (лейцин), так и энергии (инсулин), поэтому он активируется только при идеальных условиях.
Роль лейцина как усилителя чувствительности к инсулину также подразумевает возможность того, что длительное очень высокое потребление лейцина может привести к инсулинорезистентности аналогично инсулинорезистентности, возникающей в результате продолжительной гипергликемии.В конечном итоге это может привести к подавлению стимуляции синтеза мышечного белка при приеме пищи. Более того, поскольку части сигнальных путей от инсулина к синтезу белка являются общими с теми, которые участвуют в регуляции метаболизма глюкозы, как обсуждалось ранее (26), существует вероятность того, что чрезмерная стимуляция лейцином может привести к нарушениям метаболизма глюкозы. Таким образом, поиск «верхнего уровня» диетического лейцина может включать в себя исследование эффектов длительного высокого потребления лейцина на гомеостаз и метаболизм глюкозы.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.Fulks
,R.H.
,Li
,J. B.
иGoldberg
,A. L.
(1975
)Влияние инсулина, глюкозы и аминокислот на обмен белков в диафрагмах крыс
.J. Biol. Chem.
250
:290
—298
. 2.Buse
,M. G.
иReid
,S. S.
(1975
)Лейцин: возможный регулятор белкового обмена в мышцах
.J. Clin. Вкладывать деньги.
56
:1250
—1261
.3.Li
,J. B.
иJefferson
,L. S.
(1978
)Влияние доступности аминокислот на обмен белка в перфузируемых скелетных мышцах
.Биохим. Биофиз. Acta.
544
:351
—359
. 4.Morgan
,H. E.
,Earl
,D.C.N.
,Broadus
,E.B.
,Giger
,K. E.
иJefferson
,L. S.
(1971
)Регуляция синтеза белка в сердечной мышце. I. Влияние уровня аминокислот на синтез белка
.J. Biol. Chem.
246
:2152
—2162
. 5.Rannels
,D. E.
,Hjalmarson
,A. C.
иMorgan
,H. E.
(1974
)Влияние неуглеводных веществ на синтез белка в мышцах
.Am J. Physiol.
226
:528
—539
.6.Sherwin
,R. S.
(1978
)Влияние голодания на обмен и метаболический ответ на лейцин
.J. Clin. Вкладывать деньги.
61
:1471
—1481
.7.Sapir
,D. G.
иWalser
,M.
(1977
)Сбережение азота при голодании путем инфузии кетокислот с разветвленной цепью
.Metab. Clin. Exp.
26
:301
—308
.8.Mitch
,WE
,Walser
,M.
иSapir
,DG
(1981
)Сбережение азота, вызванное лейцином, по сравнению с его кето-аналогом, μ-кетоизокапроатом, Человек с ожирением голодания
.J. Clin. Вкладывать деньги.
67
:553
—562
.9.Hagenfeldt
,L.
,Eriksson
,S.
иWahren
,J.
(1980
)Влияние лейцина на артериальные концентрации и региональный обмен аминокислот у здоровых субъектов
.Clin. Sci.
59
:173
—181
.10.Buse
,MG
,Atwell
,R.
иMancusi
,V.
(1979
)Влияние аминокислот с разветвленной цепью на рибосомный цикл в мышцах голодных крыс in vitro
.Horm. Метаб. Res.
11
:289
—292
. 11.McNurlan
,M.A.
,Папоротник
,E.B.
иGarlick
,P. J.
(1982
)Неспособность лейцина стимулировать синтез белка in vivo
.Biochem. J.
204
:831
—838
. 12.Гарлик
,П. Дж.
,МакНурлан
,М.A.
иPreedy
,V. R.
(1980
)Быстрый и удобный метод измерения скорости синтеза белка в тканях путем инъекции ( 3 H) фенилаланина
.Biochem. J.
192
:719
—723
. 13.Preedy
,V. R.
иGarlick
,P. J.
(1986
)Реакция синтеза мышечного белка на потребление питательных веществ у постабсорбтивных крыс: роль инсулина и аминокислот
.Biosci. Представитель
6
:177
—183
. 14.Garlick
,P.J.
,Fern
,M.
иPreedy
,V. R.
(1983
)Влияние инфузии инсулина и приема пищи на синтез мышечного белка у постабсорбтивных крыс
.Biochem. J.
210
:669
—676
. 15.Garlick
,P.J.
иGrant
,I.
(1988
)Инфузия аминокислот увеличивает чувствительность синтеза мышечного белка in vivo к инсулину
.Biochem J.
254
:579
—584
. 16.Dardevet
,D.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
иGrizard
,J.
(2002
)Постпрандиальная стимуляция синтеза мышечного белка у старых крыс может быть восстановлена приемом пищи с добавлением лейцина
.J. Nutr.
132
:95
—100
. 17.Rieu
,I.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
,Balage
,M.
,Papet
,I.
,Grizard
,J.
иDardevet
,D.
(2003
)Десятидневное кормление с добавлением лейцина благотворно влияет на мышцы после еды Синтез белка у старых крыс
.J. Nutr.
133
:1198
—1205
. 18.Anthony
,J. C.
,Anthony
,T. G.
иLayman
,D. K.
(1999
)Прием лейцина улучшает восстановление скелетных мышц у крыс после выполнения упражнения
.J. Nutr.
129
:1102
—1106
.19.Энтони
,Дж. К.
,Ланг
,К.H.
,Crozier
,SJ
,Anthony
,TG
,MacLean
,DA
,Kimball
,SR
иJefferson
,LS
(2002
) Вклад инсулина в трансляционный контроль синтеза белка в скелетных мышцах лейцином.г. J. Physiol. Эндокринол. Метаб.
282
:E1092
—E1101
.20.Энтони
,Дж.C.
,Reiter
,AK
,Anthony
,TG
,Crozier
,SJ
,Lang
,CH
,MacLean
,DA
,Kimball
, иJefferson
,LS
(2002
)Пероральный лейцин усиливает синтез белка в скелетных мышцах крыс с диабетом в отсутствие увеличения фосфорилирования 4E-BP1 или S6K1
.Диабет
51
:928
—936
. 21.Bolster
,DR
,Vary
,TC
,Kimball
,SR
иJefferson
,LS
(2004
)Лейцин регулирует инициацию трансляции в скелетных мышцах крысы с помощью улучшенного elF4G Фосфорилирование
.J. Nutr.
134
:1704
—1710
. 22.Kimball
,S.R.
иJefferson
,L. S.
(2004
)Молекулярные механизмы, посредством которых аминокислоты опосредуют передачу сигналов через мишень рапамицина
млекопитающих.Curr. Мнение. Clin. Nutr. Метаб. Уход
7
:39
—44
. 23.Kadowaki
,M.
иKanazawa
,T.
(2003
)Аминокислоты как регуляторы протеолиза
.Дж.Nutr.
133
:2052S
—2056
S.24.Энтони
,TG
,Энтони
,JC
,Йошизава
,F.
,Кимбалл
,SR
иДжефферсон
,LS
(2001 Орал администрация)
лейцина стимулирует трансляцию мРНК рибосомного белка, но не общие скорости синтеза белка в печени крыс
.J. Nutr.
131
:1171
—1176
0,25.Mortimore
,G. E.
&Pösö
,A. R.
(1987
)Катаболизм внутриклеточного белка и его контроль во время дефицита питательных веществ и снабжения
.Ann. Rev. Nutr.
7
:539
—564
0,26.Layman
,D. K.
&Baum
,J. I.
(2004
)Влияние диетического белка на гликемический контроль во время потери веса
.J Nutr.
134
:968S
—973
S.© 2005 Американское общество диетологии
Роль лейцина в регуляции метаболизма белков | Журнал питания
РЕФЕРАТ
Исследования как in vivo, так и in vitro показали, что лейцин в очень высоких дозах может стимулировать синтез мышечного белка, эффект, который усиливается in vivo инсулином, секретируемым в ответ на дозу лейцина.Высокий уровень лейцина также может ингибировать деградацию белка в скелетных мышцах, а также в печени. Напротив, при нормальных физиологических уровнях увеличение концентрации лейцина путем инфузии стимулирует синтез мышечного белка за счет повышения его чувствительности к инсулину. Сделан вывод о том, что роль лейцина in vivo заключается в предоставлении сигнала о доступности аминокислот, который в сочетании с сигналом доступности энергии от инсулина стимулирует синтез мышечного белка.
В 1970-х годах ряд лабораторий проводили in vitro исследования факторов, контролирующих обмен белка в тканях.Среди этих факторов были гормоны, например, инсулин, и сами субстраты для синтеза белка, аминокислоты. Эти исследования показали, что высокие концентрации всех аминокислот стимулировали синтез белка и ингибировали деградацию белка, особенно в скелетных мышцах (1–3), но также и в сердечной мышце (4). В частности, на сердце было показано, что стимуляция аминокислотами может быть воспроизведена только с 3 аминокислотами с разветвленной цепью (BCAA; лейцин, изолейцин и валин) (5), тогда как в изолированной мышце диафрагмы только лейцин, как а также полная смесь аминокислот стимулировала синтез белка (2).Эта группа исследований из нескольких лабораторий положила начало непрерывной серии исследований роли лейцина в контроле массы тканевого белка, его механизма действия и его возможного значения для увеличения отложения мышечного белка у здоровых субъектов или замедления потери мышечного белка. в катаболических состояниях.
Попытки продемонстрировать действие лейцина in vivo
Исходя из того, что если лейцин стимулирует синтез мышечного белка и ингибирует деградацию, тогда добавки лейцина могут быть эффективными для ограничения потери белка у людей с патологическими состояниями, потенциал дополнительного лейцина для улучшения баланса белка во время голодания был исследован в нескольких лабораториях.Несколько групп показали, что введение лейцина или кетокислотных аналогов BCAA голодающим пациентам улучшает азотный баланс (6–8), предполагая, что лейцин действительно может экономить белок организма. Однако этот эффект, по-видимому, не был результатом улучшения белкового баланса в скелетных мышцах у голодных субъектов, поскольку отток из ног аминокислот фенилаланина и тирозина не изменился у субъектов с бедренными артериальными и венозными катетерами (9). Эти аминокислоты не метаболизируются в скелетных мышцах, поэтому их отток является индикатором чистого отрицательного белкового баланса в ткани.Тем не менее, эти первые результаты у людей, предполагающие, что добавка BCAA может сдерживать потерю белка, которая происходит при многих патологических состояниях, привели к большому количеству исследований их эффективности у пациентов, страдающих такими состояниями, как сепсис и травмы, а также для улучшения мышечной массы. функции у спортсменов.
Исследования эффектов лейцина или BCAA на интактных крысах не дали результатов. Buse et al. (10) вводили голодным крысам лейцин плюс глюкозу плюс инсулин и наблюдали стимуляцию агрегации мышечных полирибосом, что указывало на увеличение синтеза мышечного белка.Однако в серии исследований на растущих крысах, которым вводили только лейцин (1 ммоль / кг), не было обнаружено изменений в синтезе белка в икроножной мышце, сердце, серозной оболочке тощей кишки, слизистой оболочке тощей кишки или печени (11). В этих исследованиях синтез белка измеряли путем внутривенной инъекции избыточной дозы [ 3 H] фенилаланина (12) с последующим умерщвлением крыс через 10 минут; лейцин (или физиологический раствор) вводили вместе с изотопом. Отдельные группы крыс либо кормили, либо лишали пищи на 2 дня, либо получали безбелковую диету в течение 9 дней, но ни в одной группе не было обнаружено изменений в синтезе мышечного белка.В дополнительном эксперименте, разработанном для того, чтобы показать, требуется ли более 10 минут для демонстрации изменения синтеза белка, двумерным крысам, лишенным пищи, внутрибрюшинно вводили лейцин, и синтез белка измеряли через 30 минут. Как и прежде, никаких изменений не обнаружено. В целом, эти исследования показали, что введение лейцина в дозе 1 ммоль / кг (что приводит к концентрации в плазме ~ 1 ммоль / л; примерно в 8 раз выше, чем у крыс, которым кормили) растущим крысам не оказывало заметного воздействия на мышечный белок. синтез.
Лейцин и реакция на питание в мышцах растущих крыс
В естественном состоянии лейцин не назначается отдельно, а входит в состав еды и, таким образом, сопровождается сбалансированной смесью других аминокислот и повышенными концентрациями глюкозы и инсулина. Измерения на молодых крысах (масса тела ~ 100–150 г) показали, что синтез мышечного белка стимулируется поступлением питательных веществ внутрижелудочно или внутривенно (13). Внутривенное вливание инсулина и глюкозы для предотвращения гипогликемии также стимулировало синтез мышечного белка у крыс, лишенных пищи, но только тогда, когда концентрация инсулина в плазме была выше, чем обычно наблюдается у кормленных крыс (14).Более того, кормление крыс антиинсулиновой сывороткой не увеличивало синтез мышечного белка (13), показывая, что инсулин необходим для ответа на синтез белка. Точно так же инфузия полной смеси аминокислот не усиливала синтез мышечного белка, если, кроме того, концентрация инсулина не была повышена инфузией глюкозы, что привело к гипотезе о том, что увеличение синтеза белка после кормления является результатом повышения чувствительности тканей. к инсулину, вызванному аминокислотами (13).Эта гипотеза была подтверждена измерением доза-ответ синтеза мышечного белка на инфузию инсулина в присутствии и в отсутствие инфузии полной смеси аминокислот [рис. 1, исх. (15)]. Из кривых видно, что без аминокислот синтез белка возрастал криволинейно, но не достиг максимума при самой высокой скорости инфузии инсулина, что дало концентрацию инсулина в плазме ~ 160 мкЕд / мл. Это резко контрастировало с кривой у крыс, которым вводили вливания смеси аминокислот в дополнение к инсулину.Эта кривая была максимальной при гораздо более низкой концентрации инсулина, которая была аналогична таковой у крыс, получавших корм (~ 15-25 мкЕд / мл).
РИСУНОК 1
Дозозависимая реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот. Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
РИСУНОК 1
Доза-реакция синтеза мышечного белка у растущих крыс на инфузию инсулина плюс физиологический раствор или полную смесь аминокислот.Каждая точка представляет данные от 5 или 6 крыс. Данные из (15).
В описанном выше исследовании (15) были проведены дополнительные эксперименты для характеристики специфичности повышения чувствительности к инсулину для отдельных аминокислот или групп аминокислот. Концентрация инсулина около 20 мкЕд / мл, которая недостаточна для стимуляции синтеза белка сама по себе, была достигнута инфузией глюкозы с низкой скоростью во всех группах. На рисунке 2 показано, что по сравнению с одной инфузией глюкозы синтез белка стимулировался в равной степени всей смесью, только незаменимыми аминокислотами и только BCAA (15).Это демонстрирует, что именно BCAA повышают чувствительность синтеза мышечного белка к инсулину. Этот вывод был подтвержден в эксперименте, показанном на рисунке 3, который показывает, что смесь аминокислот без BCAA не эффективна для стимуляции синтеза белка. Более того, как показано на Рисунке 4, действие BCAA можно полностью объяснить лейцином, который имел тот же эффект, что и 3 BCAA вместе, тогда как изолейцин и валин не имели никакого эффекта.
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только несущественные аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 2
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили только глюкозу (для обеспечения инсулина на уровне, типичном для кормленных крыс) или глюкозу плюс полную смесь аминокислот, только незаменимые аминокислоты, только заменимые аминокислоты или только 3 BCAA.Неполные смеси содержали отдельные аминокислоты в тех же концентрациях, что и полная смесь. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные из (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полная смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 3
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, плюс полную смесь аминокислот, полные аминокислоты за вычетом BCAA или только 3 BCAA.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. & Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
РИСУНОК 4
Скорость синтеза белка в скелетных мышцах растущих крыс, которым вводили глюкозу, как показано на рисунке 2, либо отдельно, с 3 BCAA, либо с лейцином, валином или изолейцином по отдельности.Остальные детали представлены на фиг. 2. Планки погрешностей представляют собой SEM групп из 5 или 6 крыс, а значения P сравниваются с группой «только глюкоза». Данные (Garlick, P.J. и Grant, I., 1988, неопубликованные результаты) были получены как продолжение исследований, описанных в (15).
Заключение вышеупомянутых исследований заключалось в том, что во время кормления лейцин повышает чувствительность синтеза белка к инсулину, вызывая стимуляцию синтеза мышечного белка. Последующее исследование проверило гипотезу о том, что притупленная реакция синтеза мышечного белка на кормление у старых крыс может быть восстановлена путем кормления диеты с добавлением лейцина (16).Взрослых и старых крыс лишали пищи, а затем снова кормили нормальной диетой в течение 1 часа или диетой с добавлением лейцина. При обычном питании взрослые крысы ответили на кормление увеличением синтеза мышечного белка, тогда как старые крысы — нет. Однако, когда еда содержала дополнительный лейцин, в обеих группах наблюдалось аналогичное увеличение синтеза белка. В последующем исследовании (17) было показано, что это преимущество для старых крыс сохранялось после 10 дней кормления диетой с добавлением лейцина.
Недавние исследования лейцина как регулятора синтеза мышечного белка
В последние годы вопрос о лейцине и его способности изменять синтез белка был повторно исследован и привел к прогрессу в понимании механизмов пищевой регуляции синтеза белка на молекулярном уровне. При исследовании снижения синтеза мышечного белка после тренировки у крыс было замечено, что введение лейцина восстанавливало синтез белка до той же величины, что и у нетренированных крыс (18).Более того, этот эффект был таким же, когда глюкоза вводилась вместе с лейцином, что позволяет предположить, что эффект не зависел от инсулина. Заметным различием между этим и предыдущими исследованиями была доза лейцина, которая вводилась через желудочный зонд, а не внутривенно, и была в 10 раз выше (10 ммоль / кг), чем в более ранних исследованиях (11). Последующие исследования выявили взаимодействие между лейцином и секрецией инсулина в этих более высоких дозах. После перорального введения лейцина (10 ммоль / кг) крысам, лишенным пищи, скорость синтеза белка увеличивалась более чем на 50%, возвращаясь к исходным уровням только через 2 часа (19).Также было отмечено, что уровень инсулина временно повышался, достигая пика примерно в 3 раза по сравнению с базальным уровнем через 30 минут (19). Это привело к эксперименту, в котором секреция инсулина подавлялась инфузией соматостатина, что приводило к отмене влияния лейцина на синтез белка (19). Это означало, что ответ на лейцин инсулино-зависимый. Однако в другом исследовании было показано, что введение лейцина стимулирует синтез белка у крыс с диабетом, предполагая, что лейцин может оказывать прямое влияние на синтез белка в дополнение к инсулинозависимой стимуляции (20).Наблюдение за тем, что лейцин стимулирует синтез мышечного белка в перфузируемой задней конечности крысы (21), также свидетельствует о существовании инсулинозависимого механизма.
Эти исследования также объясняют, почему некоторые из более ранних исследований влияния лейцина на синтез мышечного белка не смогли обнаружить стимуляции [например, исх. (11)]. Дозы лейцина, хотя и достаточно велики, чтобы вызвать повышение концентрации лейцина в плазме, как при приеме пищи, были слишком малы, чтобы усилить синтез белка сами по себе, и слишком малы, чтобы вызвать секрецию инсулина.Напротив, в исследовании Buse et al. (10), лейцин давали вместе с глюкозой и инсулином, которые, как описано выше, усиливают действие лейцина.
Работа, описанная выше, привела к значительному прогрессу в понимании путей передачи сигнала, участвующих в контроле синтеза мышечного белка с помощью аминокислот и инсулина. Детали этих достижений изложены в недавнем обзоре (22) и здесь не будут описаны.
Другие эффекты лейцина
Большинство исследований влияния лейцина на метаболизм белков сосредоточено на синтезе белка в скелетных мышцах.Однако есть также доказательства того, что лейцин ингибирует деградацию белка в мышцах (2), которая в этой ткани происходит в основном через убиквитин-протеасомный путь (23). В отличие от мышц, в печени лейцин не влияет на общий синтез белка, хотя есть стимуляция синтеза рибосомального белка (24). Основное влияние лейцина на печень, по-видимому, связано с протеолизом, который в этой ткани преимущественно лизосомный (23,25). Однако, в отличие от мышц, лейцин не уникален, но является наиболее сильнодействующим из группы из 8 аминокислот, которые называются «регуляторными» (25).В эту группу также входят тирозин, фенилаланин, глутамин, пролин, гистидин, триптофан и метионин (25).
Выводы: роль лейцина
Очень высокие концентрации лейцина обладают способностью стимулировать синтез белка и подавлять деградацию белка в скелетных мышцах интактных крыс. Этот эффект на синтез белка может быть усилен кратковременным, но небольшим повышением уровня инсулина в сыворотке, вызванным дозой лейцина. Однако в пределах нормального физиологического диапазона концентраций лейцина и инсулина у крыс, лишенных пищи и кормленных, чувствительность синтеза мышечного белка к инсулину усиливается инфузией лейцина, так что синтез белка стимулируется умеренно повышенными концентрациями инсулина и лейцина. которые типичны для откормленных крыс.Следовательно, физиологическая роль лейцина состоит в том, чтобы работать с инсулином, чтобы активировать переключатель, который стимулирует синтез мышечного белка, когда становятся доступными аминокислоты и энергия из пищи. Преимущество этого режима регулирования заключается в том, что для переключения требуется одновременное присутствие как аминокислот (лейцин), так и энергии (инсулин), поэтому он активируется только при идеальных условиях.
Роль лейцина как усилителя чувствительности к инсулину также подразумевает возможность того, что длительное очень высокое потребление лейцина может привести к инсулинорезистентности аналогично инсулинорезистентности, возникающей в результате продолжительной гипергликемии.В конечном итоге это может привести к подавлению стимуляции синтеза мышечного белка при приеме пищи. Более того, поскольку части сигнальных путей от инсулина к синтезу белка являются общими с теми, которые участвуют в регуляции метаболизма глюкозы, как обсуждалось ранее (26), существует вероятность того, что чрезмерная стимуляция лейцином может привести к нарушениям метаболизма глюкозы. Таким образом, поиск «верхнего уровня» диетического лейцина может включать в себя исследование эффектов длительного высокого потребления лейцина на гомеостаз и метаболизм глюкозы.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.Fulks
,R.H.
,Li
,J. B.
иGoldberg
,A. L.
(1975
)Влияние инсулина, глюкозы и аминокислот на обмен белков в диафрагмах крыс
.J. Biol. Chem.
250
:290
—298
. 2.Buse
,M. G.
иReid
,S. S.
(1975
)Лейцин: возможный регулятор белкового обмена в мышцах
.J. Clin. Вкладывать деньги.
56
:1250
—1261
.3.Li
,J. B.
иJefferson
,L. S.
(1978
)Влияние доступности аминокислот на обмен белка в перфузируемых скелетных мышцах
.Биохим. Биофиз. Acta.
544
:351
—359
. 4.Morgan
,H. E.
,Earl
,D.C.N.
,Broadus
,E.B.
,Giger
,K. E.
иJefferson
,L. S.
(1971
)Регуляция синтеза белка в сердечной мышце. I. Влияние уровня аминокислот на синтез белка
.J. Biol. Chem.
246
:2152
—2162
. 5.Rannels
,D. E.
,Hjalmarson
,A. C.
иMorgan
,H. E.
(1974
)Влияние неуглеводных веществ на синтез белка в мышцах
.Am J. Physiol.
226
:528
—539
.6.Sherwin
,R. S.
(1978
)Влияние голодания на обмен и метаболический ответ на лейцин
.J. Clin. Вкладывать деньги.
61
:1471
—1481
.7.Sapir
,D. G.
иWalser
,M.
(1977
)Сбережение азота при голодании путем инфузии кетокислот с разветвленной цепью
.Metab. Clin. Exp.
26
:301
—308
.8.Mitch
,WE
,Walser
,M.
иSapir
,DG
(1981
)Сбережение азота, вызванное лейцином, по сравнению с его кето-аналогом, μ-кетоизокапроатом, Человек с ожирением голодания
.J. Clin. Вкладывать деньги.
67
:553
—562
.9.Hagenfeldt
,L.
,Eriksson
,S.
иWahren
,J.
(1980
)Влияние лейцина на артериальные концентрации и региональный обмен аминокислот у здоровых субъектов
.Clin. Sci.
59
:173
—181
.10.Buse
,MG
,Atwell
,R.
иMancusi
,V.
(1979
)Влияние аминокислот с разветвленной цепью на рибосомный цикл в мышцах голодных крыс in vitro
.Horm. Метаб. Res.
11
:289
—292
. 11.McNurlan
,M.A.
,Папоротник
,E.B.
иGarlick
,P. J.
(1982
)Неспособность лейцина стимулировать синтез белка in vivo
.Biochem. J.
204
:831
—838
. 12.Гарлик
,П. Дж.
,МакНурлан
,М.A.
иPreedy
,V. R.
(1980
)Быстрый и удобный метод измерения скорости синтеза белка в тканях путем инъекции ( 3 H) фенилаланина
.Biochem. J.
192
:719
—723
. 13.Preedy
,V. R.
иGarlick
,P. J.
(1986
)Реакция синтеза мышечного белка на потребление питательных веществ у постабсорбтивных крыс: роль инсулина и аминокислот
.Biosci. Представитель
6
:177
—183
. 14.Garlick
,P.J.
,Fern
,M.
иPreedy
,V. R.
(1983
)Влияние инфузии инсулина и приема пищи на синтез мышечного белка у постабсорбтивных крыс
.Biochem. J.
210
:669
—676
. 15.Garlick
,P.J.
иGrant
,I.
(1988
)Инфузия аминокислот увеличивает чувствительность синтеза мышечного белка in vivo к инсулину
.Biochem J.
254
:579
—584
. 16.Dardevet
,D.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
иGrizard
,J.
(2002
)Постпрандиальная стимуляция синтеза мышечного белка у старых крыс может быть восстановлена приемом пищи с добавлением лейцина
.J. Nutr.
132
:95
—100
. 17.Rieu
,I.
,Sornet
,C.
,Bayle
,G.
,Prugnaud
,J.
,Pouyet
,C.
,Balage
,M.
,Papet
,I.
,Grizard
,J.
иDardevet
,D.
(2003
)Десятидневное кормление с добавлением лейцина благотворно влияет на мышцы после еды Синтез белка у старых крыс
.J. Nutr.
133
:1198
—1205
. 18.Anthony
,J. C.
,Anthony
,T. G.
иLayman
,D. K.
(1999
)Прием лейцина улучшает восстановление скелетных мышц у крыс после выполнения упражнения
.J. Nutr.
129
:1102
—1106
.19.Энтони
,Дж. К.
,Ланг
,К.H.
,Crozier
,SJ
,Anthony
,TG
,MacLean
,DA
,Kimball
,SR
иJefferson
,LS
(2002
) Вклад инсулина в трансляционный контроль синтеза белка в скелетных мышцах лейцином.г. J. Physiol. Эндокринол. Метаб.
282
:E1092
—E1101
.20.Энтони
,Дж.C.
,Reiter
,AK
,Anthony
,TG
,Crozier
,SJ
,Lang
,CH
,MacLean
,DA
,Kimball
, иJefferson
,LS
(2002
)Пероральный лейцин усиливает синтез белка в скелетных мышцах крыс с диабетом в отсутствие увеличения фосфорилирования 4E-BP1 или S6K1
.Диабет
51
:928
—936
. 21.Bolster
,DR
,Vary
,TC
,Kimball
,SR
иJefferson
,LS
(2004
)Лейцин регулирует инициацию трансляции в скелетных мышцах крысы с помощью улучшенного elF4G Фосфорилирование
.J. Nutr.
134
:1704
—1710
. 22.Kimball
,S.R.
иJefferson
,L. S.
(2004
)Молекулярные механизмы, посредством которых аминокислоты опосредуют передачу сигналов через мишень рапамицина
млекопитающих.Curr. Мнение. Clin. Nutr. Метаб. Уход
7
:39
—44
. 23.Kadowaki
,M.
иKanazawa
,T.
(2003
)Аминокислоты как регуляторы протеолиза
.Дж.Nutr.
133
:2052S
—2056
S.24.Энтони
,TG
,Энтони
,JC
,Йошизава
,F.
,Кимбалл
,SR
иДжефферсон
,LS
(2001 Орал администрация)
лейцина стимулирует трансляцию мРНК рибосомного белка, но не общие скорости синтеза белка в печени крыс
.J. Nutr.
131
:1171
—1176
0,25.Mortimore
,G. E.
&Pösö
,A. R.
(1987
)Катаболизм внутриклеточного белка и его контроль во время дефицита питательных веществ и снабжения
.Ann. Rev. Nutr.
7
:539
—564
0,26.Layman
,D. K.
&Baum
,J. I.
(2004
)Влияние диетического белка на гликемический контроль во время потери веса
.J Nutr.
134
:968S
—973
S.© 2005 Американское общество диетологии
Влияние лейцина на метаболизм аминокислот и глюкозы у человека
Сообщается, что лейцин является важным регулятором метаболизма белков. Мы исследовали влияние внутривенной инфузии l-лейцина по сравнению с физиологическим раствором на метаболизм аминокислот у восьми здоровых людей.Концентрации аминокислот в плазме были измерены, и обмен белка был оценен с использованием 1- (1- 13 C) лизина и 1- (3,3,3- 2 H 3 ) лейцина в качестве индикаторов. Кинетику глюкозы измеряли с использованием d- (6,6- 2 H 2 ) глюкозы в качестве индикатора. Инфузия лейцина увеличивала концентрацию лейцина в плазме с 103 ± 8 до 377 ± 35 мкмоль / л ( P <0,01). Плазменные концентрации незаменимых аминокислот, включая треонин, метионин, изолейцин, валин, тирозин и фенилаланин, были значительно снижены инфузией лейцина.Инфузия лейцина существенно не изменила поток лизина (108 ± 4 в физиологическом растворе против 101 ± 4 мк моль / кг / ч -1 во время инфузии лейцина), но уменьшила окисление лизина (13,2 ± 0,9 против 10,7 ± 1 мк моль / кг / ч, P <0,05) и поток эндогенного лейцина (от 128 ± 4 до 113 ± 7 мкмоль / кг / ч, P <0,05) в плазме ( 2 H 3 ) кетоизокапроат (KIC) использовали для расчета. Во время инфузии лейцина соотношение обогащения плазмы ( 2 H 3 ) KIC до ( 2 H 3 ) лейцином увеличивалось с 0.От 76 ± 0,02 до 0,88 ± 0,01 ( P <.001), тогда как оценка потока лейцина с использованием плазмы ( 2 H 3 ) лейцина не показала изменений в потоке эндогенного лейцина. Инфузия лейцина снизила выработку глюкозы в печени и метаболический клиренс глюкозы, но не изменила плазменные концентрации глюкозы, инсулина, С-пептида, глюкагона, адреналина, норэпинефрина или свободных жирных кислот. Мы пришли к выводу, что лейцин сохраняет катаболизм глюкозы и лизина и снижает плазменные концентрации незаменимых аминокислот.Это исследование также продемонстрировало, что соотношение обогащения KIC в плазме и обогащения лейцином не остается постоянным во всех условиях исследования.
Новые метаболические и физиологические функции аминокислот с разветвленной цепью: обзор | Журнал зоотехники и биотехнологии
Ву Г. Функциональные аминокислоты в питании и здоровье. Аминокислоты. 2013; 45: 407–11.
CAS PubMed Статья Google ученый
Фройнд Н., Йошимура Н., Лунетта Л., Фишер Дж. Роль аминокислот с разветвленной цепью в снижении катаболизма мышц in vivo. Хирургия. 1978; 83: 611–8.
CAS PubMed Google ученый
Hedden MP, Buse MG. Общая стимуляция синтеза мышечного белка аминокислотами с разветвленной цепью in vitro. Exp Biol Med. 1979; 160: 410–5.
CAS Статья Google ученый
Лимонный PW. Потребности силовых атлетов в белках и аминокислотах. Int J Sport Nutr. 1991; 1: 127–45.
CAS PubMed Статья Google ученый
Norton LE, непрофессионал DK. Лейцин регулирует инициацию трансляции синтеза белка в скелетных мышцах после тренировки. J Nutr. 2006; 136: 533С – 7С.
CAS PubMed Google ученый
Наир К.С., Короткий КР.Гормональная и сигнальная роль аминокислот с разветвленной цепью. J Nutr. 2005; 135: 1547S – 52S.
CAS PubMed Google ученый
Танти Дж. Ф., Ягер Дж. Клеточные механизмы инсулинорезистентности: роль стресс-регулируемых сериновых киназ и фосфорилирования серина субстратов инсулинового рецептора (IRS). Curr Opin Pharmacol. 2009. 9: 753–62.
CAS PubMed Статья Google ученый
Абдалла САС, Эльфаги Р. Перспективы взаимодействия липидов и аминокислот с разветвленной цепью (BCAA) в развитии инсулинорезистентности. Лекарство. 2014; 1: 8–12.
Google ученый
Negro M, Giardina S, Marzani B, Marzatico F. Прием аминокислот с разветвленной цепью не улучшает спортивные результаты, но влияет на восстановление мышц и иммунную систему. J Sports Med Phys Fitness. 2008. 48: 347–51.
CAS PubMed Google ученый
Теодоро СКФ, Вианна Д., Торрес-Леал, Флорида, Панталеан ЛК, Матос-Нето Е.М., Донато Дж. И др. Лейцин необходим для ослабления задержки роста плода, вызванной диетой с ограничением белка у крыс. J Nutr. 2012; 142: 924–30.
CAS PubMed Статья Google ученый
Lei J, Feng D, Zhang Y, Dahanayaka S, Li X, Yao K и др. Регулирование катаболизма лейцина метаболическим топливом в эпителиальных клетках молочной железы. Аминокислоты.2012; 43: 2179–89.
CAS PubMed Статья Google ученый
Li P, Knabe DA, Kim SW, Lynch CJ, Hutson SM, Wu G. Лактирующая ткань молочной железы свиньи катаболизирует аминокислоты с разветвленной цепью для синтеза глутамина и аспартата. J Nutr. 2009; 139: 1502–9.
CAS PubMed PubMed Central Статья Google ученый
Нисимура Дж., Масаки Т., Аракава М., Сейке М., Йошимацу Х.Изолейцин предотвращает накопление тканевых триглицеридов и усиливает экспрессию PPARα и разобщающего белка у мышей с ожирением, вызванным диетой. J Nutr. 2010; 140: 496–500.
CAS PubMed Статья Google ученый
Дои М., Ямаока И., Фукунага Т., Накаяма М. Изолейцин, мощная аминокислота, снижающая уровень глюкозы в плазме, стимулирует захват глюкозы в мышечных трубках C2C12. Biochem Biophys Res Commun. 2003; 312: 1111–7.
CAS PubMed Статья Google ученый
Newgard CB, An J, Bain JR, Muehlbauer MJ, Stevens RD, Lien LF и др. Метаболическая характеристика, связанная с аминокислотами с разветвленной цепью, которая отличает людей с ожирением и худощавым телом и способствует развитию инсулинорезистентности. Cell Metab. 2009; 9: 311–26.
CAS PubMed PubMed Central Статья Google ученый
Kainulainen H, Hulmi JJ, Kujala UM. Возможная роль катаболизма аминокислот с разветвленной цепью в регулировании окисления жиров.Exerc Sport Sci Rev.2013; 41: 194–200.
PubMed Статья Google ученый
Непрофессионал Д. К., Буало Р. А., Эриксон Д. Д., Пейнтер Дж. Э., Шиуэ Х., Сатер С. и др. Уменьшение соотношения углеводов и белков в рационе улучшает состав тела и липидный профиль крови во время похудания у взрослых женщин. J Nutr. 2003; 133: 411–7.
CAS PubMed Google ученый
Ноукс М., Кио Дж. Б., Фостер PR, Клифтон П.М. Влияние калорийной диеты с высоким содержанием белка и низким содержанием жиров по сравнению с традиционной диетой с высоким содержанием углеводов и низким содержанием жиров на потерю веса, состав тела, статус питания и показатели сердечно-сосудистой системы у женщин с ожирением. Am J Clin Nutr. 2005. 81: 1298–306.
CAS PubMed Google ученый
Crozier SJ, Kimball SR, Emmert SW, Anthony JC, Jefferson LS. Пероральное введение лейцина стимулирует синтез белка в скелетных мышцах крыс.J Nutr. 2005. 135: 376–82.
CAS PubMed Google ученый
Гуо Ф, Кавенер DR. Киназа GCN2 eIF2α регулирует гомеостаз жирных кислот в печени во время депривации незаменимой аминокислоты. Cell Metab. 2007; 5: 103–14.
CAS PubMed Статья Google ученый
Cheng Y, Meng Q, Wang C, Li H, Huang Z, Chen S, et al. Депривация лейцина снижает жировую массу за счет стимуляции липолиза в белой жировой ткани и активации разобщающего белка 1 (UCP1) в коричневой жировой ткани.Сахарный диабет. 2010; 59: 17–25.
CAS PubMed Статья Google ученый
Du Y, Meng Q, Zhang Q, Guo F. Депривация изолейцина или валина стимулирует потерю жира за счет увеличения расхода энергии и регулирования липидного обмена в WAT. Аминокислоты. 2012; 43: 725–34.
CAS PubMed Статья Google ученый
Бай Дж., Грин Э., Ли В., Кидд М.Т., Дриди С.Аминокислоты с разветвленной цепью модулируют экспрессию генов, связанных с метаболизмом жирных кислот в печени, у кур-бройлеров. Mol Nutr Food Res. 2015; 59: 1171–81.
CAS PubMed Статья Google ученый
Бернард Дж. Р., Ляо Ю. Х., Доернер П. Г., Динг З., Се М., Ван В. и др. Смесь аминокислот необходима для оптимизации инсулино-стимулированного поглощения глюкозы и транслокации GLUT4 в перфузируемой мышце задних конечностей грызунов. J Appl Physio.2012; 113: 97–104.
CAS Статья Google ученый
Нишитани С., Такехана К., Фудзитани С., Сонака И. Аминокислоты с разветвленной цепью улучшают метаболизм глюкозы у крыс с циррозом печени. Am J Physiol Gastrointest Liver Physiol. 2005; 288: G1292–300.
CAS PubMed Статья Google ученый
Doi M, Yamaoka I, Nakayama M, Mochizuki S, Sugahara K, Yoshizawa F.Изолейцин, аминокислота, снижающая уровень глюкозы в крови, увеличивает захват глюкозы в скелетных мышцах крыс в отсутствие повышения активности АМФ-активированной протеинкиназы. J Nutr. 2005; 135: 2103–8.
CAS PubMed Google ученый
Дои М., Ямаока И., Накаяма М., Сугахара К., Йошизава Ф. Гипогликемический эффект изолейцина включает повышенное поглощение мышечной глюкозы и окисление глюкозы в организме, а также снижение глюконеогенеза в печени.Am J Physiol Endocrinol Metab. 2007; 292: E1683–93.
CAS PubMed Статья Google ученый
Li C, Najafi H, Daikhin Y, Nissim IB, Collins HW, Yudkoff M, et al. Регуляция лейцин-стимулированной секреции инсулина и метаболизма глутамина в изолированных островках крысы. J Biol Chem. 2003. 278: 2853–8.
CAS PubMed Статья Google ученый
Lund S, Holman G, Schmitz O, Pedersen O. Сокращение стимулирует транслокацию переносчика глюкозы GLUT4 в скелетных мышцах по механизму, отличному от механизма инсулина. Proc Natl Acad Sci U S. A. 1995; 92: 5817–21.
CAS PubMed PubMed Central Статья Google ученый
Koivisto UM, Martinez-Valdez H, Bilan P, Burdett E, Ramlal T., Klip A. Дифференциальная регуляция систем транспорта глюкозы GLUT-1 и GLUT-4 глюкозой и инсулином в мышечных клетках L6 в культуре .J Biol Chem. 1991; 266: 2615–21.
CAS PubMed Google ученый
Чен Х.С., Бандйопадхьяй Г., Саджан М.П., Кано Й., Стэндаерт М., Фарезе Р.В. Активация пути ERK и изоформ атипичной протеинкиназы C в транспорте глюкозы, стимулированном физической нагрузкой и аминоимидазол-4-карбоксамид-1-β-d-рибозидом (AICAR). J Biol Chem. 2002; 277: 23554–62.
CAS PubMed Статья Google ученый
Zhang SH, Yang Q, Ren M, Qiao SY, He PL, Li DF, et al. Влияние изолейцина на поглощение глюкозы за счет увеличения концентраций GLUT1 и GLUT4 в мышечной мембране и концентрации Na + / содранспортера глюкозы 1 (SGLT-1) и GLUT2 в кишечной мембране Br J Nutr. 2016; 116: 593–602.
CAS PubMed Статья Google ученый
Энтони Дж. К., Энтони Т. Г., обыватель DK. Добавки лейцина ускоряют восстановление скелетных мышц у крыс после физических упражнений.J Nutr. 1999. 129: 1102–6.
CAS PubMed Google ученый
Энтони Дж. К., Йошизава Ф., Энтони Т. Г., Вэри Т.К., Джефферсон Л.С., Кимбалл С.Р. Лейцин стимулирует инициацию трансляции в скелетных мышцах постабсорбтивных крыс посредством чувствительного к рапамицину пути. J Nutr. 2000; 130: 2413–9.
CAS PubMed Google ученый
Энтони Дж.С., Энтони Т.Г., Кимбалл С.Р., Вэри Т.К., Джефферсон Л.С.Перорально вводимый лейцин стимулирует синтез белка в скелетных мышцах постабсорбтивных крыс в сочетании с повышенным образованием eIF4F. J Nutr. 2000. 130: 139–45.
CAS PubMed Google ученый
Bolster DR, Vary TC, Kimball SR, Jefferson LS. Лейцин регулирует инициацию трансляции в скелетных мышцах крысы посредством повышенного фосфорилирования eIF4G. J Nutr. 2004. 134: 1704–10.
CAS PubMed Google ученый
Купман Р., Вагенмакерс А., Мандерс Р., Антуан Х., Джоан М., Марчел Дж. И др. Комбинированный прием белка и свободного лейцина с углеводами увеличивает синтез мышечного белка после тренировки in vivo у мужчин. Am J Physiol Endocrinol Metabo. 2005; 288: E645–53.
Энтони Дж. К., Рейтер А. К., Энтони Т. Г., Крозье С. Дж., Ланг С. К., Маклин Д. А. и др. Перорально вводимый лейцин усиливает синтез белка в скелетных мышцах крыс с диабетом при отсутствии увеличения фосфорилирования 4E-BP1 или S6K1.Сахарный диабет. 2002; 51: 928–36.
CAS PubMed Статья Google ученый
Эскобар Дж., Фрэнк Дж. У., Сурьяван А., Нгуен Х. В., Кимбалл С. Р., Джефферсон Л. С. и др. Повышение физиологического уровня лейцина в плазме стимулирует синтез мышечного белка у новорожденных свиней за счет усиления активации фактора инициации трансляции. Am J Physiol Endocrinol Metab. 2005; 288: E914–21.
CAS PubMed Статья Google ученый
Suryawan A, Jeyapalan AS, Orellana RA, Wilson FA, Nguyen HV, Davis TA. Лейцин стимулирует синтез белка в скелетных мышцах новорожденных свиней за счет усиления активации mTORC1. Am J Physiol Endocrinol Metab. 2008; 295: E868–75.
CAS PubMed PubMed Central Статья Google ученый
Дэвис Т.А., Фиоротто М.Л., Буррин Д.Г., Ридс П.Дж., Нгуен Х.В., Беккет П.Р. и др. Стимуляция синтеза протеина как инсулином, так и аминокислотами уникальна для скелетных мышц новорожденных свиней.Am J Physiol Endocrinol Metab. 2002; 282: E880–90.
CAS PubMed Статья Google ученый
Драммонд М.Дж., Расмуссен ББ. Питательные вещества, обогащенные лейцином, и регуляция у млекопитающих-мишеней передачи сигналов рапамицина и синтеза белка скелетных мышц человека. Curr Opin Clin Nutr Metab Care. 2008; 11: 222–6.
CAS PubMed PubMed Central Статья Google ученый
Купман Р., Вагенмейкерс А.Дж., Мандерс Р.Дж., Зоренц А.Х., Сенден Дж.М., Горселинк М. и др. Комбинированный прием белка и свободного лейцина с углеводами увеличивает синтез мышечного белка после тренировки in vivo у мужчин. Am J Physiol Endocrinol Metab. 2005; 288: E645–53.
CAS PubMed Статья Google ученый
Эскобар Дж., Фрэнк Дж. В., Сурьяван А., Нгуен Х. В., Ван Хорн К. Г., Хатсон С. М. и др. Лейцин и α-кетоизокапроновая кислота, но не норлейцин, стимулируют синтез белка скелетных мышц у новорожденных свиней.J Nutr. 2010; 140: 1418–24.
CAS PubMed PubMed Central Статья Google ученый
Эскобар Дж., Фрэнк Дж. У., Сурьяван А., Нгуен Х. В., Дэвис Т. А.. Доступность аминокислот и возраст влияют на стимуляцию лейцином синтеза белка и образование eIF4F в мышцах. Am J Physiol Endocrinol Metab. 2007; 293: E1615–21.
CAS PubMed PubMed Central Статья Google ученый
Boutry C, El-Kadi SW, Suryawan A, Wheatley SM, Orellana RA, Kimball SR, et al. Импульсы лейцина усиливают синтез белка скелетных мышц во время непрерывного кормления новорожденных свиней. Am J Physiol Endocrinol Metab. 2013; 305: E620–31.
CAS PubMed PubMed Central Статья Google ученый
Torrazza RM, Suryawan A, Gazzaneo MC, Orellana RA, Frank JW, Nguyen HV, et al. Добавление лейцина в пищу с низким содержанием белка увеличивает синтез белка в скелетных мышцах и висцеральных тканях у новорожденных свиней за счет стимуляции mTOR-зависимой инициации трансляции.J Nutr. 2010; 140: 2145–52.
CAS Статья Google ученый
Manjarín R, Columbus DA, Suryawan A, Nguyen HV, Hernandez-García AD, Hoang NM, et al. Добавление лейцина к хронически ограниченному белку и энергетической диете усиливает активацию пути mTOR, но не синтез мышечного белка у новорожденных свиней. Аминокислоты. 2016; 48: 257–67.
PubMed Статья CAS Google ученый
Wilson FA, Suryawan A, Gazzaneo MC, Orellana RA, Nguyen HV, Davis TA. Стимуляция синтеза мышечного протеина длительным парентеральным введением лейцина зависит от доступности аминокислот у новорожденных свиней. J Nutr. 2010; 140: 264–70.
CAS PubMed PubMed Central Статья Google ученый
Mao X, Zeng X, Wang J, Qiao S. Лейцин способствует экспрессии лептинового рецептора в мышечных трубках C2C12 посредством пути mTOR.Mol Biol Rep. 2011; 38: 3201–6.
CAS PubMed Статья Google ученый
Mao X, Zeng X, Huang Z, Wang J, Qiao S. Лептин и лейцин синергетически регулируют метаболизм белков в миотрубках C2C12 и скелетных мышцах мышей. Br J Nutr. 2013; 110: 256–64.
CAS PubMed Статья Google ученый
Чжан С., Чу Л., Цяо С., Мао Х, Цзэн Х.Влияние диетических добавок лейцина в рационах с низким содержанием сырого протеина на продуктивность, азотный баланс, белковый обмен в организме, характеристики туши и качество мяса свиней откорма. Anim Sci J. 2016; 87: 911–20.
CAS PubMed Статья Google ученый
Madeira M, Alfaia C, Costa P, Lopes P, Lemos J, Bessa R, et al. Комбинация добавок аргинина и лейцина в рацион с пониженным содержанием сырого протеина для хряков повышает вкусовые качества свинины.J Anim Sci. 2014; 92: 2030–2040.
CAS PubMed Статья Google ученый
Wessels AG, Kluge H, Hirche F, Kiowski A, Schutkowski A, Corrent E, et al. Диеты с высоким содержанием лейцина стимулируют деградацию церебральных аминокислот с разветвленной цепью и изменяют концентрацию серотонина и кетонов в организме на модели свиньи. PLoS One. 2016; 11: e0150376.
PubMed PubMed Central Статья CAS Google ученый
Koch CE, Göddeke S, Krüger M, Tups A. Влияние центрального и периферического лейцина на энергетический метаболизм у джунгарского хомяка (Phodopus sungorus). Журнал Comp Physiol B. 2012; 183: 261–8.
PubMed Статья CAS Google ученый
Laeger T, Reed SD, Henagan TM, Fernandez DH, Taghavi M, Addington A, et al. Лейцин действует в головном мозге, подавляя потребление пищи, но не действует как физиологический сигнал о низком уровне диетического белка.Am J Physiol Regul Integr Comp Physiol. 2014; 307: R310–20.
CAS PubMed PubMed Central Статья Google ученый
Кота Д., Пру К., Смит К.А., Козма С.К., Томас Г., Вудс СК и др. Передача сигналов гипоталамуса mTOR регулирует потребление пищи. Наука. 2006; 312: 927–30.
CAS PubMed Статья Google ученый
Дардевет Д., Сорне С., Бейл Дж., Прюно Дж., Пуйе С., Гризар Дж.Постпрандиальная стимуляция синтеза мышечного белка у старых крыс может быть восстановлена приемом пищи с добавлением лейцина. J Nutr. 2002; 132: 95–100.
CAS PubMed Google ученый
Rieu I, Sornet C, Bayle G, Prugnaud J, Pouyet C, Balage M, et al. Кормление с добавлением лейцина в течение десяти дней благотворно влияет на постпрандиальный синтез мышечного белка у старых крыс. J Nutr. 2003. 133: 1198–205.
CAS PubMed Google ученый
Бассил М.С., Хвалла Н., Обейд О.А. Схема питания самцов крыс, получающих диету с добавками гистидина, лейцина или тирозина. Ожирение. 2007; 15: 616–23.
CAS PubMed Статья Google ученый
Pedrosa RG, Jr DJ, Pires IS, Tirapegui J. Добавка лейцина увеличивает концентрацию инсулиноподобного фактора роста 1 в сыворотке крови и соотношение белок / РНК в печени у крыс после периода восстановления питания. Appl Physiol Nutr Metab.2013; 38: 694–7.
CAS PubMed Статья Google ученый
Gloaguen M, Le FHN, Corrent E, Primot Y, Van MJ. Обеспечение диеты с дефицитом валина, но с избытком лейцина приводит к быстрому снижению потребления корма и изменению постпрандиальных концентраций аминокислот и α-кетокислоты в плазме у свиней. J Anim Sci. 2012; 90: 3135–42.
CAS PubMed Статья Google ученый
Zhang S, Qiao S, Ren M, Zeng X, Ma X, Wu Z, et al. Добавление аминокислот с разветвленной цепью к диете с низким содержанием белка регулирует экспрессию в кишечнике переносчиков аминокислот и пептидов у поросят-отъемышей. Аминокислоты. 2013; 45: 1191–205.
CAS PubMed Статья Google ученый
Энтони Т.Г., Гитцен Д.В. Обнаружение аминокислотной депривации в центральной нервной системе. Curr Opin Clin Nutr Metab Care.2013; 16: 96–101.
CAS PubMed Google ученый
DeSantiago S, Torres N, Suryawan A, Tovar AR, Hutson SM. Регулирование метаболизма аминокислот с разветвленной цепью у кормящих крыс. J Nutr. 1998; 128: 1165–71.
CAS PubMed Google ученый
DeSantiago S, Torres N, Tovar AR. Катаболизм лейцина в ткани молочной железы, печени и скелетных мышцах матери крыс во время лактации и отлучения от груди.Arch Med Res. 1997. 29: 25–32.
Google ученый
Мацумото Т., Накамура Е., Накамура Н., Хирота М., Сан-Габриэль А., Накамура К.-и и др. Производство свободного глутамата в молоке требует транспортера лейцина LAT1. Am J Physiol Cell Physiol. 2013; 305: C623–31.
CAS PubMed Статья Google ученый
DeSantiago S, Torres N, Hutson S, Tovar AR.Индукция экспрессии аминотрансферазы с разветвленной цепью и дегидрогеназы альфа-кетокислоты в тканях крыс во время лактации. Adv Exp Med Biol. 2001; 501: 93–9.
CAS PubMed Статья Google ученый
Lei J, Feng D, Zhang Y, Dahanayaka S, Li X, Yao K и др. Гормональная регуляция катаболизма лейцина в эпителиальных клетках молочной железы. Аминокислоты. 2013; 45: 531–41.
CAS PubMed Статья Google ученый
Dunshea FR, Bauman DE, Nugent EA, Kerton DJ, King RH, McCauley I. Гиперинсулинемия, дополнительный белок и аминокислоты с разветвленной цепью в сочетании могут увеличить выход молочного белка у кормящих свиноматок. Br J Nutr. 2005; 93: 325–32.
CAS PubMed Статья Google ученый
Доелман Дж., Кертис Р.В., Карсон М., Ким Дж. Дж. М., Кант Дж. П., Меткалф Дж. А.. Синтез молочного белка регулируется дефицитом лизина и аминокислот с разветвленной цепью в молочных железах кормящих коров.J Dairy Sci. 2014; 97 (Е-Дополнение 1): 205.
Google ученый
Strathe AV, Bruun TS, Zerrahn JE, Tauson AH, Hansen CF. Влияние увеличения соотношения валина и лизина в рационе на метаболизм свиноматок, молочную продуктивность и рост помета. J Anim Sci. 2016; 94: 155–64.
CAS PubMed Статья Google ученый
Доэльман Дж., Ким Дж. Дж., Карсон М., Меткалф Дж. А., Кант Дж.Дефицит аминокислот с разветвленной цепью и лизина по-разному влияет на регуляцию трансляции в молочных железах. J Dairy Sci. 2015; 98: 7846–55.
CAS PubMed Статья Google ученый
Moser S, Tokach M, Dritz S, Goodband R, Nelssen J, Loughmiller J. Влияние аминокислот с разветвленной цепью на продуктивность свиноматки и подстилки. J Anim Sci. 2000. 78: 658–67.
CAS PubMed Статья Google ученый
Лей Дж, Фэн Д., Чжан И, Чжао Ф.К., Ву З, Сан Габриэль А. и др. Пищевая и регулирующая роль аминокислот с разветвленной цепью в период лактации. Передние биоски. 2012; 17: 725–2.
Артикул CAS Google ученый
Appuhamy JRN, Knoebel NA, Nayananjalie WD, Escobar J, Hanigan MD. Изолейцин и лейцин независимо регулируют передачу сигналов mTOR и синтез белка в MAC-T-клетках и срезах ткани молочной железы крупного рогатого скота. J Nutr. 2012; 142: 484–91.
CAS PubMed Статья Google ученый
Резаи Р. Кормовые и регулирующие роли аминокислот с разветвленной цепью в производстве молока кормящими свиноматками. 2015. Техасский университет A&M. Доступно в электронном виде по адресу http://oaktrust.library.tamu.edu/handle/1969.1/154999. По состоянию на 26 января 2015 г.
Десаи М., Гейл Д., Бабу Дж., Росс М.Г. Постоянное снижение роста органов сердца и почек у потомков недоедающих самок крыс.Am J Obstet Gynecol. 2005; 193: 1224–32.
PubMed Статья Google ученый
Mogami H, Yura S, Itoh H, Kawamura M, Fujii T, Suzuki A, et al. Изокалорийная диета с высоким содержанием белка, а также диета с добавлением аминокислот с разветвленной цепью частично смягчает неблагоприятные последствия недостаточного питания матери для роста плода. Гормона роста IGF Res. 2009. 19: 478–85.
CAS PubMed Статья Google ученый
Линч CJ, Fox HL, Vary TC, Джефферсон LS, Kimball SR. Регуляция передачи сигналов TOR, чувствительной к аминокислотам, аналогами лейцина в адипоцитах. J Cell Biochem. 2000; 77: 234–51.
CAS PubMed Статья Google ученый
Маватари К., Кацумата Т., Уэмацу М., Кацумата Т., Йошида Дж., Смрига М. и др. Длительное пероральное лечение незаменимой аминокислотой L-лейцином не влияет на репродуктивную функцию самок и развитие эмбриона и плода у крыс.Food Chem Toxicol. 2004; 42: 1505–11.
CAS PubMed Статья Google ученый
Веретено A. Улучшенная питательная среда для бластоцист мыши. In vitro. 1980; 16: 669–74.
CAS PubMed Статья Google ученый
Martin PM, Sutherland AE. Экзогенные аминокислоты регулируют дифференцировку трофэктодермы в бластоцисте мыши посредством mTOR-зависимого пути.Dev Biol. 2001; 240: 182–93.
CAS PubMed Статья Google ученый
Ганглофф Ю.Г., Мюллер М., Данн С.Г., Свобода П., Наклейка М, Спец Дж.Ф. и др. Нарушение гена mTOR мыши приводит к ранней постимплантационной летальности и препятствует развитию эмбриональных стволовых клеток. Mol Cell Biol. 2004; 24: 9508–16.
CAS PubMed PubMed Central Статья Google ученый
Гертин Д.А., Стивенс Д.М., Торин С.К., Бердс А.А., Калаани, штат Нью-Йорк, Моффат Дж. И др. Удаление у мышей компонентов mTORC raptor, rictor или mLST8 показывает, что mTORC2 необходим для передачи сигналов Akt-FOXO и PKCα, но не S6K1. Dev Cell. 2006; 11: 859–71.
CAS PubMed Статья Google ученый
Гонсалес И.М., Мартин П.М., Бурдсал С., Слоан Дж. Л., Магер С., Харрис Т. и др. Лейцин и аргинин регулируют подвижность трофобластов через mTOR-зависимые и независимые пути в доимплантационном эмбрионе мыши.Dev Biol. 2012; 361: 286–300.
PubMed Статья CAS Google ученый
Ван Винкль LJ. Регуляция транспорта аминокислот и раннее развитие эмбриона. Биол Репрод. 2001; 64: 1–12.
PubMed Статья Google ученый
Chen L, Yin YL, Jobgen WS, Jobgen SC, Knabe DA, Hu WX и др. In vitro окисление незаменимых аминокислот клетками слизистой оболочки тощей кишки растущих свиней.Livest Sci. 2007; 109: 19–23.
Артикул Google ученый
Chen L, Li P, Wang J, Li X, Gao H, Yin Y, et al. Катаболизм незаменимых в питании аминокислот в развивающихся энтероцитах свиней. Аминокислоты. 2009; 37: 143–52.
CAS PubMed Статья Google ученый
Sun Y, Wu Z, Li W, Zhang C, Sun K, Ji Y, et al. Добавка L-лейцина в рацион способствует развитию кишечника у поросят-сосунов.Аминокислоты. 2015; 47: 1517–25.
CAS PubMed Статья Google ученый
Zhang S, Ren M, Zeng X, He P, Ma X, Qiao S. Лейцин стимулирует экспрессию транспортера аминокислот ASCT2 в эпителиальных клетках свиной кишки (IPEC-J2) через PI3K / Akt / mTOR и ERK сигнальные пути. Аминокислоты. 2014; 46: 2633–42.
CAS PubMed Статья Google ученый
Чанг И, Цай Х, Лю Дж, Чанг В., Чжэн А., Чжан С. и др. Влияние диетических добавок лейцина на экспрессию генов млекопитающих-мишеней сигнального пути рапамицина и развитие кишечника бройлеров. Питание животных. 2015; 1: 313–9.
Артикул Google ученый
Мао X, Лю М., Тан Дж, Чен Х, Чен Д., Ю Б и др. Добавка лейцина к пище улучшает выработку муцина в слизистой оболочке тощей кишки свиней-отъемышей, зараженных ротавирусом свиней.PLoS One. 2015; 10: e0137380.
PubMed PubMed Central Статья CAS Google ученый
Jiang WD, Deng YP, Liu Y, Qu B, Jiang J, Kuang SY, et al. Пищевой лейцин регулирует иммунный статус кишечника, иммунные сигнальные молекулы и количество транскриптов плотных контактов у белого амура (Ctenopharyngodon idella). Аквакультура. 2015; 444: 134–42.
CAS Статья Google ученый
Dai ZL, Zhang J, Wu G, Zhu WY. Утилизация аминокислот бактериями тонкого кишечника свиньи. Аминокислоты. 2010; 39: 1201–15.
CAS PubMed Статья Google ученый
Накамура И. Нарушение врожденного иммунного ответа у пациентов с циррозом и лечение аминокислотами с разветвленной цепью. Мир J Gastroenterol. 2014; 20: 7298.
PubMed PubMed Central Статья CAS Google ученый
Zhang W, Feng F, Wang WZ, Li MB, Ji G, Guan C. Влияние раствора аминокислот, обогащенного BCAA, на иммунную функцию и метаболизм белков у послеоперационных пациентов с раком прямой кишки. Парентеральное и энтеральное питание. 2007; 2: 009.
Google ученый
Кефхарт В.С., Вакс Т.Д., Мак Томпсон Р., Мобли С.Б., Фокс С.Д., Макдональд Дж. Р. и др. Десять недель приема аминокислот с разветвленной цепью улучшают отдельные показатели производительности и иммунологические показатели у тренированных велосипедистов.Аминокислоты. 2016; 48: 779–89.
Ren M, Zhang S, Zeng X, Liu H, Qiao S. Аминокислоты с разветвленной цепью полезны для поддержания показателей роста и иммунной функции кишечника у поросят-отъемышей, получавших диету с ограничением белка. Азиатско-Австралийский J Anim Sci. 2015; 28: 1742.
CAS PubMed PubMed Central Статья Google ученый
Xiao W, Chen P, Liu X, Zhao L. Нарушение функции макрофагов, вызванное интенсивными упражнениями, не может быть улучшено добавлением BCAA.Питательные вещества. 2015; 7: 8645–56.
CAS PubMed PubMed Central Статья Google ученый
Mao X, Qi S, Yu B, He J, Yu J, Chen D. Zn 2+ и l-изолейцин индуцируют экспрессию свиных β-дефензинов в клетках IPEC-J2. Mol Biol Rep. 2013; 40: 1547–52.
CAS PubMed Статья Google ученый
Rivas-Santiago C, Rivas-Santiago B, León D, Castañeda-Delgado J, Hernández PR.Индукция β-эфензинов с помощью l-изолейцина как новая иммунотерапия экспериментального туберкулеза мышей. Clin Exp Immunol. 2011; 164: 80–9.
CAS PubMed PubMed Central Статья Google ученый
Ёкоу К., Тошифуми А., Юхей И., Такахиро И., Хироки Т., Ацуо М. и др. Изолейцин, незаменимая аминокислота, индуцирует экспрессию человеческого β-дефенсина 2 через активацию пути ERK, связанного с G-белком, в эпителии кишечника.Food Nutr Sci. 2012. DOI: 10.4236 / fns.2012.34077.
Google ученый
Zhao J, Feng L, Liu Y, Jiang W, Wu P, Jiang J, et al. Влияние диетического изолейцина на иммунитет, антиоксидантный статус, плотные контакты и микрофлору в кишечнике молоди карпа Цзянь (Cyprinus carpio var. Jian). Fish Shellfish Immunol. 2014; 41: 663–73.
CAS PubMed Статья Google ученый
Rahimnejad S, Lee KJ. Диетический изолейцин влияет на неспецифический иммунный ответ у молоди оливковой камбалы (Paralichthys olivaceus). Турок J Fish Aquat Sci. 2014; 14: 853–62.
Артикул Google ученый
Zhao J, Liu Y, Jiang J, Wu P, Jiang W, Li S, et al. Влияние диетического изолейцина на иммунный ответ, антиоксидантный статус и экспрессию генов в головной почке молоди карпа Цзянь (Cyprinus carpio var. Jian).Fish Shellfish Immunol. 2013; 35: 572–80.
CAS PubMed Статья Google ученый
Пауэлл Д.Д., Поллицци К.Н., Хейкамп Э.Б., Хортон М.Р. Регуляция иммунных ответов с помощью mTOR. Анну Рев Иммунол. 2012; 30:39.
CAS PubMed Статья Google ученый
Солиман Г.А. Роль механистической мишени передачи сигналов комплексов рапамицина (mTOR) в иммунных ответах.Питательные вещества. 2013; 5: 2231–57.
CAS PubMed PubMed Central Статья Google ученый
Uyangaa E, Lee HK, Eo SK. Глютамин и лейцин обеспечивают повышенный защитный иммунитет против инфекции слизистых оболочек вирусом простого герпеса типа 1. Иммунная сеть. 2012; 12: 196–206.
PubMed PubMed Central Статья Google ученый
Какадзу Э, Канно Н., Уэно Й, Симосегава Т.Внеклеточные аминокислоты с разветвленной цепью, особенно валин, регулируют созревание и функцию дендритных клеток, происходящих из моноцитов. J Immunol. 2007. 179: 7137–46.
CAS PubMed Статья Google ученый
Луо Дж. Б., Фэн Л., Цзян В. Д., Лю И, Ву П, Цзян Дж. И др. Нарушение иммунной системы слизистой оболочки кишечника из-за дефицита валина у молодого белого амура (Ctenopharyngodon idella) связано со снижением иммунного статуса и регулированием количества транскриптов белков плотных контактов в кишечнике.Fish Shellfish Immunol. 2014; 40: 197–207.
CAS PubMed Статья Google ученый
Thornton SA, Corzo A, Pharr G, Dozier Iii W, Miles D, Kidd M. Потребность в валине для иммунной реакции и реакции роста у бройлеров в возрасте от 3 до 6 недель. Br Poult Sci. 2006; 47: 190–9.
CAS PubMed Статья Google ученый
Field AE, Coakley EH, Must A, Spadano JL, Laird N, Dietz WH, et al.Влияние избыточного веса на риск развития общих хронических заболеваний в течение 10 лет. Arch Intern Med. 2001; 161: 1581–6.
CAS PubMed Статья Google ученый
McCormack SE, Shaham O, McCarthy MA, Deik AA, Wang TJ, Gerszten RE, et al. Концентрации циркулирующих аминокислот с разветвленной цепью связаны с ожирением и будущей инсулинорезистентностью у детей и подростков. Pediatr Obes. 2013; 8: 52–61.
CAS PubMed Статья Google ученый
Wang TJ, Larson MG, Vasan RS, Cheng S, Rhee EP, McCabe E, et al. Профили метаболитов и риск развития диабета. Nat Med. 2011; 17: 448–53.
PubMed PubMed Central Статья CAS Google ученый
Allam-Ndoul B, Guénard F, Garneau V, Barbier O, Pérusse L., Vohl MC. Связь между уровнями аминокислот с разветвленной цепью, ожирением и кардиометаболическими осложнениями.Интегральный диабет с ожирением. 2015. DOI: 10.15761 / IOD.1000134.
Pietiläinen KH, Naukkarinen J, Rissanen A, Saharinen J, Ellonen P, Keränen H, et al. Глобальные профили транскрипции жира у монозиготных близнецов, не согласующиеся с ИМТ: пути, лежащие в основе приобретенного ожирения. PLoS Med. 2008; 5: e51.
PubMed PubMed Central Статья CAS Google ученый
Ше П., Ван Хорн С., Рид Т., Хатсон С.М., Куни Р.Н., Линч С.Дж.Повышение уровня лейцина в плазме, связанное с ожирением, связано с изменениями ферментов, участвующих в метаболизме аминокислот с разветвленной цепью. Am J Physiol Endocrinol Metab. 2007; 293: E1552–63.
CAS PubMed PubMed Central Статья Google ученый
Connor SC, Hansen MK, Corner A, Smith RF, Ryan TE. Интеграция данных метаболомики и транскриптомики для помощи в обнаружении биомаркеров диабета 2 типа. Мол Биосист.2010; 6: 909–21.
CAS PubMed Статья Google ученый
Кивеля Р., Сильвеннойнен М., Лехти М., Риннанкоски-Туйкка Р., Пурхонен Т., Кетола Т. и др. Центроиды экспрессии генов, которые связаны с низкой способностью к аэробным нагрузкам и комплексным риском заболеваний. FASEB J. 2010; 24: 4565–74.
PubMed Статья CAS Google ученый
Райан К.К., Сили Р.Дж.Еда как гормон. Наука. 2013; 339: 918.
CAS PubMed PubMed Central Статья Google ученый
Каммингс Д.Э., Овердуин Дж. Желудочно-кишечная регуляция приема пищи. J Clin Invest. 2007; 117: 13–23.
CAS PubMed PubMed Central Статья Google ученый
Бреннан С.К., Дэвис Т.С., Шепельманн М., Риккарди Д. Новые роли внеклеточного кальциевого рецептора в восприятии питательных веществ: контроль модуляции вкуса и секреции кишечных гормонов.Br J Nutr. 2014; 111: S16–22.
CAS PubMed Статья Google ученый
Розенгурт Э., Стернини С. Передача сигналов рецептора вкуса в кишечнике млекопитающих. Curr Opin Pharmacol. 2007. 7: 557–62.
CAS PubMed PubMed Central Статья Google ученый
Урок 3: Лейцин в вашем белке — что это такое и почему это важно?
Я уверен, что многие из вас слышали об аминокислотах с разветвленной цепью, или сокращенно BCAA.Это аминокислоты, которые люди употребляют во время тренировок, чтобы улучшить восстановление и нарастить мышцы. Лейцин является основным BCAA ; именно он отвечает за все эффекты наращивания мышц.
Уникальность лейцина заключается в том, что он не только является «строительным блоком» мышц, как это обычно бывает с большинством аминокислот. Скорее, лейцин в большей степени сигнализирует организму о необходимости создания нового мышечного белка. Это анаболический триггер , если хотите. Но исследования показывают, что для того, чтобы активировать этот триггер для наращивания мышечной массы, вам нужно достичь порогового уровня лейцина, примерно 3-5 граммов в зависимости от вашего веса.
Почему все это имеет значение? Я имею в виду, что пью протеиновые коктейли и потребляю много белка из цельных продуктов. Действительно ли большее количество лейцина имеет такое значение?
Ответ — да. Исследования на людях показывают, что даже в присутствии пищи с высоким содержанием белка добавление лейцина еще больше увеличивает синтез белка [1]. Поскольку синтез белка — это то, что создает новую мышечную ткань, само собой разумеется, что оптимизация количества лейцина в приеме пищи, даже если в нем много белка, может еще больше ускорить набор мышц. Фактически, недавние исследования показывают, что главный фактор в определении того, насколько хорошо белок наращивает мышцы, — это количество лейцина, которое содержит белок [2].
Итак, 100% сывороточные протеиновые продукты состоят примерно на 10% из лейцина по содержанию протеина, что означает, что ваша средняя 20-25 г мерная ложка протеина содержит только 2-2,5 г лейцина, что недостаточно для достижения порогового значения для активации анаболического триггера. Перевод: высока вероятность, что ваш протеиновый порошок сокращает вас в лейциновом отделе, особенно если дешевые формы протеина используются для «увеличения» общего количества протеина. Решение? Добавьте в свой рацион лейцин. В Select Protein вы найдете добавленные пептиды лейцина PepForm ™ , которые являются одной из форм лейцина, которую мы очень любим.