Syntrax Matrix 2.0 — Протеины
Matrix 2.0 это протеин который имеет не только прекрасный вкус, но и усиливает способности организма к восстановлению, росту мышечных тканей и способствует улучшению анаболических процессов всего организма. Качество смеси действительно находится на высшем уровне и позволяет добиваться ошеломляющих результатов тысячам спортсменам, это один из самых популярных протеинов на рынке спортивного питания и самый верный путь для набора сухой мышечной массы,которая останется с Вами надолго.
— Один из лучших протеинов продолжительного действия.
-23г белка в каждой порции из сывороточного протеина, мицеллярного казеина и яичного альбумина
-Жизненно важные питательные вещества для поддержания здоровья и восстановления мышц
-Гарантированно превосходный вкус – один из лучших на сегодняшний день
-Устойчивые по усвояемости глютаминовые пептиды
Вкусы, разработанные компанией Syntrax действительно восхитительны, Благодаря тому, что сыворотку комплексного протеина Matrix подвергли специальной обработке для быстрого приготовления, теперь порция порошка мгновенно растворяется в вашем любимом напитке .
Состав на порцию (31 г):
Калории – 120, в т. ч. Калории от жиров – 15
Всего жиров – 2 г, в т. ч. Насыщенные жиры – 1 г
Холестерин – 40 мг
Натрий – 150 мг
Калий – 270 мг
Всего углеводов – 3 г
Протеин – 23 г
Ингредиенты: Протеиновая смесь Matrix (ультрафильтрованный и неденатурированный концентрат сывороточного протеина, ультрафильтрованный и неденатурированный концентрат молочного протеина (включает в себя казеин), неденатурированный яичный белок, гидролизованная пшеничная клейковина (источник глютаминовых пептидов)), натуральные и искусственные ароматизаторы, лецитин, хлорид натрия, аспартам, ацесульфам калия.
Рекомендации по применению: Смешать 1-2 мерные ложки Matrix 2.0 в 230-450 мл воды, обезжиренного молока, либо другого напитка на ваш выбор. Для максимального эффекта Matrix 2. 0 следует принимать 3 раза в день. Первую порцию утром сразу после пробуждения, вторую – после тренировки и третью – перед сном.
0 следует принимать 3 раза в день. Первую порцию утром сразу после пробуждения, вторую – после тренировки и третью – перед сном.
Протеин Matrix от Syntrax (1.0; 2.0; 5.0) – базовый многокомпонентник. Мой многолетний опыт использования и почему я стал меньше доверять этому протеину.
Моя оценка: 3 из 5
У многих, да и у меня поначалу, вызывала недоумение эта фишка с цифрами после названия: Matrix 1.0; Matrix 2.0; Matrix 5.0 – в чём разница? Если кто ещё не разобрался: это не что иное, как размер упаковки в фунтах (lb), один lb – около 454 грамм. Соответственно: 1.0 – 454 грамма; 2.0 – 908 грамм; 5.0 – 2270 грамм (пакет).
Весьма странное решение производителя – в названии продукта указывать вес упаковки (когда много лет назад только искал информацию по этому протеину, меня эти цифры немало смущали).
Состав, описание
Классический многокомпонентный протеин, которого я съел больше чем любого другого и который не имел себе равных по соотношению состав-цена-качество (как я думал много лет подряд).
Описание производителя и состав в моём свободном переводе:
ПРОБЛЕМА: Протеиновые порошки низкого качества, содержат провоцирующий отложение жира мальтодекстрин, ужасны на вкус, требуют для смешивания блендер и содержат только один быстродействующий протеин. Несомненно, что большинство таких продуктов стоят дёшево, но кто захочет давиться чем-то день за днём, что неудобно и неполезно?Итак, в описании производителя присутствует немного рекламной дребедени: в частности насчёт мальтодекстрина в составе «протеиновых порошков низкого качества» – именно протеиновые порошки (от 60% протеина и выше), если и содержат в составе мальтодекстрин (добавляемый как эмульгатор, например), то буквально грамм один на порцию, что никак не может привести к отложению жира; насчёт «одного быстродействующего протеина» в составе – сывороточный, надо полагать, имеется в виду – опять же не вполне корректный «гон» на сывороточный протеин, который очень быстро усваивается и во многих случаях это плюс; а насчёт вкусовых качеств и смешиваемости ложкой – бла, бла, бла.
РЕШЕНИЕ: Протеиновый порошок Матрикс. После лет потраченных на создание его формулы, Матрикс решает все проблемы присущие в настоящее время протеиновым порошкам низкого качества. Главное, мы полностью отказались от таких низкокачественных протеиновых источников, как денатурированные натрия и кальция казеинаты.Мы знали, чтобы быть лучшими мы должны использовать только высококачественные протеиновые источники, такие как ультрафильтрованный сывороточный протеин, ультрафильтрованный молочный протеин, чистый яичный альбумин и глютаминовые пептиды. Расходы гораздо выше, но результат того стоит: эти протеины не только очень вкусные, но и не имеют себе равных по способности улучшать здоровье и стимулировать анаболические процессы в организме.
Сделав продукт наивысшего качества, мы знали, что должны сделать ещё больше. Мы решили не соглашаться на меньшее, чем лучший на вкус протеиновый порошок на рынке. После бесчисленных проб, мы остановились на нескольких восхитительных вкусах, вызывающих экстаз при употреблении.Полностью решая все проблемы, матрикс в завершение демонстрирует, что каждый мерные совок полностью растворяется в вашем любимом напитке. Никаких отвратительных комков или грязных блендеров на вашей кухне. С матриксом вам нужна лишь ложка!
РЕКОМЕНДАЦИИ ПО ПРИМЕНЕНИЮ: Смешайте 1 мерную ложку матрикса с 8 унциями (моё примечание: 240 мл) воды или молока.При меньшей потребности в протеине, можно смешать половину мерной ложки с 4 унциями (моё примечание: 120 мл) воды или молока. Обратите внимание на дополнительные калории, когда смешиваете с молоком. Употребляйте матрикс два-три раза в день для удовлетворения вашей потребности в протеине. Запомните, лучшее время для употребления протеина: сразу после пробуждения утром; после интенсивной физической активности, такой как силовая тренировка; и перед сном. Матрикс отлично смешивается ложкой и имеет прекрасный вкус…гарантированно!
Размер порции: 1 мерная ложка (32 г)
Килокалорий – 120
килокалорий из жиров – 20
Всего жиров – 2 г
насыщенные жиры – 1 г
Холестерин – 40 мг
Натрий – 130 мг
Калий – 280 мг
Всего углеводов – 3 г
клетчатка – 1 г
сахар – 2 г
Протеин – 23 г
Ингредиенты: смесь протеинов молочного происхождения (концентрат сывороточного белка, концентрат молочного белка), смесь протеинов немолочного происхождения (гидролизованный пшеничный глютен, яичный альбумин), какао-порошок, натуральные и искусственные ароматизаторы, соль, соевый лецитин, ацесульфам-К, сукралоза.

Аминокислотный профиль на банке указан как-то странно – только 11 незаменимых и условно незаменимых аминокислот, а не все 20, как это обычно указывается в аминокислотном профиле протеинов. Почему бы не указать все? Ну да ладно, хоть как-то выделиться что-ли захотели (туда же и указание веса упаковки в названии протеина – только ввергали в сомнения этими своими 1.0, 2.0, 5.0).
Вкус, растворимость, усвояемость, опыт использования
Встречал много положительных отзывов о вкусовых качествах этого протеина, чего я лично не заметил за несколько лет постоянного употребления, что лишний раз доказывает – у каждого своё восприятие вкуса. На мой вкус, так этот протеин имеет слабый, но отчётливый специфический привкус, не самый приятный надо сказать. Охарактеризовать этот привкус я затрудняюсь, часто читал в отзывах о неком «химическом» привкусе протеинов, но ни разу не сталкивался с подобным привкусом и не вполне понимаю, что под ним подразумевается.
Смешиваемость (в шейкере) на молоке комнатной температуры – без проблем, на холодном молоке – могут быть комочки, пенообразование – среднее. А если смешиваю с кефиром, шейкером вообще не пользуюсь – насыпаю в кружку и постепенно понемногу доливая кефир, помешиваю ложкой. Проблем с животом – никаких, усваивается у меня всегда хорошо, независимо от того с чем смешивать.
Проблем с животом – никаких, усваивается у меня всегда хорошо, независимо от того с чем смешивать.
Не знаю как, но несколько лет назад был период, когда я умудрялся набирать мышечную массу и силу на одном только этом протеине, потребляя его по три порции в день с молоком (между основными приёмами пищи и на ночь). Не знаю как – потому, что белок белком, но важны и калории в целом. Наверное это связано с тем, что тогда я весил поменьше, а ел побольше (завтрак, обед и ужин), да и большое кол-во белка в сутки (69 г только из белкового порошка) + литр молока, в котором я разводил этот протеин (30 г порошка в 330 мл молока на порцию), в целом давало достаточно калорий.
Сейчас и уже довольно давно я постоянно употребляю гейнер (чем больше вес, тем больше нужно калорий), а этот протеин в основном на ночь – в этом плане матрикс для меня почти незаменим (был до недавнего времени, о чём ниже).То, что я не люблю в продуктах спортивного питания, продающихся в пластиковых банках, это когда отсутствует плёночная защита крышки от вскрытия. Матрикс – именно такой случай. Т.е. крышка свободно откручивается, а под ней защитная мембрана непосредственно закрывающая горловину банки.
Матрикс – именно такой случай. Т.е. крышка свободно откручивается, а под ней защитная мембрана непосредственно закрывающая горловину банки.
Но ведь эта мембрана может быть и плохо приклеена (сфотографировал эту ситуацию в отзыве на гейнер Muscle Jujce Revolution), и вот здесь не лишней оказалась бы плёнка на крышке. Лично у меня за всё время употребления данного протеина была пара таких случаев – откручиваешь крышку, а мембрана местами отходит. Бывает крышка наполовину откручивается в процессе транспортировки от производителя до полки магазина, а под такой неплотно закрученной крышкой плохо приклеенная мембрана – налицо нарушение герметичности. Не думаю, что это фатально для протеинового порошка, но и явно не полезно.
Почему я сейчас сомневаюсь в качестве и заявленном составе этого протеина
Уже в новой синей банке покупал матрикс пару раз, со вкусом «perfect chocolate» – так как не было моего любимого «milk chocolate». Перфект шоколад мне изначально нравился гораздо меньше милк шоколада, но выбора не было. Однако мне он показался несколько отличным от того, что было раньше – порошок несколько более рыхлый и привкус как будто растительный что-ли (такая ассоциация у меня возникла). Но в принципе всё нормально – протеиновые порошки и их вкусы разные бывают, и мне он показался странноватым именно в сравнении с тем что был раньше.
Однако мне он показался несколько отличным от того, что было раньше – порошок несколько более рыхлый и привкус как будто растительный что-ли (такая ассоциация у меня возникла). Но в принципе всё нормально – протеиновые порошки и их вкусы разные бывают, и мне он показался странноватым именно в сравнении с тем что был раньше.
Ну вот, и на волне своего недавнего интереса к варке протеинов, дёрнуло меня его сварить – раз преобладающий белок там, по заверениям производителя, сывороточный концентрат (о чём писал в отзыве на Trophix), он должен свернуться в кипятке (к тому же видел на ютубе, как варили матрикс, когда он был ещё в старой белой банке, и он отлично сворачивался). Так вот, результат моей варки – лёгкий шок. Порошок полностью растворился в кипящей воде, получилось какао без единого комочка, как в худшем кошмаре – как будто я купил какую-то хрень за 300 р. килограмм, а не протеин очень известной фирмы торгующей своей продукцией по всему миру. В общем, я варил его минут пять – на что-то надеясь, так как не мог поверить своим глазам, но единственное чего добился этим – выпал осадок в виде мелких хлопьев.
 Я был бы вполне удовлетворён таким результатом, будь это Trophix этой же фирмы – там то преобладающий белок казеин….
Я был бы вполне удовлетворён таким результатом, будь это Trophix этой же фирмы – там то преобладающий белок казеин…. В общем, я не знаю, что думать – матрикс состоит из негидролизованного сывороточного белка, казеина, гидролизованного пшеничного белка, и яичного. Как минимум сывороточный (которого там по заверениям производителя больше всего) и яичный должны сворачиваться в более-менее выраженные сгустки и комки, да что там комки – я бы и комочкам был рад. Гидролизат пшеничного глютена и казеин могут не свернуться, а казеин, при длительной варке, может выпасть в осадок хлопьями. Результат варки – как будто там один казеин и гидролизованный пшеничный белок, что, как уже сказал, я мог бы воспринять как норму, если бы это был тропхикс.
Как это всё трактовать не знаю – перепутали на производстве и насыпали в банки от матрикса более дешёвый тропхикс, намеренно или случайно (в принципе, на пищевом производстве такое может быть), или действительно есть какой-то «термостойкий сывороточный белок», который не сворачивается при варке и в существовании которого я сомневаюсь…. Или же то, о чём я писал в заметке о способах проверки протеина – в многокомпонентной смеси, белки, не подверженные выраженной коагуляции при варке, могут препятствовать нормальному сворачиванию белков, которые должны образовывать выраженные комки и сгустки. Я бы так и подумал, если бы не то видео на ютубе, где матрикс сворачивался не хуже чистого сывороточного протеина (может видео было фейком, но зачем и кому это могло быть нужно?).
Или же то, о чём я писал в заметке о способах проверки протеина – в многокомпонентной смеси, белки, не подверженные выраженной коагуляции при варке, могут препятствовать нормальному сворачиванию белков, которые должны образовывать выраженные комки и сгустки. Я бы так и подумал, если бы не то видео на ютубе, где матрикс сворачивался не хуже чистого сывороточного протеина (может видео было фейком, но зачем и кому это могло быть нужно?).
Конечно, я не выбросил начатую банку после этого теста – если даже состав не соответствует заявленному, то всё же белок там, надеюсь, присутствует, и при том, что проблем с усвоением этого порошка у меня не возникло, никаких причин выбрасывать банку, соответственно, тоже не было. Но после этого покупать матрикс снова, желания у меня сильно поубавилось.
Сама проверка протеина варкой не является настолько надёжной, чтобы делать однозначные выводы о несоответствии заявленного состава реальному, только на основании такого ненадёжного теста. Но «осадочек», как говорится, остался. Довольно большая проблема на самом деле теперь найти замену этому протеину по заявленному составу и цене.
Довольно большая проблема на самом деле теперь найти замену этому протеину по заявленному составу и цене.
P.S. После описанного случая с варкой покупал матрикс ещё не раз – реально большая проблема найти на замену что-то похожее по цене, составу и вкусовым качествам (вкус Milk Chocolate). И варил его ещё раз – в принципе результат был похожий, но осадок выпал быстрее и был он довольно своеобразен, если рассмотреть и изучить получше, чем я сделал это в первый раз. Очень мелкие комочки слегка «резиновые» что-ли – какими и должны быть сгустки чистого сывороточного протеина при варке. Только очень мелкие и не плавают, а выпадают в осадок. Так что может и нормально всё – для многокомпонентника с сывороточным белком в составе, и зря я сомневаюсь (а упомянутое видео действительно было фейком). А может и нет – меня всегда настораживал пшеничный белок в составе матрикса, сколько его там? Однозначно только то, что протеин дешёвый, вкусный и эффективный (что подтверждает весь мой многолетний опыт его использования), даже если там и не всё идеально с составом. Так что я, конечно, буду присматриваться к альтернативным вариантам, пробовать, но и полностью отказываться от матрикса пока не буду.
Так что я, конечно, буду присматриваться к альтернативным вариантам, пробовать, но и полностью отказываться от матрикса пока не буду.
состав, плюсы и минусы рекомендации по применению
Среди комплексных протеинов высокого качества следует упомянуть о Syntrax Matrix. Его формула разработана специально для тех атлетов, которые хотят от протеиновой добавки всего и сразу, а именно: быстрого усвоения, в то же время длительного высвобождения аминокислот, а также компонентов высочайшего качества по доступной цене. Все это совмещает в себе протеин от Синтракс.
Содержание
Особенности протеина Matrix
Здесь стоит остановиться на особенностях отдельных компонентов. В составе Матрикс содержится смесь, включающая в себя сывороточный протеин, мицеллярный казеин и яичный альбумин.
- Сывороточный протеин известен своими способностями быстро насыщать мышцы аминокислотами в тот момент, когда это особенно необходимо. Скорость поступления аминокислот из сыворотки составляет примерно полчаса.
 Таким образом, это незаменимый компонент для употребления после тренировки, позволяя быстро восстанавливать мышцы и предупреждать повышение уровня кортизола, то есть предупреждать катаболизм.
Таким образом, это незаменимый компонент для употребления после тренировки, позволяя быстро восстанавливать мышцы и предупреждать повышение уровня кортизола, то есть предупреждать катаболизм. - Мицеллярный казеин состоит их мицелл, способных притягиваться и собираться в сгусток, обеспечивая длительное высвобождение аминокислот. Мицеллы казеина обеспечивают расщепление аминокислот от 8 до 12 часов. Такой компонент защищает мышцы от разрушения во время сна и после нагрузок, постоянно подпитывая мышцы строительным материалом. Именно этого часто не хватает в обычных сывороточных протеинах. Но в отличие от чистого казеина, Матрикс начинает действовать в два раза быстрее.
- Яичный альбумин – самый биодоступный и легкоусваиваемый белок, который усваивается организмом почти полностью. Как единственный компонент в протеиновых добавках будет стоить дороже, поэтому приобретать яичный протеин не очень-то выгодно. Альбумин яиц содержит широкий аминокислотный комплекс.

Какие вкусы и объемы упаковок протеина Syntrax бывают
Среди разнообразия линейки Матрикс, протеин можно встретить со вкусом:
- молочного шоколада;
- мятного печенья;
- печенье-крема;
- клубничного крема;
- шоколада;
- ванили;
- бананового крема;
- арахисового масла;
- апельсина.
В линейке встречаются упаковки объемом:
- 454 г;
- 938 г;
- 2275 г;
- 2290 г.
Состав протеина Syntrax Matrix
1 порция 30 г содержит:
- Калории – 150 ккал.
- Белки – 25 г.
- Углеводы – 1,5 г.
- Жиры – 1 г.
- ВСАА – 7 г.
Также в 100 граммах Матрикса присутствует комплекс аминокислот, состоящий из:
- Аргинина — 2,5 гр.
- Глютамина — 8,4 гр.
- Гистидина — 2,1 гр.
- Изолейцина — 5,8 гр.
- Лейцина — 10,3 гр.

- Лизина — 8,7 гр.
- Метионина — 2,2 гр.
- Фенилаланина- 3,6 гр.
- Треонина — 6,4 гр.
- Триптофана — 1,9 гр.
- Валина — 6 гр.
Плюсы протеина Матрикс
- Протеин изготовлен из сырья высокого качества, без дешевых и синтетических примесей.
- Комплекс вобрал в себя лучшие виды белка из молока, сыворотки и яиц.
- Сравнительно невысокая цена.
- Матрикс, в одно время, быстро расщепляется на аминокислоты благодаря сывороточным и яичным белкам, в другое время – долго высвобождается благодаря мицеллярному казеину.
- Содержит мало жиров и углеводов по сравнению с аналогичными комплексными протеинами. Это позволяет принимать продукт тем людям, которые следят за весом и работают на рельеф мышц.
- Несмотря на то, что это комплексный продукт, его состав приближен к изолятам многих конкурентов.
- Также содержит пептиды глютамина.
- Матрикс подвергается клиническим испытаниям.
Минусы добавки
- Наличие яичного альбумина может вызвать аллергию у лиц, чувствительных к этому компоненту.

- Продукт содержит лактозу, поэтому не рекомендуется принимать при ее непереносимости.
Кому подойдет, и для каких целей
Этот новаторский продукт подойдет и тем, кто хочет увеличить мышечную массу, и тем, кому необходимо улучшить рельеф, без потери мышечной массы.
Как принимать Matrix protein
При наборе мышечной массы:
- Принимайте протеин утром, после основного приема пищи, если есть необходимость в дополнительном источнике белка.
- За два часа до тренировки, чтобы компоненты успели частично усвоиться и не доставляли дискомфорт при нагрузках, или сразу после тренировки.
- И последнюю порцию перед сном.
1 мерный стакан порошка можно разводить водой, молоком, соком, объемом 200-250 мл, в зависимости от необходимой консистенции.
Не стоит превышать прием протеина более 3 порций в день.
При тренировках на рельеф употребляйте протеин на воде. Достаточно двух порций в день:
- до или после тренировки;
- и на ночь.

В дни отдыха можно принять протеин утром.
Аналоги Matrix
Матрикс можно сравнить с его конкурентом – комплексным протеином BSN Syntha 6. Конечно, в БСН больше источников белка, но среди них есть и яичный альбумин, и мицеллярный казеин, и сывороточный протеин. Но, несмотря на то, что в Синте присутствует изолят и концентрат сыворотки, Матрикс по составу больше похож на изолированный протеин. В одной порции Синты содержится 200 ккал, и целых 18 углеводов и 6 г жира.
Заключение
Вот такую гамму компонентов собрал Матрикс, а это не может оставить равнодушными спортсменов, которые ценят продукты спортивного питания, не содержащие дешевых примесей из растительных источников белка, например сои, которой производители любят разбавить и удешевить продукт.
Обзор протеина Matrix в видео формате
youtube.com/embed/Sv-M7oTiWCA» frameborder=»0″ allow=»accelerometer; autoplay; encrypted-media; gyroscope; picture-in-picture» allowfullscreen=»»/>А также читайте, обзор протеинов Impact Whey от MyProtein →
Калорийность Протеин Syntrax — Matrix 2.0 (Мятное печенье). Химический состав и пищевая ценность.
Химический состав и анализ пищевой ценности
Пищевая ценность и химический состав
«Протеин Syntrax — Matrix 2.0 (Мятное печенье)».В таблице приведено содержание пищевых веществ (калорийности, белков, жиров, углеводов, витаминов и минералов) на порцию съедобной части.
| Нутриент | Количество | Норма** | % от нормы в 100 г | % от нормы в 100 ккал | 100% нормы |
| Калорийность | 120 кКал | 1684 кКал | 7. 1% 1% | 5.9% | 1403 г |
| Белки | 23 г | 76 г | 30.3% | 25.3% | 330 г |
| Жиры | 2 г | 56 г | 3.6% | 3% | 2800 г |
| Углеводы | 3 г | 219 г | 1.4% | 1.2% | 7300 г |
| Макроэлементы | |||||
| Калий, K | 200 мг | 2500 мг | 8% | 6. 7% 7% | 1250 г |
| Кальций, Ca | 160 мг | 1000 мг | 16% | 13.3% | 625 г |
| Магний, Mg | 20 мг | 400 мг | 5% | 4.2% | 2000 г |
| Натрий, Na | 105 мг | 1300 мг | 8.1% | 6.8% | 1238 г |
| Фосфор, P | 140 мг | 800 мг | 17. 5% 5% | 14.6% | 571 г |
| Незаменимые аминокислоты | |||||
| Аргинин* | 2.5 г | ~ | |||
| Валин | 6 г | ~ | |||
| Гистидин* | 2.1 г | ~ | |||
| Изолейцин | 5. 8 г 8 г | ~ | |||
| Лейцин | 10.3 г | ~ | |||
| Лизин | 8.7 г | ~ | |||
| Метионин | 2.2 г | ~ | |||
| Треонин | 6. 4 г 4 г | ~ | |||
| Триптофан | 1.9 г | ~ | |||
| Фенилаланин | 3.6 г | ~ | |||
| Стеролы (стерины) | |||||
| Холестерин | 30 мг | max 300 мг | |||
| Насыщенные жирные кислоты | |||||
| Насыщеные жирные кислоты | 1 г | max 18. 7 г 7 г |
Энергетическая ценность Протеин Syntrax — Matrix 2.0 (Мятное печенье) составляет 120 кКал.
Основной источник: Создан в приложении пользователем. Подробнее.
** В данной таблице указаны средние нормы витаминов и минералов для взрослого человека. Если вы хотите узнать нормы с учетом вашего пола, возраста и других факторов, тогда воспользуйтесь приложением «Мой здоровый рацион».
Syntrax Matrix 2.0 (0,9 кг)
Syntrax Matrix 2.0 (0,9 кг)
Проблема: Обычная упаковка протеина низкого качества, который содержит мальтодекстрин, имеет ужасный вкус и плохую растворимостью. Да к тому же содержит только «быстрый» протеин. Без сомнения, большинство этих упаковок стоят дешево, но кто хочет принимать ежедневно добавку, которая так же неудобна, как и бесполезна?
Решение: Имея за плечами годы исследований, Matrix 2. 0 решает все проблемы обычных протеинов. Что самое главное, Matrix 2.0 полностью отказались от дешевого, низкосортного источника протеина, такого как денатурированный казеинат натрия и кальция. Осознавали, чтобы быть лучшими, надо использовать только неденатурированный протеин высочайшего качества, такой как ультрафильтрованный сывороточный протеин, ультрафильтрованный молочный протеин, неденатурированный яичный белок, а также глютаминовые пептиды. Эти протеины не только превосходны на вкус, но и несравненны в своей способности улучшать здоровье всего организма, как и способствовать росту тканей и процессам в организме.
0 решает все проблемы обычных протеинов. Что самое главное, Matrix 2.0 полностью отказались от дешевого, низкосортного источника протеина, такого как денатурированный казеинат натрия и кальция. Осознавали, чтобы быть лучшими, надо использовать только неденатурированный протеин высочайшего качества, такой как ультрафильтрованный сывороточный протеин, ультрафильтрованный молочный протеин, неденатурированный яичный белок, а также глютаминовые пептиды. Эти протеины не только превосходны на вкус, но и несравненны в своей способности улучшать здоровье всего организма, как и способствовать росту тканей и процессам в организме.
Лучшая протеиновая смесь это:
— Неденатурированный сывороточный протеин
— Мицеллярный казеин и яичный белок
— Анаболические и антикатаболичские протеины
— Протеин, имеющий лучший вкус!
— Глютаминовые пептиды
— Легко смешивается
Чтобы сделать обычную упаковку протеина абсолютно действенной и прекрасной, Matrix 2. 0 знали, что должны сделать нечто большее. После бесчисленных испытаний они остановились на двух вкусах: Simply Vanilla и Perfect Chocolate. И завершается решение проблем протеиновых смесей тем, что Matrix 2.0 полностью растворима, так что простой ложки будет достаточно, чтобы сделать превосходный протеиновый шейк. Больше никаких комочков, никаких блендеров… для Matrix 2.0 Вам может потребоваться только ложка!
0 знали, что должны сделать нечто большее. После бесчисленных испытаний они остановились на двух вкусах: Simply Vanilla и Perfect Chocolate. И завершается решение проблем протеиновых смесей тем, что Matrix 2.0 полностью растворима, так что простой ложки будет достаточно, чтобы сделать превосходный протеиновый шейк. Больше никаких комочков, никаких блендеров… для Matrix 2.0 Вам может потребоваться только ложка!
Количество питательных веществ в одной порции (одна мерная ложка = 30 г) продукта:
Калории – 110
Всего жиров – 1,5 г
Всего углеводов – 2 г
Протеин – 23 г
Холестерин – 40 мг
Натрий – 70 мг
Калий – 200 мг
Аминокислотный состав на 100 г протеина:
Аргинин – 2,5 г
Глютамин – 8,4 г
Гистидин – 2,1 г
Изолейцин – 5,8 г
Лейцин – 10,3 г
Лизин – 8,7 г
Метионин – 2,2 г
Фенилаланин – 3,6 г
Треонин – 6,4 г
Триптофан – 1,9 г
Валин – 6 г
Ингредиенты: протеиновая смесь (концентрат сывороточного протеина, концентрат молочного протеина, яичный белок, гидролизованная пшеничная клейковина), натуральные и искусственные ароматизаторы, лецитин, соль, ацесульфам калия, сукралоза.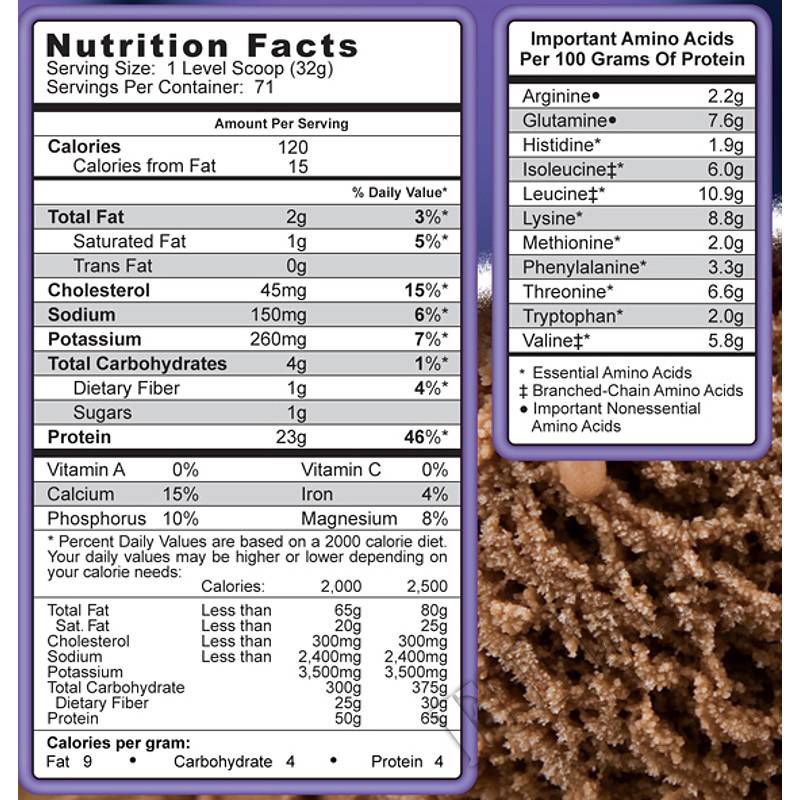
Рекомендации по применению: Добавьте одну порцию в 200–250 мл воды или молока. Принимайте 1–3 порции в день.
Порций в упаковке: 31
Протеин Matrix 2.0 Syntrax 907g 30 порций (Спортивное питание,белок,многокомпонентный,комплексный,матрикс,синтракс.)
Matrix не содержит дешевых источников белка, от которых потребители ранее испытывали дискомфорт. В состав продукта вошли сывороточный, молочный и яичный протеины, результат от приема которых не заставит себя долго ждать. Отменный вкус, высокая польза для здоровья и всех обменных процессов в организме: Matrix 2.0 просто незаменим при строительстве мышечной массы.
Аминокислотный профиль продукта включает в себя большое количество BCAA (лейцин, валин и изолейцин в правильном соотношении 2:1:1), донатор азота аргинин, глютамин, составляющий 60% мышц, лизин и метионин, помогающие сжигать жирные кислоты, а также треонин, гистидин, фенилаланин и триптофан.
В процессе применения препарата улучшается общее состояние организма, поддерживаются все жизненно-важные процессы организма, и, самое главное, растет сухая мышечная масса. В Матриксе содержатся быстрые и средние белки, которые равномерно снабжают мышцы аминокислотами во время и после тренировки, способствует ускорению восстановительных процессов тканей мышц. Благодаря яичному альбумину, входящему в состав Matrix, появляется дополнительная возможность набрать мышечную сухую массу.
В Матриксе содержатся быстрые и средние белки, которые равномерно снабжают мышцы аминокислотами во время и после тренировки, способствует ускорению восстановительных процессов тканей мышц. Благодаря яичному альбумину, входящему в состав Matrix, появляется дополнительная возможность набрать мышечную сухую массу.
При правильной диете продукт поможет не только построить мощную мускулатуру, но и сжечь лишний жир. Кроме того, в состав продукта вошла клетчатка, поддерживающая пищеварительную систему на должном уровне, поэтому все питательные вещества протеиновой добавки будет усвоены организмом полностью.
Эффективность Matrix 2.0 доказана многими спортсменами: сотни тысяч поднятых килограмм над собой – еще один плюс в копилку. Коктейль из этого продукта делается очень просто и обладает высокими вкусовыми качествами.
Все протеины, входящие в состав, легко и быстро усваиваются, процесс анаболизма запускается в считанные минуты. Matrix 2.0 от Syntrax защищает от стресса, который вы получаете в ходе напряженных тренировок. Этот продукт имеет высокую оценку атлетов, которые ценят качество, реальный эффект и конечно же, вкусовые характеристики протеина.
Этот продукт имеет высокую оценку атлетов, которые ценят качество, реальный эффект и конечно же, вкусовые характеристики протеина.
Содержание питательных веществ в порции(1 мерная ложка 30 г):
Калории – 120
Калории от жиров – 15
Всего жиров – 2 г
Насыщенные жиры – 1 г
Холестерин – 30 мг
Всего углеводов – 3 г
Протеин – 23 г
Кальций – 160 мг
Фосфор – 140 мг
Магний – 20 мг
Натрий – 105 мг
Калий – 200 мг
Аминокислотный состав на 100 г протеина:
Аргинин – 2,5 г
Глютамин – 8,4 г
Гистидин – 2,1 г
Изолейцин – 5,8 г
Лейцин – 10,3 г
Лизин – 8,7 г
Метионин – 2,2 г
Фенилаланин – 3,6 г
Треонин – 6,4 г
Триптофан – 1,9 г
Валин – 6,0 г
Ингредиенты:
Ультрафильтрованный и неденатурированный концентрат сывороточного протеина, ультрафильтрованный и неденатурированный концентрат молочного протеина (включая мицеллярный казеин), неденатурированный яичный белок, гидролизованная пшеничная клейковина (включая глютаминовые пептиды), натуральные и искусственные ароматизаторы, лецитин, хлорид натрия, аспартам, ацесульфам калия
Применение:
Добавьте одну порцию в 200–250 мл воды или молока. Принимайте 1–3 порции в день.
Принимайте 1–3 порции в день.
| Волгин Андрей оценил продукт на 10 3.01.2021 12:25 | Пользуюсь достаточно давно. Стабильное качество, без неожиданностей. Рекомендую. Работает. |
| Отзыв полезен? Да 0 / Нет 0 | |
| Жариков Сергей Алексеевич оценил продукт на 9 19.10.2020 20:19 | Шоколад и клубника зачёт,долгоиграющий и не приедается |
| Отзыв полезен? Да 0 / Нет 0 | |
| Тарасов Павел Игоревич стаж 11 лет оценил продукт на 5 8. | Все таки хуже синтры во всем, кроме цены. Бюджетность заметна <�Владислав> 27.09.2020 13:19 Что то …, что это … |
| Отзыв полезен? Да 0 / Нет 0 | |
| Александр оценил продукт на 9 2.08.2020 19:31 | Разбавлял с холодным молоком, смешивается хорошо. Молочный шоколад не приторный — мой любимый вкус. Хорошо усваивается. |
| Отзыв полезен? Да 1 / Нет 0 | |
| Анна оценил продукт на 10 25.02.2020 14:31 | Отличный продукт! Пока пробовала только «Клубнику», очень нравится вкус, легко перемешивается, консистенция жидкая, но прекрасно взбивается блендером, образуя густую пену. Сытный, никаких проблем с ЖКТ. Очень довольна покупкой, рекомендую) |
| Отзыв полезен? Да 1 / Нет 1 | |
| Паук охотник оценил продукт на 9 20. | Один из первых моих протеинов ,после Вейдера 80.По органолептическим свойствам нареканий нет ,только из за приторностм надоедает как и любой белковый порошок ))впрочем Какое было моё удивление когда я сравнил данный многокомпонентник и концентрат от SAN,по составу БЖУ они идентичны ,по а-к профилю тоже ,ну разве что глютамина в концентрате больше .Если нет разницы зачем платить больше …. Только вот вопрос где у него в составе ещё 7аминокислот ???? |
| Отзыв полезен? Да 1 / Нет 0 | |
| Зотов Алексей Анатольевич оценил продукт на 10 12.01.2020 18:27 | Отлично |
| Отзыв полезен? Да 0 / Нет 0 | |
| Зотов Алексей Анатольевич оценил продукт на 10 12.01.2020 18:26 | Отлично |
| Отзыв полезен? Да 0 / Нет 0 | |
| Рита оценил продукт на 10 31. | пробровала апельсиновый, клубничный и печенье-крем вкусы, все достойные. печенье-крем с шоколадной крошкой. саму марку протеина посоветовал тренер. |
| Отзыв полезен? Да 0 / Нет 1 | |
| Зотов Алексей Анатольевич оценил продукт на 10 19.12.2019 13:59 | Качественный товар, результат есть, порций в упаковке оказалось больше чем написано в инструкции. |
| Отзыв полезен? Да 0 / Нет 0 | |
| Расул оценил продукт на 5 24.11.2019 01:21 | Многокомпонентных протеинов на рынке на текущий момент я не нашел, пришлось выбирать из того что было. Выбор на данную марку пал по причине цена-качество и популярности, это был первый «многокомпонентный» протеин который я купил. Во первых состав этого протеина не тянет на многокомпонентный, в основном одна сыворотка, дешевая, простая и быстрая, хотя мне нужно среднее значение усвояемости. Далее идет молочный белок, который тоже состоит на 80% из сыворотки и только на 20 из казеина, далее пшеничная клейковина, он же соевый белок, что видимо не удивительно, и на последнем месте, т.е. буквально три процента яичный белок. Во вторых протеин после размешивания с молоком превращается в какую то слизь. В общем пока одни разочарования. Первый вкус, несмотря на плохие отзывы, взял мятное печенье, вкус приятный, пился хорошо, никакой химозности не заметил. Второй вкус взял арахисовое масло, выбора не было поэтому его и купил, вкус «чего и требовалось ожидать», допил с трудом, арахисовую пасту никогда не любил. Последний вкус молочный шоколад, вкус был ужасным: с одной стороны приторным, с другой каким то соленым(не понял почему), ожидал совсем другого, по крайней мере от этой марки. Работает протеин хорошо или нет сказать не могу, оценка была бы очень неточной. Матрикс больше не куплю, есть марки достойнее. Далее идет молочный белок, который тоже состоит на 80% из сыворотки и только на 20 из казеина, далее пшеничная клейковина, он же соевый белок, что видимо не удивительно, и на последнем месте, т.е. буквально три процента яичный белок. Во вторых протеин после размешивания с молоком превращается в какую то слизь. В общем пока одни разочарования. Первый вкус, несмотря на плохие отзывы, взял мятное печенье, вкус приятный, пился хорошо, никакой химозности не заметил. Второй вкус взял арахисовое масло, выбора не было поэтому его и купил, вкус «чего и требовалось ожидать», допил с трудом, арахисовую пасту никогда не любил. Последний вкус молочный шоколад, вкус был ужасным: с одной стороны приторным, с другой каким то соленым(не понял почему), ожидал совсем другого, по крайней мере от этой марки. Работает протеин хорошо или нет сказать не могу, оценка была бы очень неточной. Матрикс больше не куплю, есть марки достойнее.<�Макс> 25.11.2019 19:54 Да, и гораздо дороже при этом. <�Игорь> 5.12.2019 08:30 Покупал в США в интернет-магазине — цена 53$ (не понятно, почему в Москве стоит дешевле). Вкус — шоколад. Отлично размешивается, не пенится. <�Хммм> 18.02.2020 01:33 О, полезный отзыв. У самого в шкафу стоит недопитый молочный шоколад. Короче рассказываю правду — все протеины невкусные, потому что откуда там взяться вкусу, жиров и углей по минимуму. Так что если нашли реально вкусный прот — то там видимо перебор с углями. Вкусных не бывает короче. Есть ужасные по вкусу и терпимые. А хотите вкусного — пейте гейнер с молоком, но это уже совсем другая история. |
| Отзыв полезен? Да 2 / Нет 4 | |
| Bearfucker оценил продукт на 8 7.10.2019 15:07 | Хороший много компонентник, но из за вкуса приторного надоедает на 2 месяц, ацесульфам калия с ним надо что то делать |
| Отзыв полезен? Да 1 / Нет 0 | |
| Анастасия оценил продукт на 5 29. | Брала вкус ‘апельсин’, который фактически оказался ‘апельсин-крем’. То есть я надеялась на свежую кислинку, а получила то самое, от чего тошнит с первого же раза и больше не хочется. Да, может это личное восприятие, но оценку низкую ставлю за то, что в шейкере отвратно замешивается, даже если с ним бегать полчаса. Такие мерзкие мягко-склизкие комки..на обычный протеин не похоже, какая-то примесь. На стенках шейкера непривычные подтеки, очень очевидные и непросто смывающиеся. Не могу заставить себя его пить, обидненько. < Андрей Александрович> 14.01.2020 14:45 Полностью согласен,вкус апельсин это тошнота,не берите! Молочный шоколад приятен,похож на Несквик |
| Отзыв полезен? Да 1 / Нет 0 | |
| Марина оценил продукт на 9 26.09.2019 22:36 | Подбирался именно многокомпонентный протеин, для замены приема пищи, купила по рекомендации знакомых. Мне хватает на часа 3. Развожу водой, вкус очень приятный, не приторный, у меня ваниль. В шейкере размешивается легко. Развожу водой, вкус очень приятный, не приторный, у меня ваниль. В шейкере размешивается легко. |
| Отзыв полезен? Да 0 / Нет 0 | |
| Анна Талаева оценил продукт на 8 12.09.2019 17:46 | Брала ваниль и шоколад, очень сладкие, приходится добавлять больше воды, сладкие всё равно((. Привкус немного химозный, а так нормальный. |
| Отзыв полезен? Да 0 / Нет 0 | |
| Сергей оценил продукт на 10 9.09.2019 13:21 | По действию — разницы со старым (в белых банках) нет. Новый, в фиолетовых банках, такое ощущение, что стал еще более “крупного помола”, и это хорошо — не летит мелкая пыль при насыпании, растворяется лучше. Никаких проблем с усваиваемостью (хотя ведрами его не жру, но 4 скупа в день — без проблем) <�Сергей> 9.09.2019 13:23 Да, забыл сказать — это я про “печеньки”. Раньше брал другие тоже, попробовать, вот там неприятная мелкая пыль, хуже растворяемость и вкус быстро надоедает, заставояешь себя пить. |
| Отзыв полезен? Да 0 / Нет 0 | |
| Елизавета оценил продукт на 10 2.09.2019 12:02 | Беру вкус Шоколад не первый раз. Не надоедает. Очень похож на Несквик ))) размешивается отлично |
Что такое внеклеточный матрикс?
Внеклеточный матрикс определяет структуру и функцию ткани через сложную сеть макромолекул.
Кредит: Вшивкова / Shutterstock.com
Состав внеклеточного матрикса зависит от типа ткани. Хотя его основная функция заключается в обеспечении необходимого каркаса для клеток, внеклеточный матрикс также регулирует процессы, контролируя коммуникацию между клетками.
Взаимодействия клетки и внеклеточного матрикса жизненно важны для структуры ткани и поддерживаются гетеродимерными молекулами.Более того, внеклеточный матрикс играет важную роль в восстановлении тканей, что может быть использовано в качестве терапевтической мишени.
Строение и функции внеклеточного матрикса
Внеклеточный матрикс состоит из неклеточных компонентов в тканях, которые образуют важный каркас для клеточных компонентов. Структура внеклеточного матрикса различается по составу для разных типов тканей, но в основном состоит из коллагеновых волокон, протеогликанов и белков мультиадгезивного матрикса, которые секретируются клетками.
Функции внеклеточного матрикса включают:
- Образует важную опорную структуру для ячеек.
- Управление связью между ячейками.
- Разделение тканей.
- Регулирует клеточные процессы, такие как рост, миграция и дифференцировка.
Внеклеточный матрикс можно разделить на две группы, каждая из которых имеет определенную структуру. Первые называются промежуточными матрицами и окружающими клетками, а вторые называются перицеллюлярными матрицами и связаны с клетками.
Базальная мембрана — важный пример перицеллюлярного матрикса, находящегося между функциональной и соединительной тканью. Структура обеспечивает закрепляющий слой, который удерживает функциональные клетки ткани вместе. Клетки, встроенные во внеклеточный матрикс, взаимодействуют через поверхностные рецепторы и интегрируют сигналы от матрикса, связанные с их функцией.
Структура обеспечивает закрепляющий слой, который удерживает функциональные клетки ткани вместе. Клетки, встроенные во внеклеточный матрикс, взаимодействуют через поверхностные рецепторы и интегрируют сигналы от матрикса, связанные с их функцией.
Кроме того, клетки участвуют в образовании внеклеточного матрикса посредством секреции макромолекул матрикса.Это означает, что различия в структуре внеклеточного матрикса влияют на биомеханические свойства всей сети в дополнение к сигналам, которые трансформируют ответ клетки.
Взаимодействие клетки с внеклеточным матриксом
Адгезия между клетками и внеклеточным матриксом устанавливается посредством взаимодействия молекул клеточной адгезии, связывающихся с клеточной поверхностью внеклеточного матрикса. Интегрины представляют собой гетеродимерные молекулы, которые образуют связи между поверхностью клетки и внеклеточным матриксом.
Интегрины имеют слабые лигандные взаимодействия, что означает необходимость множественных адгезий к сайтам связывания белков внеклеточного матрикса. Эта слабая сила взаимодействия особенно выгодна для мигрирующих клеток.
Эта слабая сила взаимодействия особенно выгодна для мигрирующих клеток.
Адгезии клетки и внеклеточного матрикса образуются в двух типах интегрин-зависимых соединений: фокальные адгезии и гемидесмосомы. Очаговые спайки возникают в месте прикрепления клеточного цитоскелета и гликопротеина фибронектина внеклеточного матрикса.
Этот тип прикрепления закрепляет клетку и способствует передаче сигналов через плазматическую мембрану. Гемидесмосомы соединяют промежуточные филаменты с базальными пластинками эпителиальных клеток, тем самым обеспечивая жесткую структуру эпителиальной ткани.
Внеклеточный матрикс и восстановление тканей
Механизм восстановления поврежденной ткани зависит от внеклеточного матрикса. Регулирование типов клеток во внеклеточном матриксе позволяет мобилизоваться в областях, требующих восстановления ткани.
Белки внеклеточного матрикса фибрин, фибронектин и коллаген обеспечивают структурную целостность во время репарации, а взаимодействия фибрин-фибронектин служат основой для клеточной адгезии и миграции. Свежеотложенный внеклеточный матрикс может быть реконструирован с образованием нормальной ткани за счет сшивания коллагеновых фибрилл.
Взаимодействия между клеткой и внеклеточным матриксом также влияют на уровень острого воспаления, реэпителизации и сокращения при повреждении ткани.Эти факторы способствуют быстрому закрытию раны, что означает, что важные биологические реакции для минимизации риска инфекции зависят от внеклеточного матрикса.
Способность локально контролировать взаимодействия клетки с внеклеточным матриксом также является привлекательной терапевтической целью. Матрицеклеточные белки, обнаруженные во внеклеточном матриксе, являются примером жизнеспособной мишени. Они обеспечивают сигналы, которые запускают определенные клеточные активности в ране и выражаются с высокой частотой во время развития, но отсутствуют в нормальной взрослой ткани. Таким образом, контролируемая экспрессия матрицеклеточных белков во время заживления ран может вызывать локальное нацеливание.
Таким образом, контролируемая экспрессия матрицеклеточных белков во время заживления ран может вызывать локальное нацеливание.
Источники:
- Frantz, C. et al. 2010. Краткий обзор внеклеточного матрикса, Journal of Cell Science , 123, стр. 4195-4200.
- Theocharis, A.D. et al. 2016. Структура внеклеточного матрикса, Advanced Drug Delivery Reviews, 97, стр. 4-27.
- Lodish, H. et al. Молекулярная клеточная биология. 4-е издание. Нью-Йорк: W.Х. Фриман; 2000. Раздел 22.2, Адгезия клеточного матрикса.
- Midwood, K.S. и другие. 2004. Восстановление тканей и динамика внеклеточного матрикса, Международный журнал биохимии и клеточной биологии , 36, стр. 1031-1037.
Дополнительная литература
соединительных тканей: состав матрицы и его значение для физиотерапии | Физическая терапия
Цели этого обновления — предоставить обзор состава, структуры и функции матрикса соединительной ткани (СТ) и проиллюстрировать, как недавние исследования способствовали лучшему пониманию того, как КТ реагирует на механические силы. Обзор не является исчерпывающим, а скорее стремится проиллюстрировать сложность этих тканей, тканей, которые когда-то считались относительно простыми структурами в механической системе. Конкретные ткани и их особенности, такие как хрящи и кости, подробно не обсуждаются; вместо этого в обзоре подчеркиваются общие принципы, применимые ко всему спектру CT.
Обзор не является исчерпывающим, а скорее стремится проиллюстрировать сложность этих тканей, тканей, которые когда-то считались относительно простыми структурами в механической системе. Конкретные ткани и их особенности, такие как хрящи и кости, подробно не обсуждаются; вместо этого в обзоре подчеркиваются общие принципы, применимые ко всему спектру CT.
Рисунок 1.
Основные компоненты соединительной ткани.
Рисунок 1.
Основные компоненты соединительной ткани.
Двумя наиболее важными волокнистыми компонентами внеклеточного матрикса являются коллаген и эластин, оба нерастворимые макромолекулярные белки. Коллаген имеет множество форм, но, пожалуй, лучше всего представлен выступающими выровненными волокнами сухожилий и связок. Другие коллагеновые волокна, которые гораздо менее заметны, включают небольшие ретикулярные волокна мягких органов, таких как печень, и субмикроскопические фибриллы, обнаруженные в базальных мембранах.Отличительной особенностью наиболее известных коллагенов является их способность противостоять растягивающим нагрузкам. Обычно они показывают минимальное удлинение (менее 10%) при растяжении; часть этого удлинения является результатом не истинного удлинения отдельных волокон, а выпрямления волокон, которые упакованы в различные трехмерные массивы. 3,4 Напротив, эластичные волокна могут увеличиваться в длине на 150%, но все же возвращаться к своей прежней конфигурации. 3
3,4 Напротив, эластичные волокна могут увеличиваться в длине на 150%, но все же возвращаться к своей прежней конфигурации. 3
Второй главный компонент ЕСМ — это PG, разнообразная группа растворимых макромолекул, которые выполняют как структурные, так и метаболические роли. 5,6 Они занимают, наряду с коллагеном, интерстициальные пространства между клетками, образуют часть базальных мембран и прикрепляются к поверхностям клеток, где они действуют как рецепторы. 5,6 Важные механические функции PG включают гидратацию матрикса, стабилизацию коллагеновых сетей и способность противостоять сжимающим силам — способность, лучше всего проявляемая PG суставного хряща. 5 Гиалуронан (HA), который технически не является PG, поскольку в нем отсутствует белковое ядро, особенно важен, поскольку он легко уносит большое количество воды и содержится в больших количествах в увлажненных мягких рыхлых тканях, где требуется повторяющееся движение (например, в оболочках сухожилий). и бурсы). 7,8
и бурсы). 7,8
Третья группа молекул матрикса, гликопротеины, встречаются повсеместно во всех CT и, как и в случае с PG, играют как структурную, так и метаболическую роль. Их механические функции включают обеспечение связи между компонентами матрицы, а также между ячейками и компонентами матрицы.
Важная концепция заключается в том, что механические свойства CT, такие как способность противостоять растяжению, сжатию, растяжимости и кручению, определяются пропорциями компонентов матрицы.В свою очередь, поддержание этих компонентов матрицы и их организация зависят от характера и степени нагрузки, испытываемой этими тканями. Обычно ткани с высоким содержанием коллагеновых волокон и низким содержанием PG сопротивляются силам растяжения, а ткани с высоким содержанием PG в сочетании с сетью коллагеновых волокон выдерживают сжатие (Табл. 1). Травма или патология могут повлиять на нормальные движения и привести к изменению механических нагрузок на КТ. Это, в свою очередь, вызывает изменения в ECM и на уровне экспрессии генов, как будет обсуждаться ниже.
и механические свойства общих соединительных тканей 1,7 , a
| Ткань . | Основной тип ячейки . | Доминантное волокно . | Доминирующее содержание PG / GAG и общее содержание GAG . | Механические свойства . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Сухожилие | Теноциты | Коллаген | Дерматансульфат PG ~ 0.2% от сухого веса | Противостоит силам растяжения | |||||||
| Суставной хрящ | Хондроциты | Коллаген | Хондроитинсульфат PG ~ 8% –10% от сухого веса | Сопротивляет силам сжатия1412 | Остеоциты | Коллаген | Хондроитинсульфат PG Очень небольшой процент от сухого веса | Сопротивляется растяжению, сжатию и скручиванию (из-за гидроксиапатита) | |||
| Dermis | Фибробластов | Elast хладагента коллагена | ~ 1% от сухого весаСопротивление растяжению и умеренному сжатию и допускает растяжение |
| Ткань
. | Основной тип ячейки . | Доминантное волокно . | Доминирующее содержание PG / GAG и общее содержание GAG . | Механические свойства . |
|---|---|---|---|---|
| Сухожилие | Теноциты | Коллаген | Дерматансульфат PG ~ 0,2% от сухого веса | Сопротивляется силам растяжения |
| Суставной хрящ ~ | Хондроциты | Хондрохондроид 10% от сухого веса | Сопротивляется силам сжатия | |
| Кость | Остеобласты Остеоциты | Коллаген | Хондроитинсульфат PG Очень маленький процент от сухого веса | Сопротивляется растяжению, сжатию и кручению |
| Дерма | Фибробласты | Коллаген Эластин | Дерматан и хондроитинсульфат PG ~ 1% от сухого веса | Сопротивляется растяжению и умеренному сжатию и допускает растяжение |

Основные компоненты внеклеточного матрикса и механические свойства общих соединительных тканей 1,7 , a
| Ткань . | Основной тип ячейки . | Доминантное волокно . | Доминирующее содержание PG / GAG и общее содержание GAG . | Механические свойства . | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Сухожилие | Теноциты | Коллаген | Дерматансульфат PG ~ 0.2% от сухого веса | Противостоит силам растяжения | |||||||
| Суставной хрящ | Хондроциты | Коллаген | Хондроитинсульфат PG ~ 8% –10% от сухого веса | Сопротивляет силам сжатия1412 | Остеоциты | Коллаген | Хондроитинсульфат PG Очень небольшой процент от сухого веса | Сопротивляется растяжению, сжатию и скручиванию (из-за гидроксиапатита) | |||
| Dermis | Фибробластов | Elast хладагента коллагена | ~ 1% от сухого весаСопротивление растяжению и умеренному сжатию и допускает растяжение |
Ткань
. | Основной тип ячейки . | Доминантное волокно . | Доминирующее содержание PG / GAG и общее содержание GAG . | Механические свойства . |
|---|---|---|---|---|
| Сухожилие | Теноциты | Коллаген | Дерматансульфат PG ~ 0,2% от сухого веса | Сопротивляется силам растяжения |
| Суставной хрящ ~ | Хондроциты 10% от сухого веса | Сопротивляется силам сжатия | ||
| Кость | Остеобласты Остеоциты | Коллаген | Хондроитинсульфат PG Очень небольшой процент от сухого веса | Сопротивляется растяжению, сжатию и кручению |
| Дерма | Фибробласты | Коллаген Эластин | Дерматан и хондроитинсульфат PG ~ 1% от сухого веса | Сопротивляется растяжению и умеренному сжатию и способствует растяжению |
Тройная спираль состоит из 3 полипептидных цепей, сложенных в виде веревки. Каждая цепь, известная как α-цепь, характеризуется повторяющимися последовательностями из 3 аминокислот, глицин-X-Y (рис. 2). Поскольку глицин является самой маленькой аминокислотой и занимает центральное ядро тройной спирали, повторение глицина как каждой третьей аминокислоты важно для правильного сворачивания 3 α-цепей в спиральную конформацию. 10,11 Определенные типы коллагена образованы множеством α-цепей и вариациями комбинации различных α-цепей: в некоторых коллагенах все 3 α-цепи идентичны; в других коллагенах 2 α-цепи могут быть идентичными; а в некоторых коллагенах все 3 α-цепи различны. Изменение последовательности аминокислот глицин-X-Y обычно приводит к нарушению функции молекулы коллагена и потере ее механических свойств (например, несовершенный остеогенез). 12 Спиральный комплекс, который по своей природе сопротивляется растяжению, дополнительно усилен межмолекулярными связями между α-цепями соседних молекул. 13
12 Спиральный комплекс, который по своей природе сопротивляется растяжению, дополнительно усилен межмолекулярными связями между α-цепями соседних молекул. 13
Рисунок 2.
Часть молекулы коллагена, показывающая, что отдельные альфа-цепи скручены, образуя тройную спираль. Внутри каждой цепи аминокислоты аналогичным образом расположены по спирали, причем глицин (G) обращен к центру тройной спирали. Остальные аминокислоты обозначены точками.
Рисунок 2.
Часть молекулы коллагена, показывающая отдельные альфа-цепи, свернутые в спираль, образуя тройную спираль. Внутри каждой цепи аминокислоты аналогичным образом расположены по спирали, причем глицин (G) обращен к центру тройной спирали.Остальные аминокислоты обозначены точками.
Концы или терминалы молекулы коллагена не являются спиральными, но важны для образования фибрилл коллагена и для других нетенсильных функций, включая взаимодействие с другими внеклеточными компонентами. Альфа-цепи основных коллагенов синтезируются с относительно длинными конечностями, и после образования тройной спирали эта вновь образованная молекула коллагена (называемая проколлагеном) выбрасывается из клетки во внеклеточное пространство, где ферментативно происходит большая часть неспиральных концов. удаленный.Удаление позволяет укороченным молекулам, теперь называемым тропоколлагеном, связываться друг с другом и образовывать фибриллы, которые видны под электронным микроскопом и характеризуются четкими поперечными полосами. Затем эти фибриллы объединяются с образованием волокон, которые видны под световым микроскопом, и пучков волокон, которые видны глазом 14 (рис. 3).
Альфа-цепи основных коллагенов синтезируются с относительно длинными конечностями, и после образования тройной спирали эта вновь образованная молекула коллагена (называемая проколлагеном) выбрасывается из клетки во внеклеточное пространство, где ферментативно происходит большая часть неспиральных концов. удаленный.Удаление позволяет укороченным молекулам, теперь называемым тропоколлагеном, связываться друг с другом и образовывать фибриллы, которые видны под электронным микроскопом и характеризуются четкими поперечными полосами. Затем эти фибриллы объединяются с образованием волокон, которые видны под световым микроскопом, и пучков волокон, которые видны глазом 14 (рис. 3).
Рисунок 3.
Представление синтеза, секреции и сборки коллагена. Адаптировано с разрешения Kielty CM, Hopkinson I, Grant ME.Коллаген: семейство коллагена, структура, сборка и организация во внеклеточном матриксе. В: Royce PM, Steinmann BS, eds. Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 113.
Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 113.
Рисунок 3.
Представление синтеза, секреции и сборки коллагена. Адаптировано с разрешения Kielty CM, Hopkinson I, Grant ME. Коллаген: семейство коллагена, структура, сборка и организация во внеклеточном матриксе.В: Royce PM, Steinmann BS, eds. Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 113.
Модификации, вариации и дополнения к основной трехспиральной конформации дают начало 6 классам коллагенов (табл. 2). 9,10 Наибольшее значение для физиотерапевтов имеют образующие фибриллы коллагены, которые обнаруживаются в тканях (например, в сухожилиях, связках), где их основная функция заключается в сопротивлении растягивающим силам, и в тканях, где существует потребность в сопротивлении растягивающим нагрузкам. (например, дерма, суставной хрящ, межпозвонковые диски [МПД], кость).Другие 5 классов коллагена, которые гораздо менее распространены, но, тем не менее, необходимы для функций компьютерной томографии во всем организме, играют различные роли. 9,10 Эти классы коллагена и их роли приведены в Таблице 2.
9,10 Эти классы коллагена и их роли приведены в Таблице 2.
9,10
| Классы коллагена . | Типы коллагена . | Примеры расположения . | Функции . |
|---|---|---|---|
| FibralForring collagen | I, II, III, V, XI | Сухожилия, самые длинные, межпозвоночный диск, крестовина. cantlage, blood vasseta, demta | I, II, III: ректально на V, XI: контрольный диометрический слой I |
| Коллагены, ассоциированные с волокном, с прерывающимся тройным hassce FACIII | IX, XII, XIV143I | Coassution bla с коллагеном brifforring, например, типа IX и типа III в коллогенеIntract с другими корспондентами матрикса | |
| Net work fonning collogen | IV | Bossent interbrance | Separate I cell sure accosprounda70 типов другие ядерные клетки и служат и td Играют в регуляцию клеточного роста, интеграции и различных аттенюаторов |
| Flanerotous collogen | VI | Uboqtous is connected Issue | Brdgeta and aschara code to charcocebase В стадии разработки и небольшого появления проблем |
| Коллоген с короткой цепью | VII, X, XIII | VII кореза и вазоутер проблема X-водородное загрязнение XIII стенка кровяной вазели, глоценозная к \ килвей | Неизвестно |
| Коллоген с длинной цепью | VII | Bconncusearbrance | внутреннее соединение подвала к соединительному элементу аэропорта Матрица проблем |
| Классы коллагена
. | Типы коллагена . | Примеры расположения . | Функции . |
|---|---|---|---|
| FibralForring collagen | I, II, III, V, XI | Сухожилия, самые длинные, межпозвоночный диск, крестовина. cantlage, blood vasseta, demta | I, II, III: ректально на V, XI: контрольный диометрический слой I |
| Коллагены, ассоциированные с волокном, с прерывающимся тройным hassce FACIII | IX, XII, XIV143I | Coassution bla с коллагеном brifforring, например, типа IX и типа III в коллогенеIntract с другими корспондентами матрикса | |
| Net work fonning collogen | IV | Bossent interbrance | Separate I cell sure accosprounda70 типов другие ядерные клетки и служат и td Играют в регуляцию клеточного роста, интеграции и различных аттенюаторов |
| Flanerotous collogen | VI | Uboqtous is connected Issue | Brdgeta and aschara code to charcocebase В стадии разработки и небольшого появления проблем |
| Коллоген с короткой цепью | VII, X, XIII | VII кореза и вазоутер проблема X-водородное загрязнение XIII стенка кровяной вазел, глоцент к \ килвей | Неизвестно |
| Длинноцепочечный коллоген | VII | Bconncusearbrance | Внутренний доступ подвала к аэропорту Матрица проблем |

Типы, расположение и функции коллагена 9,10
| Классы коллагена . | Типы коллагена . | Примеры расположения . | Функции . |
|---|---|---|---|
| FibralForring collagen | I, II, III, V, XI | Сухожилия, самые длинные, межпозвоночный диск, крестовина. cantlage, blood vasseta, demta | I, II, III: ректально на V, XI: контрольный диометрический слой I |
| Коллагены, ассоциированные с волокном, с прерывающимся тройным hassce FACIII | IX, XII, XIV143I | Coassution bla с коллагеном brifforring, например, типа IX и типа III в коллогенеIntract с другими корспондентами матрикса | |
| Net work fonning collogen | IV | Bossent interbrance | Separate I cell sure accosprounda70 типов другие ядерные клетки и служат и td Играют в регуляцию клеточного роста, интеграции и различных аттенюаторов |
| Flanerotous collogen | VI | Uboqtous is connected Issue | Brdgeta and aschara code to charcocebase В стадии разработки и небольшого появления проблем |
| Коллоген с короткой цепью | VII, X, XIII | VII кореза и вазоутер проблема X-водородное загрязнение XIII стенка кровяной вазели, глоценозная к \ килвей | Неизвестно |
| Коллоген с длинной цепью | VII | Bconncusearbrance | внутреннее соединение подвала к соединительному элементу аэропорта Матрица проблем |
Классы коллагена
. | Типы коллагена . | Примеры расположения . | Функции . |
|---|---|---|---|
| FibralForring collagen | I, II, III, V, XI | Сухожилия, самые длинные, межпозвоночный диск, крестовина. cantlage, blood vasseta, demta | I, II, III: ректально на V, XI: контрольный диометрический слой I |
| Коллагены, ассоциированные с волокном, с прерывающимся тройным hassce FACIII | IX, XII, XIV143I | Coassution bla с коллагеном brifforring, например, типа IX и типа III в коллогенеIntract с другими корспондентами матрикса | |
| Net work fonning collogen | IV | Bossent interbrance | Separate I cell sure accosprounda70 типов другие ядерные клетки и служат и td Играют в регуляцию клеточного роста, интеграции и различных аттенюаторов |
| Flanerotous collogen | VI | Uboqtous is connected Issue | Brdgeta and aschara code to charcocebase В стадии разработки и небольшого появления проблем |
| Коллоген с короткой цепью | VII, X, XIII | VII кореза и вазоутер проблема X-водород XIII стенка кровяной вазел, глоцент к \ килвэй | Неизвестно |
| Коллоген с длинной цепью | VII | Bconncusearbrance | внутреннее соединение базиса с соединительным элементом аэропорта Матрица проблем |
Фибриллообразующие коллагены (типы I, II, III, V и XI)
Фибриллообразующие коллагены составляют более 70% от общего количества коллагена в организме. 10 Коллаген I типа преобладает в тканях, таких как кости, сухожилия, связки, суставные капсулы и фиброзное кольцо МПД. Коллаген типа II находится в основном в суставном хряще и пульпозном ядре МПД. Коллаген III типа, по-видимому, играет роль в растяжимости тканей и особенно обнаруживается в тканях эмбриона и во многих тканях взрослого человека, таких как артерии, кожа и мягкие органы, где они образуют ретикулярные волокна. 11,15 Преобладание коллагена типа III также является индикатором зрелости ткани и также заметно на начальных стадиях заживления и образования рубцовой ткани, где он обеспечивает раннюю механическую прочность вновь синтезированного матрикса. 14 По мере развития плода и увеличения прочности заживающих тканей волокна типа III заменяются более прочными волокнами типа I. 16–18 Как правило, фибриллы типа I имеют большой диаметр, что коррелирует со способностью выдерживать большую механическую нагрузку. У молодых растущих сухожилий упражнения увеличивают диаметр фибрилл и предел прочности на разрыв, но у взрослых эффект упражнений минимален.
10 Коллаген I типа преобладает в тканях, таких как кости, сухожилия, связки, суставные капсулы и фиброзное кольцо МПД. Коллаген типа II находится в основном в суставном хряще и пульпозном ядре МПД. Коллаген III типа, по-видимому, играет роль в растяжимости тканей и особенно обнаруживается в тканях эмбриона и во многих тканях взрослого человека, таких как артерии, кожа и мягкие органы, где они образуют ретикулярные волокна. 11,15 Преобладание коллагена типа III также является индикатором зрелости ткани и также заметно на начальных стадиях заживления и образования рубцовой ткани, где он обеспечивает раннюю механическую прочность вновь синтезированного матрикса. 14 По мере развития плода и увеличения прочности заживающих тканей волокна типа III заменяются более прочными волокнами типа I. 16–18 Как правило, фибриллы типа I имеют большой диаметр, что коррелирует со способностью выдерживать большую механическую нагрузку. У молодых растущих сухожилий упражнения увеличивают диаметр фибрилл и предел прочности на разрыв, но у взрослых эффект упражнений минимален. Тем не менее, постоянное натяжение необходимо для поддержания структуры сухожилия, поскольку иммобилизация приводит к потере прочности на разрыв. 19
Тем не менее, постоянное натяжение необходимо для поддержания структуры сухожилия, поскольку иммобилизация приводит к потере прочности на разрыв. 19
Фибриллы также могут состоять из более чем одного типа коллагена. Типы V и XI объединяются с коллагеном типа I и II, соответственно, с образованием гетеротипических фибрилл, расположение которых, как считается, играет роль в определении диаметра фибрилл и тем самым влияет на механические свойства. Как правило, чем больше диаметр фибриллы, тем меньше процентное содержание коллагена типа V и типа XI. 11
Сопротивление растяжению фибриллообразующих коллагенов является основным средством ограничения диапазона движений суставов, передачи усилий, создаваемых мышцами, придания прочности на растяжение костному скелету и сопротивления растяжению поверхностных слоев суставного хряща.Расположение и выравнивание коллагеновых волокон отражает механические нагрузки, действующие на ткани.
В сухожилиях большинство волокон выровнено параллельно, что позволяет им противостоять однонаправленным силам и эффективно передавать силы, генерируемые мышцами, к костям. 4 Для сравнения, волокна типа I в связках часто располагаются немного менее параллельными рядами, что отражает необходимость противостоять разнонаправленным силам. Например, связки, связанные с суставами, должны как ограничивать движение, так и обеспечивать стабильность суставов.Коллаген также играет важную роль в прикреплении сухожилий и связок к кости. В этих местах сухожилия и связки обычно расширяются и уступают место фиброхрящам — трансформации, при которой выровненные волокна, исходящие из сухожилия или связки, разделяются другими коллагеновыми волокнами, расположенными в трехмерной сети, окружающей округлые клетки. 20 Такое расположение помогает передавать растягивающие усилия на большую площадь и снижает вероятность отказа при чрезмерной нагрузке.
4 Для сравнения, волокна типа I в связках часто располагаются немного менее параллельными рядами, что отражает необходимость противостоять разнонаправленным силам. Например, связки, связанные с суставами, должны как ограничивать движение, так и обеспечивать стабильность суставов.Коллаген также играет важную роль в прикреплении сухожилий и связок к кости. В этих местах сухожилия и связки обычно расширяются и уступают место фиброхрящам — трансформации, при которой выровненные волокна, исходящие из сухожилия или связки, разделяются другими коллагеновыми волокнами, расположенными в трехмерной сети, окружающей округлые клетки. 20 Такое расположение помогает передавать растягивающие усилия на большую площадь и снижает вероятность отказа при чрезмерной нагрузке.
Костные коллагеновые волокна I типа имеют более сложное расположение.Обычно фибриллы располагаются ортогональными рядами, подобно тому, как древесные волокна в фанере располагаются в чередующихся листах. Такое расположение, особенно когда оно выполнено в виде небольших цилиндров, таких как остеоны, обеспечивает значительную разнонаправленную прочность на растяжение.
Такое расположение, особенно когда оно выполнено в виде небольших цилиндров, таких как остеоны, обеспечивает значительную разнонаправленную прочность на растяжение.
Комбинация коллагена типа I и типа II обнаруживается в МПД и в сухожилиях с фиброзно-хрящевыми подушечками давления. 21 В фиброзном кольце МПД чередующиеся слои волокон типа I связывают соседние тела позвонков и окружают центральное пульпозное ядро.Фиброзные ленты обычно выровнены под углами примерно 45 градусов от оси позвонка, расположение, которое обеспечивает механизм гибкости позвоночника и повышения сопротивления чрезмерному движению вблизи пределов движения. В пульпозном ядре преобладает коллаген типа II, и есть высокие уровни HA и сульфатированного PG, которые действуют вместе с волокнами типа II, обеспечивая гидратированное и устойчивое к давлению ядро. 22
В суставном хряще основными коллагеновыми волокнами являются волокна типа II, которые образуют сеть полос между клетками. На первый взгляд эти фиброзные тяжи в основном касаются суставной поверхности, но с увеличением глубины они становятся более радиальными и проходят между столбиками клеток. Непосредственно вокруг клеток другие коллагеновые волокна типа II объединяются с типами VI, IX и XI в плотную структуру капсулы. Эти волокнистые ленты обеспечивают как свойства растяжения хряща, так и, в сочетании с большими сульфатированными PG, механизм сопротивления сжатию. Считается, что капсульный коллаген защищает хондроциты от этих внешних сил. 23,24
На первый взгляд эти фиброзные тяжи в основном касаются суставной поверхности, но с увеличением глубины они становятся более радиальными и проходят между столбиками клеток. Непосредственно вокруг клеток другие коллагеновые волокна типа II объединяются с типами VI, IX и XI в плотную структуру капсулы. Эти волокнистые ленты обеспечивают как свойства растяжения хряща, так и, в сочетании с большими сульфатированными PG, механизм сопротивления сжатию. Считается, что капсульный коллаген защищает хондроциты от этих внешних сил. 23,24
Эластичные волокна: растяжимые элементы внеклеточного матрикса
Эластичные волокна в ЕСМ позволяют тканям, таким как кожа, легкие и кровеносные сосуды, выдерживать многократное растяжение и значительную деформацию и возвращаться в расслабленное состояние. Расположение эластина варьируется и во многом зависит от силы и направления сил, действующих на ткань. Волокна могут быть организованы в концентрические фенестрированные листы (например, аорта), в виде небольших отдельных волокон (например, кожи, легких) или в виде трехмерной сотовой сети тонких волокон (например, эластичного хряща). 25
25
Эластичные волокна состоят из эластиновой сердцевины и микрофибрилл, расположенных в основном по периферии (рис. 4). Микрофибриллы, которые в основном состоят из фибриллина, первоначально действуют как каркас, на котором откладывается эластин, но как только образуется сердцевина эластина, большинство микрофибрилл перемещается на внешнюю поверхность волокна. Эластин содержит 2 аминокислоты (т.е. десмозин и изодесмозин), которые образуют поперечные связи между соседними цепями тропоэластина и играют важную роль в придании эластина эластину. 26 Точный механизм растяжимости не совсем понятен, но количество эластина, обнаруженного в ткани, обычно отражает величину механического напряжения, наложенного на нее, и необходимость обратимой деформации (обзор эластина см. В Chadwick and Goode 27 ).
Рисунок 4.
Изображение эластичного волокна, показывающее эластиновую сердцевину, содержащую и окруженную микрофибриллами. Адаптировано с разрешения Cormack DH. Основная гистология. Филадельфия, Пенсильвания: JB Lippincott Co; 1993: 107.
Основная гистология. Филадельфия, Пенсильвания: JB Lippincott Co; 1993: 107.
Рисунок 4.
Изображение эластичного волокна, показывающее ядро из эластина, содержащее и окруженное микрофибриллами. Адаптировано с разрешения Cormack DH. Основная гистология. Филадельфия, Пенсильвания: JB Lippincott Co; 1993: 107.
Эластичные волокна широко распространены и в разной степени обнаруживаются в большинстве органов. Они находятся по всему трахеобронхиальному дереву легкого и в значительной степени отвечают за приспособление к изменениям давления. 28 Потенциальная энергия, запасенная в эластичном волокне в конце вдоха, высвобождается во время выдоха с последующей вспомогательной отдачей легочной ткани. 28 Точно так же эластин, который находится в стенках артерий, противостоит деформации, вызванной систолой, отскакивает во время диастолы и компенсирует гемодинамические напряжения, которые ток крови накладывает на стенку артерии. 25,29
В дерме эластичные волокна обеспечивают характерную упругость кожи. Имеется предпочтительная ориентация, при которой свернутые в спираль волокна выравниваются преимущественно под прямым углом к линиям натяжения кожи и в направлении, которое обеспечивает большее растяжение кожи. 18 Как изменение конформации, так и общая потеря эластичных волокон с возрастом снижают способность кожи к отдаче. 30
Имеется предпочтительная ориентация, при которой свернутые в спираль волокна выравниваются преимущественно под прямым углом к линиям натяжения кожи и в направлении, которое обеспечивает большее растяжение кожи. 18 Как изменение конформации, так и общая потеря эластичных волокон с возрастом снижают способность кожи к отдаче. 30
Эластичные волокна относительно редки в связках, за двумя примечательными исключениями: выйная связка в шейном отделе позвоночного столба и желтая связка, соединяющая пластинки соседних позвонков. 31 Эластичная отдача в этих связках помогает разгибать голову, шею и туловище против силы тяжести, тем самым уменьшая нагрузку на мышцы, выпрямляющие позвоночник, спины. Отсутствие регенерации функциональных эластических волокон у взрослых является серьезной проблемой, и после потери этой способности к регенерации восстановление нормальной функции становится невозможным. 30 Эластин, однако, синтезируется взрослыми тканями в ответ на циклическое растяжение, повреждение и ультрафиолетовое излучение 32 и тканями при ряде болезненных состояний, включая эмфизему. 33 Взрослые, однако, по-видимому, не могут восстановить механизмы сборки эластичных волокон, и функция не восстанавливается. 27 В целом отсутствуют знания о механизмах контроля образования эластичных волокон. 27
33 Взрослые, однако, по-видимому, не могут восстановить механизмы сборки эластичных волокон, и функция не восстанавливается. 27 В целом отсутствуют знания о механизмах контроля образования эластичных волокон. 27
Протеогликаны: гидраторы, стабилизаторы и наполнители внеклеточного матрикса
PG характеризуются коровым белком, ковалентно связанным с одной или несколькими боковыми цепями сульфатированного гликозаминогликана (GAG).Коровые белки обычно специфичны для каждого из типов PG и демонстрируют значительную изменчивость по размеру. Точно так же существуют различные цепочки GAG. Цепи GAG состоят из повторяющихся дисахаридных единиц, причем тип и количество единиц в значительной степени определяют свойства PG. 5 Комбинации сахаров составляют дисахаридные единицы, в результате чего образуются 6 основных ГАГ: хондроитинсульфаты 4 (CS A) и 6 (CS C), кератансульфат (KS), дерматансульфат (DS, также известный как CS B), гепаран сульфат и ГК. Гиалуронан нетипичен, потому что он не прикреплен к ядру белка и не сульфатирован. Однако его обычно включают в обсуждение PG, потому что он является наиболее распространенным и повсеместным из GAGs, и он играет важную роль в связывании с другими PG с образованием супрамолекулярных комплексов.
Гиалуронан нетипичен, потому что он не прикреплен к ядру белка и не сульфатирован. Однако его обычно включают в обсуждение PG, потому что он является наиболее распространенным и повсеместным из GAGs, и он играет важную роль в связывании с другими PG с образованием супрамолекулярных комплексов.
Все ГАГ отрицательно заряжены и имеют склонность притягивать ионы, создавая осмотический дисбаланс, в результате чего PG-GAG поглощает воду из окружающих областей. Это поглощение помогает поддерживать гидратацию матрицы; степень гидратации зависит от количества цепей GAG и от ограничения набухания PG окружающими коллагеновыми волокнами. 6
Процент GAG в CT напрямую зависит от механической нагрузки. Ткани, подверженные высоким сжимающим силам (например, суставной хрящ), имеют большое содержание PG (примерно 8-10% от сухого веса ткани). И наоборот, в устойчивых к растяжению тканях, таких как сухожилия и связки, PG обнаруживаются в относительно небольших концентрациях (примерно 0,2% от сухой массы). 7 Кроме того, пропорции PG различаются в зависимости от механической нагрузки таким образом, что отношение CS: DS выше в тканях, подвергающихся сжатию, и ниже в тканях, которые сопротивляются растяжению. 7
7 Кроме того, пропорции PG различаются в зависимости от механической нагрузки таким образом, что отношение CS: DS выше в тканях, подвергающихся сжатию, и ниже в тканях, которые сопротивляются растяжению. 7
Протеогликан можно разделить на агрегирующие и неагрегирующие PG. Ключевыми особенностями, которые различают эти 2 группы, являются их способность или неспособность агрегировать с HA и количество боковых цепей GAG, которые связываются с ядром белка. 5
Агрегирующие протеогликаны
Агрегированные PG связываются с HA. Большой комплекс возникает, когда многие мономеры PG связываются с одной цепью НА. Связь PG-HA стабилизируется гликопротеином, известным как связывающий белок, который помогает закрепить мономеры PG на HA. 34 Поскольку цепи GAG, прикрепленные к ядру PG, заряжены отрицательно и выходят из ядра белка, как щетинки ёршика для бутылок, создается высокая плотность заряда. Эта плотность заряда вызывает давление осмотического набухания, что приводит к перемещению воды в матрицу. Следовательно, PG будет иметь тенденцию к набуханию, но устойчивые к растяжению коллагеновые волокна и связывание отрицательно заряженных цепей GAG с областями положительного заряда на фибриллах коллагена ограничивают расширение PG примерно до 20% их способности к набуханию. 35,36 Это ограниченное расширение обеспечивает жесткость матрицы и, при высоком содержании PG, наделяет ткань способностью противостоять силам сжатия. Двумя примерами агрегации PG являются аггрекан и версикан.
Эта плотность заряда вызывает давление осмотического набухания, что приводит к перемещению воды в матрицу. Следовательно, PG будет иметь тенденцию к набуханию, но устойчивые к растяжению коллагеновые волокна и связывание отрицательно заряженных цепей GAG с областями положительного заряда на фибриллах коллагена ограничивают расширение PG примерно до 20% их способности к набуханию. 35,36 Это ограниченное расширение обеспечивает жесткость матрицы и, при высоком содержании PG, наделяет ткань способностью противостоять силам сжатия. Двумя примерами агрегации PG являются аггрекан и версикан.
Aggrecan — наиболее известный и хорошо изученный агрегирующий PG. Это преобладающий PG в суставном хряще и играет важную роль в нормальной функции суставов и в росте скелета. 6,37 Большой набор цепей CS (примерно 100) и меньший набор цепей KS (примерно 30) прикреплены к белковому ядру мономера (рис.5). Версикан имеет меньше цепей CS (примерно 30), прикрепленных к его корному белку, но он также агрегируется с HA и способствует сопротивлению сжимающим силам. 5 Версикан содержится во многих тканях, включая стенки кровеносных сосудов, 36 МПД, 22 и некоторые участки сухожилий, которые подвергаются сжимающей нагрузке. 21 Версикан, наряду с HA, также действует как антиадгезивная молекула и облегчает миграцию клеток. 38,39
5 Версикан содержится во многих тканях, включая стенки кровеносных сосудов, 36 МПД, 22 и некоторые участки сухожилий, которые подвергаются сжимающей нагрузке. 21 Версикан, наряду с HA, также действует как антиадгезивная молекула и облегчает миграцию клеток. 38,39
Рисунок 5.
Представление мономера аггрекана с боковыми цепями гликозаминогликанов кератансульфата (KS) и хондроитинсульфата (CS), прикрепленными к ядру белка. Мономер присоединен к гиалуронану и стабилизируется в этой области связывания с помощью связывающего белка. Многие мономеры присоединяются к гиалуронану с образованием большого агрегата протеогликана. Адаптировано с разрешения Heinegard D, Oldberg A. Гликозилированные матричные белки. В: Royce PM, Steinmann B, eds. Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты.Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 193.
Рисунок 5.
Представление мономера аггрекана с гликозаминогликановыми боковыми цепями кератансульфата (KS) и хондроитинсульфата (CS), прикрепленных к ядру белка. Мономер присоединен к гиалуронану и стабилизируется в этой области связывания с помощью связывающего белка. Многие мономеры присоединяются к гиалуронану с образованием большого агрегата протеогликана. Адаптировано с разрешения Heinegard D, Oldberg A. Гликозилированные матричные белки. В: Royce PM, Steinmann B, eds.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 193.
Мономер присоединен к гиалуронану и стабилизируется в этой области связывания с помощью связывающего белка. Многие мономеры присоединяются к гиалуронану с образованием большого агрегата протеогликана. Адаптировано с разрешения Heinegard D, Oldberg A. Гликозилированные матричные белки. В: Royce PM, Steinmann B, eds.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, штат Нью-Йорк: Уайли-Лисс; 1993: 193.
Неагрегационные протеогликаны
Неагрегирующие PGs не связываются с HA и часто имеют лишь небольшое количество боковых цепей GAG, состоящих из CS и DS. Они, по-видимому, играют ограниченную роль в противостоянии сжатию, но они взаимодействуют с другими компонентами матрикса и вносят свой вклад в механическую стабильность за счет взаимодействия с коллагеном.Декорин, который имеет одну цепь GAG, является одним из самых маленьких PG и частично связывает соседние фибриллы коллагена. Коровые белки связываются в определенных сайтах на поверхности фибрилл, и цепь GAG простирается, образуя антипараллельный массив с соседней цепью GAG декорина, отходящей от соседней фибриллы. 40 Бигликан (2 цепи ГАГ) также мал и находится в матриксе между пучками коллагеновых фибрилл. Механические и другие функции бигликана не изучены, но и бигликан, и декорин играют роль в регуляции клеточной активности, в первую очередь за счет связывания факторов роста через специфические сайты с высоким и низким сродством на основных белках 41 (рис. .6).
Коровые белки связываются в определенных сайтах на поверхности фибрилл, и цепь GAG простирается, образуя антипараллельный массив с соседней цепью GAG декорина, отходящей от соседней фибриллы. 40 Бигликан (2 цепи ГАГ) также мал и находится в матриксе между пучками коллагеновых фибрилл. Механические и другие функции бигликана не изучены, но и бигликан, и декорин играют роль в регуляции клеточной активности, в первую очередь за счет связывания факторов роста через специфические сайты с высоким и низким сродством на основных белках 41 (рис. .6).
Рисунок 6.
Представление бигликана (2 боковые цепи гликозаминогликана) и декорина (1 цепь) с их подобными коровыми белками. CS = хондроитинсульфат, DS = дерматансульфат, S-S = дисульфидные связи, Y = олигосахариды. Адаптировано с разрешения Heinegard D, Oldberg A. Гликозилированные матричные белки. В: Royce PM, Steinmann B, eds. Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, Нью-Йорк: Wiley-Liss; 1993: 198.316.
Нью-Йорк, Нью-Йорк: Wiley-Liss; 1993: 198.316.
Рисунок 6.
Представление бигликана (2 боковые цепи гликозаминогликана) и декорина (1 цепь) с их подобными коровыми белками. CS = хондроитинсульфат, DS = дерматансульфат, S-S = дисульфидные связи, Y = олигосахариды. Адаптировано с разрешения Heinegard D, Oldberg A. Гликозилированные матричные белки. В: Royce PM, Steinmann B, eds. Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты. Нью-Йорк, Нью-Йорк: Wiley-Liss; 1993: 198.316.
Гепарансульфат PG, синдекан, прикрепляется к клеточной мембране и играет роль в росте клеток посредством связывания факторов роста, таких как основной фактор роста фибробластов, и действует как корецептор. 42,43 Perlecan находится вблизи поверхности клеток и вносит свой вклад в структуру базальных мембран. Помимо поддержки, он способствует клеточной дифференциации. 44
Гиалуронан — важный компонент аггреканового комплекса, но он также существует в виде свободной молекулы. Гиалуронан сильно захватывает воду и проявляется там, где матрица сильно гидратирована, например, в рыхлой CT. 7,8 Относительно богатый раствор ГК содержится в стекловидном теле глаза, пуповине и синовиальной жидкости суставов, где его реологические свойства подходят для смазывания. 45,46
Гиалуронан сильно захватывает воду и проявляется там, где матрица сильно гидратирована, например, в рыхлой CT. 7,8 Относительно богатый раствор ГК содержится в стекловидном теле глаза, пуповине и синовиальной жидкости суставов, где его реологические свойства подходят для смазывания. 45,46
Роль механических сил в определении содержания и типа протеогликанов
Имеются убедительные доказательства того, что поддержание нормальной архитектуры ткани требует нормальной физиологической механической нагрузки и что КТ реагируют на изменения приложенных напряжений изменением содержания и типа PG.
Движение в суставах важно для нормального поддержания и обмена PG в здоровом суставном хряще. И наоборот, иммобилизация сустава или неиспользование приводит к атрофии суставного хряща из-за потери PG из матрикса. 37 Важно отметить, что потеря PG после иммобилизации сустава обратима с помощью программы ремобилизации. 37,47
37,47
Одного движения без нагрузки достаточно для поддержания содержания PG в суставном хряще барана. 48 Однако отсутствие веса и движения привело к большой потере (40%) PG в течение 1 месяца.
Артритные заболевания, вызванные травмой или дегенеративными процессами, также приводят к нарушению синтеза и деградации аггрекана, а также к неспособности мономера аггрекана связываться с ГК и образовывать большие агрегаты. 49 В результате хрящ может не сопротивляться сжатию эффективно.
Несущее МПД также имеет высокое содержание PG, при этом PG концентрируется в основном в пульпозном ядре и уменьшается по периферии к фиброзному кольцу, где ткань находится под возрастающим напряжением.Однако даже внешняя область фиброзного кольца имеет более высокое содержание PG, чем основные устойчивые к растяжению структуры, такие как сухожилия и связки, что отражает необходимость противостоять как растяжению, так и давлению. Отказ МПД может частично быть результатом неспособности аггрекана и НА образовывать стабильный комплекс из-за фрагментации связывающего белка. 50
50
В сухожилиях сгибателей, которые расположены под углом вокруг костного выступа, внешняя часть сухожилия, подвергаемая растяжению, имеет низкое содержание PG с высокой долей дерматансульфата PG. 7 Напротив, более глубокая часть сухожилия, которая прижата к костной поверхности, имеет высокое содержание PG с высокой долей PG хондроитинсульфата. 7,51 Морфология клеток также изменяется. 51 В области растяжения клетки сильно вытянуты. В области давления они округлые и похожи на фиброзно-хрящевые клетки. Важно отметить, что снятие сжимающих сил путем перемещения сухожилия приводит к быстрому (в течение 2 недель) ремоделированию и потере PG хондроитинсульфата из области, несущей давление.При приложении напряжения общее содержание PG снижается, но с увеличением доли дерматансульфата PG. Возвращение сухожилия в исходное положение приводит к медленному (месяцы) увеличению содержания PG. 7
Совсем недавно было показано, что латеральное сжатие сухожилий плода приводит к заметным изменениям в специфических PGs и на уровне гена. 52 Рибонуклеиновые кислоты аггрекана и бигликана (мРНК) были увеличены без изменения мРНК декорина или коллагена типа I.Более того, эти изменения, по-видимому, вызваны повышенным синтезом определенного фактора роста (т. Е. Трансформирующего фактора роста бета), который, как известно, является мощным стимулятором синтеза аггрекана и бигликана, но не декорина. 52
52 Рибонуклеиновые кислоты аггрекана и бигликана (мРНК) были увеличены без изменения мРНК декорина или коллагена типа I.Более того, эти изменения, по-видимому, вызваны повышенным синтезом определенного фактора роста (т. Е. Трансформирующего фактора роста бета), который, как известно, является мощным стимулятором синтеза аггрекана и бигликана, но не декорина. 52
Гликопротеины: стабилизаторы и линкеры внеклеточного матрикса
Гликопротеины составляют небольшую, но важную долю от общих компонентов матрикса. Это растворимые, многодоменные, многофункциональные макромолекулы.Хотя они не имеют заметных механических функций, они являются неотъемлемой частью стабилизации окружающей матрицы и соединения матрицы с ячейкой. 53 Им приписывают регуляцию многих функций, включая изменение формы клеток, повышение подвижности клеток и стимуляцию пролиферации и дифференцировки клеток. 53 К числу наиболее охарактеризованных гликопротеинов относятся фибронектин, тенасцин, ламинин, связывающий белок, тромбоспондин, остеопонтин и фибромодулин.![]() Фибронектин широко распространен в ECM большинства CT и играет роль в прикреплении клеток к компонентам матрикса, например, через рецепторы интегрина; тенасцин, также участвующий в модулировании прикрепления клеток, широко распространен в эмбриональных тканях и в некоторых тканях взрослого человека, включая мышечно-сухожильное соединение; а ламинин вносит вклад в структуру базальной мембраны. 53–57 Связующий белок, как обсуждалось выше, необходим для стабилизации агрегатов PG в матриксе хряща, фибромодулин взаимодействует с различными компонентами матрикса и контролирует образование фибрилл коллагена, остеопонтин связывает кальций и способствует кальцификации тканей, а тромбоспондин играет роль в прикрепление клетки. 34,53
Фибронектин широко распространен в ECM большинства CT и играет роль в прикреплении клеток к компонентам матрикса, например, через рецепторы интегрина; тенасцин, также участвующий в модулировании прикрепления клеток, широко распространен в эмбриональных тканях и в некоторых тканях взрослого человека, включая мышечно-сухожильное соединение; а ламинин вносит вклад в структуру базальной мембраны. 53–57 Связующий белок, как обсуждалось выше, необходим для стабилизации агрегатов PG в матриксе хряща, фибромодулин взаимодействует с различными компонентами матрикса и контролирует образование фибрилл коллагена, остеопонтин связывает кальций и способствует кальцификации тканей, а тромбоспондин играет роль в прикрепление клетки. 34,53
Изменения в матрице при заболеваниях и травмах соединительной ткани
В нормальных физиологических условиях поддержание волокон, PG и гликопротеинов строго регулируется и контролируется посредством баланса между синтезом и деградацией. Этот баланс поддерживается в основном стимулирующими цитокинами и факторами роста в дополнение к разрушающим матриксные металлопротеиназы (ММП) и тканевым ингибиторам металлопротеиназ (ТИМП). 58 Синтез и секреция MMP и TIMP аналогичным образом модулируется сложной сетью сигнальных факторов, цитокинов, факторов роста и гормонов. 58
Этот баланс поддерживается в основном стимулирующими цитокинами и факторами роста в дополнение к разрушающим матриксные металлопротеиназы (ММП) и тканевым ингибиторам металлопротеиназ (ТИМП). 58 Синтез и секреция MMP и TIMP аналогичным образом модулируется сложной сетью сигнальных факторов, цитокинов, факторов роста и гормонов. 58
Изменение баланса между синтезом и деградацией влияет на архитектуру нормальной ткани, нарушает функцию органов и изменяет механические свойства тканей. Как общее наблюдение, чистая деградация компонентов матрикса происходит при остеоартрите, ревматоидном артрите, эмфиземе легких и остеопорозе.Чистое увеличение синтеза по сравнению с деградацией приводит к накоплению ЕСМ в фиброзных состояниях, таких как интерстициальный фиброз легких, фиброз печени и склеродермии.
Травма КТ также изменяет функцию. Частичный или полный разрыв КТ из-за чрезмерной растягивающей нагрузки обычно происходит в связках и сухожилиях, а также в мышечно-сухожильных соединениях. Как правило, потеря растягивающей нагрузки или сжимающей нагрузки в случае суставного хряща в суставе 48 приводит к быстрому разрушению тканей. 59 Ремонт и реконструкция этих структур обычно происходит медленно, занимает много месяцев, но в целом следует предсказуемой схеме. 26,59 На начальных этапах заживления участки разрыва перекрываются вновь синтезированным коллагеном III типа, но по мере процесса ремоделирования преобладает все большее количество коллагена I типа, обеспечивающее большую прочность. 20
Как правило, потеря растягивающей нагрузки или сжимающей нагрузки в случае суставного хряща в суставе 48 приводит к быстрому разрушению тканей. 59 Ремонт и реконструкция этих структур обычно происходит медленно, занимает много месяцев, но в целом следует предсказуемой схеме. 26,59 На начальных этапах заживления участки разрыва перекрываются вновь синтезированным коллагеном III типа, но по мере процесса ремоделирования преобладает все большее количество коллагена I типа, обеспечивающее большую прочность. 20
Физические упражнения также оказывают благотворное влияние на прочность здоровых сухожилий и связок, хотя результаты несколько неоднозначны.Это может быть связано с тем, что нормальные сухожилия и связки находятся в оптимальном состоянии. 60
Считается, что напряжение, оказываемое на раны, стимулирует синтез коллагена и усиливает процесс восстановления, заставляя фибриллы коллагена выравниваться параллельно направлению силы раньше, чем для ран, которые не подвергаются натяжению. 18 Степень напряжения, оказываемого на заживающие кожные раны, однако, более проблематична, поскольку длительное напряжение приводит к гипертрофическому рубцеванию, когда избыток сульфатированных PG вызывает утолщение дермы. 61,62
18 Степень напряжения, оказываемого на заживающие кожные раны, однако, более проблематична, поскольку длительное напряжение приводит к гипертрофическому рубцеванию, когда избыток сульфатированных PG вызывает утолщение дермы. 61,62
Резюме
За последние два десятилетия понимание структуры и функций ТТ значительно расширилось. Теперь ясно, что клетки различных CT синтезируют множество компонентов ECM, которые действуют не только для поддержки определенных биомеханических и функциональных свойств тканей, но также для регулирования множества клеточных функций. Это важно для физиотерапевта, и, как обсуждалось выше, КТ реагируют на изменения в механической среде, как естественные, так и применяемые.
Относительные пропорции коллагенов и PG в значительной степени определяют механические свойства CT. Связь между коллагенами, образующими фибриллы, и концентрацией PG является обратной. Соединительные ткани, предназначенные для противодействия высоким силам растяжения, имеют высокое содержание коллагена и низкое общее содержание PG (в основном PGs дерматансульфата), тогда как CT, подверженные сжимающим силам, имеют большее содержание PG (в основном PGs хондроитинсульфата). Гиалуронан выполняет несколько функций и не только обеспечивает гидратацию тканей и облегчает скольжение и скольжение, но также является неотъемлемым компонентом крупных агрегатов PG в тканях, сопротивляющихся давлению.Гликопротеины меньшего размера помогают стабилизировать и связывать коллагены и PG с поверхностью клетки. Результатом является сложная взаимодействующая сеть матричных молекул 5,10,53 (Рис. 7), которая определяет как механические свойства, так и метаболические реакции тканей.
Гиалуронан выполняет несколько функций и не только обеспечивает гидратацию тканей и облегчает скольжение и скольжение, но также является неотъемлемым компонентом крупных агрегатов PG в тканях, сопротивляющихся давлению.Гликопротеины меньшего размера помогают стабилизировать и связывать коллагены и PG с поверхностью клетки. Результатом является сложная взаимодействующая сеть матричных молекул 5,10,53 (Рис. 7), которая определяет как механические свойства, так и метаболические реакции тканей.
Рисунок 7.
Представление типичных компонентов внеклеточного матрикса и их взаимодействия друг с другом и с рецепторами на поверхности клетки. Компоненты нарисованы не в масштабе.
Рисунок 7.
Представление типичных компонентов внеклеточного матрикса и их взаимодействия друг с другом и с рецепторами на поверхности клетки. Компоненты нарисованы не в масштабе.
Пациенты с проблемами компьютерной томографии, влияющими на движение, часто проходят обследование и лечение у физиотерапевтов. Знание состава матрикса КТ и его связи с биомеханическими свойствами этих тканей, особенно предсказуемой реакцией на изменение механических сил, дает возможность обеспечить рациональную основу для лечения.Однако сложность взаимодействия между компонентами требует проведения дальнейших исследований для более точного определения влияния лечения на структуру и функцию КТ.
Знание состава матрикса КТ и его связи с биомеханическими свойствами этих тканей, особенно предсказуемой реакцией на изменение механических сил, дает возможность обеспечить рациональную основу для лечения.Однако сложность взаимодействия между компонентами требует проведения дальнейших исследований для более точного определения влияния лечения на структуру и функцию КТ.
Благодарность
Мы благодарим г-на Артура Эллиса, отделение анатомии с радиологией Медицинской школы Оклендского университета за помощь в подготовке рисунков.
Список литературы
1Компер
WD
, изд.Внеклеточный матрикс, том 1: функция тканей
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
. 2Компер
WD
, изд.
Внеклеточный матрикс, Том 2: Молекулярные компоненты и взаимодействия
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
. 3Харкнесс
RD
.Механические свойства соединительной ткани в зависимости от функции
. В:Parry
DAD
,Creamer
LK
, ред.Волокнистые белки: научные, промышленные и медицинские аспекты
.Лондон, Англия
:Academic Press
;1980
:207
—230
,4Jozsa
л
,Каннус
P
,Балинт
JB
,Reffy
A
.Трехмерная ультраструктура сухожилий человека
.Acta Anat (Базель)
.1991
;142
:306
—312
,5Heinegard
D
,Олдберг
А
.
Гликозилированные матричные белки
. В:Royce
PM
,Steinmann
B
, ред.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты
.Нью-Йорк, Нью-Йорк
:Wiley-Liss
;1993
:189
—209
,6Hardingham
TE
,Fosang
AJ
.Протеогликаны: множество форм и множество функций
.FASEB J
.1992
;6
:861
—870
,7Флинт
MH
,Gillard
GC
,Merrilees
MJ
.Влияние местных факторов окружающей среды на организацию соединительной ткани и синтез гликоаминогликанов
. В:Parry
DAD
,Creamer
LK
, ред.Волокнистые белки: научные, промышленные и медицинские аспекты
.
Лондон, Англия
:Academic Press
;1980
:107
—119
,8Фрейзер
JRE
,Laurent
TC
.Гиалуронан
. В:Comper
WD
, изд.Внеклеточный матрикс, том 1: функция тканей
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
,9Бейтман
JF
,Lamande
SR
,Ramshaw
JAM
.Суперсемейство коллагена
. В:Comper
WD
, изд.Внеклеточный матрикс, Том 2: Молекулярные компоненты и взаимодействия
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
:22
—67
.10Кильти
CM
,Hopkinson
I
,Grant
ME
.
Коллаген: семейство коллагенов, структура, сборка и организация внеклеточного матикса
.В:Royce
PM
,Steinmann
BS
, ред.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты
.Нью-Йорк, Нью-Йорк
:Wiley-Liss
;1993
:103
—147
.11Линзенмайер
TF
.Коллаген
. В:Hay
ED
, ed.Клеточная биология внеклеточного матрикса
.Нью-Йорк, Нью-Йорк
:Plenum Press
;1991
:7
—44
.12Байрес
PH
.Несовершенный остеогенез
. В:Royce
PM
,Steinmann
BS
, ред.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты
.
Нью-Йорк, Нью-Йорк
:Wiley-Liss
;1993
:317
—350
,13Орян
А
.Роль коллагена в заживлении ран мягких соединительных тканей
.Протокол трансплантологии
.1995
;27
:2759
—2761
.14Burgeson
РЭ
,Нимни
ME
.Типы коллагена: молекулярная структура и распределение в тканях
.Клин Ортоп
.1992
;282
:250
—272
.15Майн
R
.Коллагеновые белки сосудов
.Артериосклероз
.1986
;6
:585
—593
.16Кларк
РАФ
.
Восстановление кожной ткани, I: основные биологические соображения
.J Am Acad Dermatol
.1985
;13
:701
—725
,17Флинт
м
.Роль мукополисахаридов в заживлении и ремоделировании донорских участков расщепленной кожи
.В:Hueston
JT
, ed.Труды Пятого Международного Конгресса пластической и реконструктивной хирургии; 22–26 февраля 1971 г .; Мельбурн, Виктория, Австралия
. Сидней, Новый Южный Уэльс, Австралия: Баттервортс;1971
:730
—740
,18Флинт
MH
.Биология соединительной ткани
.В:McFarlane
RM
,McCrouther
DA
,Flint
MH
, ред.Болезнь Дюпюитрена
.Эдинбург, Шотландия
:Черчилль Ливингстон
;1990
:13
—24
,19Фогель
кг
,Кооб
ТДж
.
Конструктивная специализация арматуры на сжатие
.Int Rev Cytol
.1989
;115
:267
—293
,20Лю
SH
,Ян
R-S
,аль-Шейх
R
,переулок
JM
.Коллаген в заживлении сухожилий, связок и костей: текущий обзор
.Клин Ортоп
.1995
;318
:265
—278
.21Роббинс
JR
,Vogel
KG
.Региональная экспрессия мРНК протеогликанов и коллагена в сухожилиях
.евро J Cell Biol
.1994
;64
:264
—270
,22Городской
JPG
,Робертс
S
.Межпозвоночный диск
. В:Comper
WD
, изд.
Внеклеточный матрикс, том 1: функция тканей
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
:203
—233
,23Меахим
G
,Stockwell
RA
.Матрица
. В:Freeman
MAR
, изд.Взрослый суставной хрящ
. 2-е изд.Лондон, Англия
:Pitman Medical
;1979
:1
—68
,24Пул
CA
.Строение и функция матриксов суставного хряща
. В:Woessner
JF
,Howell
DS
, ред.Деградация суставного хряща: основные и клинические аспекты
.Нью-Йорк, Нью-Йорк
:Марсель Деккер Инк
;1993
:1
—35
,25Мичем
RP
,Heuser
JE
.
Эластичное волокно
. В:Hay
ED
, ed.Клеточная биология внеклеточного матрикса
.Нью-Йорк, Нью-Йорк
:Plenum Press
;1991
:79
—109
.26Розенблум
Дж
.Эластин
. В:Royce
PM
,Steinmann
BS
, ред.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты
.Нью-Йорк, Нью-Йорк
:Wiley-Liss
;1993
:167
—188
,27Чедвик
DJ
,Goode
JA
, ред.Симпозиум Фонда Ciba: Молекулярная биология и патология эластичных тканей
.Нью-Йорк, Нью-Йорк
:John Wiley & Sons Inc
;1995
:192
,28Камеры
RC
,Laurent
GJ
.
Легкое
. В:Comper
WD
, изд.Внеклеточный матрикс, том 1: функция тканей
.Амстердам, Нидерланды: Harwood Academic Publishers;1996
:378
—409
,29Сандберг
фунтов
,Soskel
NT
,Leslie
JG
.Структура эластина, биосинтез и связь с болезненными состояниями
.N Engl J Med
.1981
;304
:566
—579
.30Клири
EG
.Кожа
. В:Comper
WD
, изд.Внеклеточный матрикс, том 1: функция тканей
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
:77
—109
.31Уильямс
PL
, изд.Анатомия Грея
. 38-е изд.
38-е изд.Нью-Йорк, Нью-Йорк
:Черчилль Ливингстон Инк.
;1995
.32Бернштейн
EF
,Chen
YQ
,Tamai
K
и др. .Повышенная экспрессия генов эластина и фибриллина в коже с хроническим фотоповреждением
.Дж Инвест Дерматол
.1994
;103
:182
—186
.33Пирс
RA
,Мариани
TJ
,Senior
RM
.Эластин в развитии и заболеваниях легких
. В:Chadwick
DJ
,Goode
JA
, ред.Симпозиум Фонда Ciba: Молекулярная биология и патология эластичных тканей
.Нью-Йорк, Нью-Йорк
:John Wiley & Sons Inc
;1995
:192
,199
—212
.34Heinegard
D
,Hascall
VC
.
Агрегация протеогликанов хряща, III: характеристики белков, выделенных из агрегатов, перевариваемых трипсином
.Дж. Биол. Хим.
.1974
;249
:4250
—4256
.35Нордин
м
,Франкель
VH
.Основные Биомеханика костно-мышечной системы
. 2-е изд.Лондон, Англия
:Lea & Febiger
;1989
:31
—57
,36Уайт
TN
,Heinegard
DK
,Hascall
VC
.Протеогликаны: структура и функции
. В:Hay
ED
, ed.Клеточная биология внеклеточного матрикса
.Нью-Йорк, Нью-Йорк
:Plenum Press
;1991
:45
—78
0,37Рэтклифф
А
,Косилка
VC
.
Суставной хрящ
. В:Comper
WD
, изд.Внеклеточный матрикс, том 1: функция тканей
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
:234
—306
.38Ямагата
м
,Кимата
К
.Подавление фенотипа адгезии злокачественных клеток к субстрату путем ингибирования продукции антиадгезионного протеогликана PG-M / версикана
.J Cell Sci
.1994
;107
:2581
—2590
.39Кочекпур
S
,Pilkington
GJ
,Merzak
A
.Взаимодействие гиалуроновой кислоты и CD44H индуцирует отрыв клеток и стимулирует миграцию и инвазию клеток глиомы человека in vitro
.Инт Дж. Рак
.1995
;63
:450
—454
,40Бьянко
-П
,Riminucci
M
,Fisher
LW
.
Бигликан и декорин в интактных развивающихся тканях: подход in situ к их роли в развитии, морфогенезе и организации тканей
.В:Scott
JE
, ed.Дерматансульфатные протеогликаны: химия, биология, химическая патология
.Лондон, Англия
:Portland Press Ltd
;1993
:193
—205
.41Hardingham
TE
,Венн
G
.Хондроитинсульфат / дерматансульфат протеогликаны из хряща: аггрекан, декорин и бигликан
.В:Scott
JE
, ed.Дерматансульфатные протеогликаны: химия, биология, химическая патология
.Лондон, Англия
:Portland Press Ltd
;1993
:207
—217
.42Галлахер
JT
.Гепарансульфатные протеогликаны: контроль роста клеток
. В:
В:Comper
WD
, изд.Внеклеточный матрикс, Том 2: Молекулярные компоненты и взаимодействия
. Амстердам, Нидерланды: Harwood Academic Publishers;1996
:230
—245
.43Fosang
AJ
,Hardingham
TE
.Матричные протеогликаны
. В:Comper
WD
, изд.Внеклеточный матрикс, Том 2: Молекулярные компоненты и взаимодействия
.Амстердам, Нидерланды: Harwood Academic Publishers;1996
:200
—229
.44Иоццо
RV
,Cohen
IR
,Grassel
S
,Murdoch
AD
.Биология перлекана: многогранный гепарансульфатный протеогликан базальных мембран и перицеллюлярных матриц
.Biochem J
.1994
;302
:625
—639
,45Лоран
ТК
,Fraser
JRE
.
Гиалуронан
.FASEB J
.1992
;6
:2397
—2404
, 46Страчан
RK
,Smith
P
,Gardner
DL
.Гиалуронат в ревматологии и ортопедии: есть ли роль
?Энн Рум Дис
.1990
;49
:949
—952
, 47Солтер
РБ
,Simmonds
DF
,Malcolm
BW
и др. .Биологический эффект непрерывного пассивного движения на заживление полнослойных дефектов суставного хряща: экспериментальное исследование на кролике
.J Bone Joint Surg Am
.1980
;62
:1232
—1251
.48Хоулбрук
К
,Vause
K
,Merrilees
MJ
.
Влияние движения и веса на содержание гликозаминогликанов в суставном хряще барана
.Австралийский журнал физиотерапии
.1990
;36
:88
—91
.49Бертон-Вурстер
N
,Todhunter
RJ
,Lust
G
.Модели остеоартроза на животных
. В:Woessner
JF
,Howell
DS
, ред.Дегенерация суставного хряща: основные и клинические аспекты
.Нью-Йорк, Нью-Йорк
:Марсель Деккер Инк
;1993
:347
—360
.50Джонстон
В
,Bayliss
MT
.Большие протеогликаны межпозвоночного диска человека: изменения их биосинтеза и структуры с возрастом, топографией и патологией
.Позвоночник
.1995
;20
:674
—684
. 51
51Меррилес
МДж
,Флинт
MH
.Ультраструктурное исследование зон напряжения и давления в сухожилии сгибателя кролика
.Ам Дж. Анат
.1980
;157
:87
—106
.52Роббинс
JR
,Evanko
SP
,Vogel
KG
.Механическая нагрузка и TGF-бета регулируют синтез протеогликанов в сухожилиях
.Arch Biochem Biophys
.1997
;342
:203
—211
.53от Марка
К
,Гудман
S
.Адгезивные гликопротеины
. В:Royce
PM
,Steinmann
B
, ред.Соединительная ткань и ее наследственные заболевания: молекулярные, генетические и медицинские аспекты
.
Нью-Йорк, Нью-Йорк
:Wiley-Liss
;1993
:211
—236
.54Мартин
ГР
,Timpl
R
.Ламинин и другие компоненты базальной мембраны
.Annu Rev Cell Biol
.1987
;3
:57
—85
.55Паулссон
м
.Белки базальной мембраны: структура, сборка и клеточные взаимодействия
.Crit Rev Biochem Mol Biol
.1992
;27
:93
—127
.56Мудрец
EH
,Борштейн
П
.Внеклеточные белки, которые модулируют взаимодействия клетки с матрицей: SPARC, тенасцин и тромбоспондин
.Дж. Биол. Хим.
.1991
;266
:14831
—14834
. 57
57Ямада
км
.Фибронектин и другие гликопротеины, взаимодействующие с клетками
. В:Hay
ED
, ed.Клеточная биология внеклеточного матрикса
. 2-е изд.Нью-Йорк, Нью-Йорк
:Plenum Press
;1991
:111
—146
.58Александр
CM
,Werb
Z
.Деградация внеклеточного матрикса
. В:Hay
ED
, ed.Клеточная биология внеклеточного матрикса
.2-е изд.Нью-Йорк, Нью-Йорк
:Plenum Press
;1991
:255
—302
.59Вийдик
А
.Строение и функция нормальных и заживающих сухожилий и связок
. В:Mow
VC
,Ratcliffe
A
,Woo
SL-Y
, ред.
Биомеханика диатродиальных суставов, Том 1
.Нью-Йорк, Нью-Йорк
:Springer-Verlag New York Inc
;1990
:3
—38
.60Вийдик
А
.Адаптивность соединительных тканей
. В:Салтин
Б
, изд.Биохимия упражнений: метаболическая регуляция и ее практическое значение
.Шампейн, Иллинойс
:Human Kinetics Publishers Inc
;1986
:545
—546
.61Гиллард
GC
,Reilly
HC
,Bell-Booth
PG
,Flint
MH
.Сравнение гликозаминогликанов дермы человека, несущего и не несущего вес
.Дж Инвест Дерматол
.1977
;69
:257
—261
,62Кишер
CW
,Шетлар
MR
.
Коллаген и мукополисахариды в гипертрофическом рубце
.Connect Tissue Res
.1974
;2
:205
—213
.© 1999 Американская ассоциация физиотерапии
Инструктивный внеклеточный матрикс легкого: основной состав и изменения при хроническом заболевании легких
Часть A: легочный ECM
Эволюция сложных тканей у высших организмов сопровождается увеличением разнообразия белков и структурной организации в ECM [ 1], а также расширение разнообразия рецепторов ЕСМ на клетках.Как и во всех других системах органов, легочный ECM состоит из двух основных структурных типов: 1) базальные мембраны, которые представляют собой тонкие слои гликопротеинов, которые покрывают базальную сторону эпителия и эндотелия и окружают мышечные, жировые и периферические нервные клетки; и 2) интерстициальные матрицы, которые образуют рыхлую и похожую на фибриллы сетку, которая связывает структурные типы клеток в тканях, и тем самым поддерживает трехмерную (3D) когезию и биомеханические характеристики легких [2]. Как базальные мембраны, так и интерстициальные матрицы образуют тканеспецифические «ниши», которые влияют на стволовость и дифференцировку популяций клеток-предшественников / стволовых клеток, а также на правильную функцию дифференцированных типов клеток, специфичных для ткани / компартмента.
Как базальные мембраны, так и интерстициальные матрицы образуют тканеспецифические «ниши», которые влияют на стволовость и дифференцировку популяций клеток-предшественников / стволовых клеток, а также на правильную функцию дифференцированных типов клеток, специфичных для ткани / компартмента.
Раскрытие матрисомы
На основании биоинформатического анализа доступного генома млекопитающих, число основных структурных компонентов всего ЕСМ млекопитающих, по прогнозам, включает ~ 300 белков (основная матрисома) [3, 4].Кроме того, ЕСМ связывается и служит резервуаром для большого количества секретируемых белков, таких как факторы роста, ферменты, модифицирующие ЕСМ, или другие связанные с ЕСМ белки, которые не вносят вклад в структуру ЕСМ, но влияют на его функцию как обучающая «ниша» (белки, ассоциированные с матрисомой). Из-за их сложных биохимических свойств (нерастворимость, высокая молекулярная масса и высокая степень сшивки белков) детальный анализ белков ЕСМ был очень сложным [5]; однако недавний прогресс в области оборудования для масс-спектрометрии (МС) и алгоритмов количественной оценки впервые позволил провести всесторонний анализ протеомов ЕСМ из различных тканей [6–13]. Количественная оценка белков без метки с помощью МС не только позволяет относительное сравнение белков в разных образцах и экспериментальных условиях, но также позволяет оценить абсолютные количества [14]. Используя этот подход, мы проанализировали наш недавно опубликованный набор протеомных данных протеома легких мышей [12] и оценили относительное содержание белков коровой матрисомы, предоставив подробный профиль экспрессии ECM в легких здоровых мышей (рис. 1).
Количественная оценка белков без метки с помощью МС не только позволяет относительное сравнение белков в разных образцах и экспериментальных условиях, но также позволяет оценить абсолютные количества [14]. Используя этот подход, мы проанализировали наш недавно опубликованный набор протеомных данных протеома легких мышей [12] и оценили относительное содержание белков коровой матрисомы, предоставив подробный профиль экспрессии ECM в легких здоровых мышей (рис. 1).
Протеом внеклеточного матрикса (ЕСМ) взрослого здорового легкого мыши.a) Мы использовали наш недавно опубликованный набор протеомных данных протеомов легких мышей для расчета относительной массовой доли белка указанных категорий генов. Интенсивности МС белков в пределах изображенных категорий генов выражали в долях на миллион от общей интенсивности МС всех белков. б – г) Для определения относительного числа копий белков ЕСМ в протеоме легких интенсивность МС нормализовали к теоретическому количеству триптических пептидов (нормализация размера белка; iBAQ). Мы использовали эту оценку числа копий белка для ранжирования коллагенов (b), протеогликанов (c) и гликопротеинов (d) по их количеству. МС: масс-спектрометрия; iBAQ: абсолютное количественное определение на основе интенсивности.
Мы использовали эту оценку числа копий белка для ранжирования коллагенов (b), протеогликанов (c) и гликопротеинов (d) по их количеству. МС: масс-спектрометрия; iBAQ: абсолютное количественное определение на основе интенсивности.
Состав ECM
Коллагены составляют основную часть протеина в легких [15], и они сильно изменяются при многих заболеваниях легких (рисунок 2). Фибриллярные коллагены (типы I, II, III, V и XI), которые имеют большую прочность на разрыв, но низкую эластичность, вносят вклад в всеобъемлющую архитектуру легкого [16, 17], тогда как большие эластичные волокна, которые характеризуются низкой прочность на разрыв и высокая эластичность, обеспечивают легкому необходимую податливость и упругую отдачу.Эластичные волокна состоят из двух различных компонентов: эластин белка ЕСМ находится в его сшитой форме во внутренней сердцевине эластичных волокон, тогда как внешняя периферия эластичных волокон содержит микрофибриллы размером 10-15 нм [18].
РИСУНОК 2 Патологические изменения внутри интерстициального внеклеточного матрикса (ЕСМ) в пораженном легком. а) Обзор легкого и участков образования болезни. б) Здоровый интерстициальный ВКМ поддерживается активностью резидентных фибробластов и представляет собой рыхлую сеть коллагенов, эластина и фибронектина, прикрепленную к базальной мембране слоя эпителиальных клеток.c) При идиопатическом фиброзе легких (IPF) фибробласты трансдифференцируются в миофибробласты с высокой сократимостью, которые откладывают высокие уровни молекул ECM в интерстиции и резко увеличивают жесткость ECM за счет ферментативного ковалентного сшивания коллагена и эластина. г) Признаками патологических изменений внутри ВЦМ при хронической обструктивной болезни легких (ХОБЛ) являются обширное разрушение эластических волокон ферментами, разрушающими ВКМ, высвобождаемыми воспалительными клетками, наряду с повышенным уровнем гиалуронана и тенасцина С и сниженным отложением декорина. .Разрушение слоя эпителиальных клеток приводит к увеличению воздушного пространства (эмфиземе). д) При легочной артериальной гипертензии (ЛАГ) ремоделирование внеклеточного матрикса внутри артериальной стенки характеризуется увеличением эластиновых и коллагеновых волокон, фибронектина и тенасцина С и гиперплазией гладкомышечных клеток.
а) Обзор легкого и участков образования болезни. б) Здоровый интерстициальный ВКМ поддерживается активностью резидентных фибробластов и представляет собой рыхлую сеть коллагенов, эластина и фибронектина, прикрепленную к базальной мембране слоя эпителиальных клеток.c) При идиопатическом фиброзе легких (IPF) фибробласты трансдифференцируются в миофибробласты с высокой сократимостью, которые откладывают высокие уровни молекул ECM в интерстиции и резко увеличивают жесткость ECM за счет ферментативного ковалентного сшивания коллагена и эластина. г) Признаками патологических изменений внутри ВЦМ при хронической обструктивной болезни легких (ХОБЛ) являются обширное разрушение эластических волокон ферментами, разрушающими ВКМ, высвобождаемыми воспалительными клетками, наряду с повышенным уровнем гиалуронана и тенасцина С и сниженным отложением декорина. .Разрушение слоя эпителиальных клеток приводит к увеличению воздушного пространства (эмфиземе). д) При легочной артериальной гипертензии (ЛАГ) ремоделирование внеклеточного матрикса внутри артериальной стенки характеризуется увеличением эластиновых и коллагеновых волокон, фибронектина и тенасцина С и гиперплазией гладкомышечных клеток. е) При астме характерные изменения ВКМ происходят под бронхиальным эпителием и утолщенной базальной мембраной. Кроме того, гладкомышечные клетки подвергаются гиперплазии, и увеличивается отложение коллагенов, фибронектина, гиалуронана и декорина.ж) При раке опухоли на первичной и метастатической сторонах окружены обширной жесткой стромой, которая содержит сильно сшитые коллагены и высокие уровни фибронектина, тенасцина С и гиалуронана. з) Легенда, изображающая молекулы и типы клеток.
е) При астме характерные изменения ВКМ происходят под бронхиальным эпителием и утолщенной базальной мембраной. Кроме того, гладкомышечные клетки подвергаются гиперплазии, и увеличивается отложение коллагенов, фибронектина, гиалуронана и декорина.ж) При раке опухоли на первичной и метастатической сторонах окружены обширной жесткой стромой, которая содержит сильно сшитые коллагены и высокие уровни фибронектина, тенасцина С и гиалуронана. з) Легенда, изображающая молекулы и типы клеток.
Основными структурными компонентами микрофибрилл являются крупные гликопротеины фибриллин-1, -2 и -3 [19]. Кроме того, другие белки, такие как гликопротеины, ассоциированные с микрофибриллами, фибулины, белки, расположенные на границе раздела микрофибрилл эластина (EMILINs) и члены семейства эластин-сшивающих лизилоксидаз (LOX), связаны с микрофибриллами или с самим эластином [18].Интересно, что связанный с микрофибриллами протеин 4 (MFAP4) был самым распространенным гликопротеином, обнаруженным в нашем наборе данных по матрисомам легких здоровых взрослых мышей (рисунок 1) [12]. У людей высокая экспрессия MFAP4 была показана не только для легких, но и для других высокоэластичных тканей, таких как сердце и кишечник [20]. Биологическая функция MFAP4 в значительной степени неизвестна; Хотя он был идентифицирован как сывороточный биомаркер гаптического фиброза, он не может служить биомаркером фиброза легких [21].
У людей высокая экспрессия MFAP4 была показана не только для легких, но и для других высокоэластичных тканей, таких как сердце и кишечник [20]. Биологическая функция MFAP4 в значительной степени неизвестна; Хотя он был идентифицирован как сывороточный биомаркер гаптического фиброза, он не может служить биомаркером фиброза легких [21].
Интерстициальный ECM альвеол состоит из расслабленной сети, в значительной степени основанной на коллагенах I и III типов и эластине как важных коровых белках [22, 23].Трехмерное расположение этой сети переплетенных волокон допускает нелинейное поведение напряжения-деформации (гистерезис и вязкоупругость), которое является характерным свойством мягких соединительных тканей [24]. Во время дыхания рассеяние энергии, вызывающее гистерезис и вязкоупругость в паренхиме легких, обусловлено контактами волокна с волокном в ECM коллаген-эластин, хотя типы сократительных клеток и поверхностно-активное вещество на границе раздела воздух-жидкость также могут способствовать этим эффектам [17]. . В дополнение к своим биомеханическим функциям компоненты эластичных волокон, такие как фибулины и EMILINs, регулируют адгезию клетка-ECM, взаимодействуя с гетеромерными трансмембранными интегриновыми рецепторами [25, 26].В отличие от EMILINs, которые связывают интегрины через их домен gC1q-1, фибулин-5 связывает интегрины через эволюционно консервативную последовательность RGD (аргинин-глицин-аспарагиновая кислота). Этот трипептид-связывающий мотив RGD характерен для других гликопротеинов ВКМ, включая фибронектин, витронектин, остеопонтин, коллагены, тромбоспондины, фибриноген и фактор фон Виллебранда, все из которых опосредуют адгезию клетки-ЕСМ через рецепторы интегрина [27]. Помимо фиброзных коллагенов и гликопротеинов, протеогликаны (PGs), которые состоят из основного белкового компонента, ковалентно связанного с сульфатированными полисахаридами или гликозаминогликанами (GAGs), являются основными составляющими ECM [28].Благодаря высокому содержанию полисахаридов PG являются гидрофильными, что позволяет образовывать гидрогель и способствует вязкоупругости легких.
. В дополнение к своим биомеханическим функциям компоненты эластичных волокон, такие как фибулины и EMILINs, регулируют адгезию клетка-ECM, взаимодействуя с гетеромерными трансмембранными интегриновыми рецепторами [25, 26].В отличие от EMILINs, которые связывают интегрины через их домен gC1q-1, фибулин-5 связывает интегрины через эволюционно консервативную последовательность RGD (аргинин-глицин-аспарагиновая кислота). Этот трипептид-связывающий мотив RGD характерен для других гликопротеинов ВКМ, включая фибронектин, витронектин, остеопонтин, коллагены, тромбоспондины, фибриноген и фактор фон Виллебранда, все из которых опосредуют адгезию клетки-ЕСМ через рецепторы интегрина [27]. Помимо фиброзных коллагенов и гликопротеинов, протеогликаны (PGs), которые состоят из основного белкового компонента, ковалентно связанного с сульфатированными полисахаридами или гликозаминогликанами (GAGs), являются основными составляющими ECM [28].Благодаря высокому содержанию полисахаридов PG являются гидрофильными, что позволяет образовывать гидрогель и способствует вязкоупругости легких. PG содержат составляющие базальной мембраны перлекан и агрин, а также hyalectans versican, aggrecan, нейрокан, бревикан и подкласс протеогликанов, богатых малым лейцином, включая его наиболее выдающиеся представители, декорин, бигликан и люмикан [29]. Декорин, бигликан и люмикан были одними из самых распространенных протеогликанов в нашем наборе данных по матрисомам здоровых легких взрослых мышей (рис. 1) [12]. In vitro , как декорин человека, так и бигликан способны связываться с профибротическим цитокином, трансформирующим фактор роста-β1 (TGF-β1), но in vivo , только декорин, но не бигликан, ингибирует фиброгенный эффект TGF- β1 [30]. Кроме того, сообщается, что декорин взаимодействует с различными металлопротеазами и может действовать как опухолевый супрессор, ослабляя рост, миграцию и ангиогенез опухоли [31].
PG содержат составляющие базальной мембраны перлекан и агрин, а также hyalectans versican, aggrecan, нейрокан, бревикан и подкласс протеогликанов, богатых малым лейцином, включая его наиболее выдающиеся представители, декорин, бигликан и люмикан [29]. Декорин, бигликан и люмикан были одними из самых распространенных протеогликанов в нашем наборе данных по матрисомам здоровых легких взрослых мышей (рис. 1) [12]. In vitro , как декорин человека, так и бигликан способны связываться с профибротическим цитокином, трансформирующим фактор роста-β1 (TGF-β1), но in vivo , только декорин, но не бигликан, ингибирует фиброгенный эффект TGF- β1 [30]. Кроме того, сообщается, что декорин взаимодействует с различными металлопротеазами и может действовать как опухолевый супрессор, ослабляя рост, миграцию и ангиогенез опухоли [31].
Посттрансляционные модификации компонентов ECM
Посттрансляционные модификации (PTM), e.грамм. Ферментативное и химическое сшивание , трансглютаминирование, гликозилирование и гликозилирование, окисление и цитруллинирование, как известно, влияют на структурное и / или функциональное разнообразие белков ЕСМ [32]. Например, ферментативное поперечное сшивание коллагена и эластина, существенный шаг во время их биосинтеза, который в основном осуществляется ферментами семейства лизилоксидаз (LOX, LOXL1-4) и членами семейства трансглутаминаз (TG1-7, FXIII- A), обеспечивает компоненты ECM их характерной прочностью на разрыв [33–35].Кроме того, ферментативное (гликозилирование) или неферментативное (гликозилирование) добавление сахаров к белкам также влияет на биомеханику и функцию ЕСМ. В частности, в настоящее время гликирование считается фактором фиброза, связанного со старением. Этот процесс вызывает образование и накопление конечных продуктов гликирования (AGE). Аберрантные процессы гликирования были связаны с повышенной жесткостью тканей, например. в экспериментальном образовании AGE в сухожилиях, которые, как было показано, уменьшают скольжение волокна при увеличении растяжения волокна [36].Карбамилирование, которое представляет собой неферментативное присоединение мочевины к остаткам изоциановой кислоты в белках, отрицательно влияет на стабильность и конформацию тройных спиралей коллагена I, а также на их расщепление под действием ММП [37].
Например, ферментативное поперечное сшивание коллагена и эластина, существенный шаг во время их биосинтеза, который в основном осуществляется ферментами семейства лизилоксидаз (LOX, LOXL1-4) и членами семейства трансглутаминаз (TG1-7, FXIII- A), обеспечивает компоненты ECM их характерной прочностью на разрыв [33–35].Кроме того, ферментативное (гликозилирование) или неферментативное (гликозилирование) добавление сахаров к белкам также влияет на биомеханику и функцию ЕСМ. В частности, в настоящее время гликирование считается фактором фиброза, связанного со старением. Этот процесс вызывает образование и накопление конечных продуктов гликирования (AGE). Аберрантные процессы гликирования были связаны с повышенной жесткостью тканей, например. в экспериментальном образовании AGE в сухожилиях, которые, как было показано, уменьшают скольжение волокна при увеличении растяжения волокна [36].Карбамилирование, которое представляет собой неферментативное присоединение мочевины к остаткам изоциановой кислоты в белках, отрицательно влияет на стабильность и конформацию тройных спиралей коллагена I, а также на их расщепление под действием ММП [37]. Окисление белков ECM реактивными формами кислорода (ROS) дополнительно модулирует качества ECM, изменяя его продукцию, оборот и модификации, а также оказывая влияние на взаимодействия клетка-ECM [38]. Кроме того, было обнаружено, что сывороточные уровни маркеров окислительного стресса повышены у пациентов с ИЛФ [39] и в конденсатах дыхания пациентов с астмой [40].ECM также может модулироваться цитруллинированием, ферментативной реакцией дезаминирования аргинина, которая влияет на адгезию клеток [41]. Для более полного обзора PTMs в ECM и их роли в заболевании мы отсылаем читателя к этим дополнительным обзорам [32, 42–45]. Взятые вместе, структурные и функциональные свойства легочного ECM могут быть изменены с помощью PTM, которые считаются важным потенциальным фактором развития заболевания легких, как подробно описано в следующих разделах.
Окисление белков ECM реактивными формами кислорода (ROS) дополнительно модулирует качества ECM, изменяя его продукцию, оборот и модификации, а также оказывая влияние на взаимодействия клетка-ECM [38]. Кроме того, было обнаружено, что сывороточные уровни маркеров окислительного стресса повышены у пациентов с ИЛФ [39] и в конденсатах дыхания пациентов с астмой [40].ECM также может модулироваться цитруллинированием, ферментативной реакцией дезаминирования аргинина, которая влияет на адгезию клеток [41]. Для более полного обзора PTMs в ECM и их роли в заболевании мы отсылаем читателя к этим дополнительным обзорам [32, 42–45]. Взятые вместе, структурные и функциональные свойства легочного ECM могут быть изменены с помощью PTM, которые считаются важным потенциальным фактором развития заболевания легких, как подробно описано в следующих разделах.
Биомеханика и перекрестные помехи между клетками и ЕСМ
Все клетки временно или постоянно прикрепляются к той или иной форме ЕСМ через рецепторы клеточной адгезии , наиболее заметно семейство интегринов трансмембранных гетеродимерных рецепторов [46, 47]. Клетки могут использовать интегрины для исследования биохимических и топографических характеристик своего окружения [47, 48]. Сигнальная трансдукция, исходящая от адгезии клетка-ЕСМ, контролирует клеточное поведение, такое как подвижность и распространение, морфология, выживаемость, пролиферация и дифференцировка [1, 22]. Эти сигнальные события зависят от множества белков, которые рекрутируются в кластеры интегринов плазматической мембраны, которые вместе называются «адгезомами» [49]. Недавние протеомные исследования очертили общий белковый состав адгезомы и его динамику под влиянием механических сил [50–55].Когда клетки сталкиваются со своим внеклеточным субстратом, они реагируют на жесткость этого субстрата множеством способов, включая немедленные изменения формы и активности клеток, а также долговременную экспрессию генов и изменения идентичности клеток. Эта механореципрокность генерируется обратными связями между адгезиями клетка-ECM и цитоскелетом, которые настраивают силу сократительных сил на равновесие между приложенной силой и прочностью на разрыв субстрата ECM [47].
Клетки могут использовать интегрины для исследования биохимических и топографических характеристик своего окружения [47, 48]. Сигнальная трансдукция, исходящая от адгезии клетка-ЕСМ, контролирует клеточное поведение, такое как подвижность и распространение, морфология, выживаемость, пролиферация и дифференцировка [1, 22]. Эти сигнальные события зависят от множества белков, которые рекрутируются в кластеры интегринов плазматической мембраны, которые вместе называются «адгезомами» [49]. Недавние протеомные исследования очертили общий белковый состав адгезомы и его динамику под влиянием механических сил [50–55].Когда клетки сталкиваются со своим внеклеточным субстратом, они реагируют на жесткость этого субстрата множеством способов, включая немедленные изменения формы и активности клеток, а также долговременную экспрессию генов и изменения идентичности клеток. Эта механореципрокность генерируется обратными связями между адгезиями клетка-ECM и цитоскелетом, которые настраивают силу сократительных сил на равновесие между приложенной силой и прочностью на разрыв субстрата ECM [47]. В этом процессе изменяется структура и организация цитоскелета, и было показано, что это вызывает долгосрочные изменения экспрессии генов [56].Точная молекулярная природа многих элементов в этих обратных связях в настоящее время неизвестна, и также неясно, в какой степени равновесие механо-чувствительности и механо-реакции различается между типами клеток и как такие различия могут быть запрограммированы. Важно отметить, что хорошо известно, что механо-чувствительные сигнальные пути важны в патофизиологии фиброзных заболеваний и рака, оба из которых обнаруживают динамические изменения в составе ВКМ и механических свойствах во время прогрессирования заболевания [57–61].В частности, патологически повышенное отложение ВКМ, сопровождающееся ковалентным перекрестным связыванием и ремоделированием ВКМ, приводит к резкому увеличению жесткости ВКМ, вызывая, таким образом, механический градиент между патологической и нормальной тканью. Градиенты жесткости внутри ЕСМ диктуют миграционное поведение клеток в процессе, называемом дуротаксисом.
В этом процессе изменяется структура и организация цитоскелета, и было показано, что это вызывает долгосрочные изменения экспрессии генов [56].Точная молекулярная природа многих элементов в этих обратных связях в настоящее время неизвестна, и также неясно, в какой степени равновесие механо-чувствительности и механо-реакции различается между типами клеток и как такие различия могут быть запрограммированы. Важно отметить, что хорошо известно, что механо-чувствительные сигнальные пути важны в патофизиологии фиброзных заболеваний и рака, оба из которых обнаруживают динамические изменения в составе ВКМ и механических свойствах во время прогрессирования заболевания [57–61].В частности, патологически повышенное отложение ВКМ, сопровождающееся ковалентным перекрестным связыванием и ремоделированием ВКМ, приводит к резкому увеличению жесткости ВКМ, вызывая, таким образом, механический градиент между патологической и нормальной тканью. Градиенты жесткости внутри ЕСМ диктуют миграционное поведение клеток в процессе, называемом дуротаксисом. Дуротаксис, по-видимому, является довольно общим явлением, поскольку было показано, что многие типы клеток, включая фибробласты, мезенхимальные стволовые клетки (МСК), миобласты и раковые клетки, перемещаются по градиентам жесткости [62–65].Кроме того, жесткость ВКМ влияет на распространение, сократимость и дифференцировку фибробластов [66, 67]. При выращивании на мягких матрицах фибробласты и многие другие клетки обычно демонстрируют низкие сократительные силы вместе с уменьшенным распространением и пролиферацией [68, 69]. Жесткость ВКМ также влияет на дифференцировку МСК, так как остеогенные и адипогенные клоны появляются на жестких и мягких поверхностях соответственно [66]. Первичные культуры клеток альвеолярного эпителия типа II (ATII), которые, как считается, обладают потенциалом стволовых клеток и способны к долгосрочному самообновлению во взрослом легком, изменяют свою морфологию и функциональные характеристики (синтез и секреция сурфактанта) в зависимости от субстрат ЕСМ, используемый в культуре [28].
Дуротаксис, по-видимому, является довольно общим явлением, поскольку было показано, что многие типы клеток, включая фибробласты, мезенхимальные стволовые клетки (МСК), миобласты и раковые клетки, перемещаются по градиентам жесткости [62–65].Кроме того, жесткость ВКМ влияет на распространение, сократимость и дифференцировку фибробластов [66, 67]. При выращивании на мягких матрицах фибробласты и многие другие клетки обычно демонстрируют низкие сократительные силы вместе с уменьшенным распространением и пролиферацией [68, 69]. Жесткость ВКМ также влияет на дифференцировку МСК, так как остеогенные и адипогенные клоны появляются на жестких и мягких поверхностях соответственно [66]. Первичные культуры клеток альвеолярного эпителия типа II (ATII), которые, как считается, обладают потенциалом стволовых клеток и способны к долгосрочному самообновлению во взрослом легком, изменяют свою морфологию и функциональные характеристики (синтез и секреция сурфактанта) в зависимости от субстрат ЕСМ, используемый в культуре [28]. В исследовании in vitro первичные альвеолярные макрофаги человека, которые опосредуют фиброз легких, показали усиление фагоцитоза и изменения транскрипции и фенотипа при культивировании на жестком ECM [70]. Более того, для монослоя эндотелиальных клеток было продемонстрировано, что их культивирование на более жестком ECM оказывает негативное влияние на целостность монослоя, таким образом подтверждая важность проницаемости барьера в отношении трансмиграции лейкоцитов [71].
В исследовании in vitro первичные альвеолярные макрофаги человека, которые опосредуют фиброз легких, показали усиление фагоцитоза и изменения транскрипции и фенотипа при культивировании на жестком ECM [70]. Более того, для монослоя эндотелиальных клеток было продемонстрировано, что их культивирование на более жестком ECM оказывает негативное влияние на целостность монослоя, таким образом подтверждая важность проницаемости барьера в отношении трансмиграции лейкоцитов [71].
Резервная функция ЕСМ
ЕСМ служит резервуаром для ряда факторов роста и цитокинов, которые имеют решающее значение для дифференцировки и пролиферации клеток [4, 22, 72].Связь факторов, таких как фактор роста фибробластов (FGF), фактор роста гепатоцитов, а также латентный и активный TGF-β1 (полный список мы отсылаем читателя к ранее опубликованной таблице [72]), с ECM имеет некоторые последствия: ECM -связанные факторы 1) могут быть латентными, замаскированными или иметь иную активность по сравнению с их растворимой формой, 2) могут образовывать иммобилизованные градиенты, имеющие решающее значение для миграции клеток, 3) могут, как отпечатки прошлой клеточной активности, иметь функцию памяти для инструктирования клеток поведение, 4) облегчают клеточную адгезию и рост клеток, и 5) как запасенные факторы могут быстро активироваться протеолитическим высвобождением и генерировать локальные сигналы, которые не зависят от медленных процессов, таких как экспрессия генов [72, 73]. Деградация ECM является ключевым событием в ремоделировании ткани, и в этом процессе цинк-зависимые протеиназы (метцинцины) играют решающую роль.
Деградация ECM является ключевым событием в ремоделировании ткани, и в этом процессе цинк-зависимые протеиназы (метцинцины) играют решающую роль.
Ферменты, разлагающие ЕСМ
Это суперсемейство металлопротеиназ включает матриксные металлопротеиназы (ММП) и адамализины. ММП представляют собой семейство из 25 цинк-зависимых эндопептидаз. Эти ферменты способны расщеплять все компоненты ВКМ [74] и базальные мембраны [75]. ММП секретируются в высоко согласованном процессе вместе с их ингибиторами, тканевыми ингибиторами металлопротеиназ (ТИМП) [76].Адамализины включают дезинтегрин и металлопротеиназы (ADAM) и ADAM с мотивом тромбоспондина (ADAMTS). Благодаря способности ADAM разрушать цитокины, факторы роста и лиганд FAS, им приписывают потенциальное клиническое применение при фиброзе, раке, воспалении и нейродегенерации [77]. При фиброзных заболеваниях легких продуцирование и секреция ММП и ТИМП приписывается макрофагам [78], фиброцитам, эндотелиальным клеткам и фибробластам [79], а также сильная экспрессия ММП, особенно ММП-1 и ММП-7. наблюдается в бронхиолярных и альвеолярных эпителиальных клетках [80].Для более подробного обсуждения молекулярных игроков в деградации и ремоделировании ECM, читатель может обратиться к превосходному обзору Lu et al. [81].
наблюдается в бронхиолярных и альвеолярных эпителиальных клетках [80].Для более подробного обсуждения молекулярных игроков в деградации и ремоделировании ECM, читатель может обратиться к превосходному обзору Lu et al. [81].
Часть B: Процессы ремоделирования ЭКМ при хронических заболеваниях легких
IPF
Патогенез и ремоделирование тканей
Хотя этиология IPF остается в значительной степени неизвестной, IPF затрагивает примерно пять миллионов человек во всем мире. До недавнего времени трансплантация легких была единственным эффективным методом лечения. Недавно было показано, что два препарата, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), пирфенидон и нинтеданиб, которые оказывают плейотропное действие на клетки, включая ингибирование продукции ECM, замедляют скорость снижения функции легких [82, 83].При IPF повторяющееся повреждение легких и последующие механизмы восстановления приводят к продолжающемуся разрушению эластичной паренхиматозной ткани легкого, которая постоянно замещается жесткой рубцовой тканью, состоящей из крупных и конденсированных агрегатов клетки-ВКМ, известных как фибробластные очаги в легочном интерстиции (рис. 2c). . Прогрессивное ремоделирование ткани приводит к тракционным бронхоэктазам, утолщению межлобулярных перегородок и субплевральным сотам, что можно визуализировать с помощью компьютерной аксиальной томографии (CAT) [84]. Все эти микроскопические и макроскопические изменения способствуют прогрессирующей потере газообмена с последующим ухудшением функции легких, одышкой и, наконец, дыхательной недостаточностью, ведущей к смерти [85].
2c). . Прогрессивное ремоделирование ткани приводит к тракционным бронхоэктазам, утолщению межлобулярных перегородок и субплевральным сотам, что можно визуализировать с помощью компьютерной аксиальной томографии (CAT) [84]. Все эти микроскопические и макроскопические изменения способствуют прогрессирующей потере газообмена с последующим ухудшением функции легких, одышкой и, наконец, дыхательной недостаточностью, ведущей к смерти [85].
Миофибробласты
Фибробластные очаги содержат активированные фибробласты и / или миофибробласты с высокой сократимостью, которые в основном характеризуются новой экспрессией α-актина гладких мышц (α-SMA) и его включением в волокна сократительного стресса. Помимо сократительных свойств, миофибробласты производят большое количество молекул ВКМ в ответ на профибротические стимулы, которые, как считается, являются результатом несбалансированных механизмов восстановления альвеолярного и бронхиолярного эпителия после повторяющихся микротравм и воспалительных процессов [86] (рис. 2c).Происхождение миофибробластов в фиброзных очагах все еще остается предметом серьезных дискуссий. В различных исследованиях было показано, что миофибробласты в фиброзном легком происходят из клеток-предшественников костного мозга [87], фиброцитов периферической крови [88, 89], альвеолярных эпителиальных клеток, претерпевающих эпителиально-мезенхимальный переход [90], резидентных фибробластов [ 91] и перициты [92]. Довольно спорно, применяя трассировку клонов, другое исследование, описало еще неустановленную популяцию резидентов стромальных клеток в фиброзных очагах в качестве источника миофибробластов, но исключить перициты и эпителиальные клетки в качестве источников [93].
2c).Происхождение миофибробластов в фиброзных очагах все еще остается предметом серьезных дискуссий. В различных исследованиях было показано, что миофибробласты в фиброзном легком происходят из клеток-предшественников костного мозга [87], фиброцитов периферической крови [88, 89], альвеолярных эпителиальных клеток, претерпевающих эпителиально-мезенхимальный переход [90], резидентных фибробластов [ 91] и перициты [92]. Довольно спорно, применяя трассировку клонов, другое исследование, описало еще неустановленную популяцию резидентов стромальных клеток в фиброзных очагах в качестве источника миофибробластов, но исключить перициты и эпителиальные клетки в качестве источников [93].
Инструктивность
Поскольку миофибробласт считается отличительной чертой IPF, можно предположить, что ECM, продуцируемый миофибробластом, является поучительным компонентом заболевания, который способствует прогрессированию заболевания. Действительно, культивируя фибробласты, происходящие либо из IPF, либо из здоровых контрольных легких на фиброзной или здоровой децеллюляризованной легочной ткани, Parker et al. продемонстрировал, что аберрантное микроокружение ECM в IPF преимущественно управляет изменениями экспрессии генов и белков, а не внутренними клеточными изменениями [94].Процесс децеллюляризации и успешной рецеллюляризации целых органов, в идеале с использованием аутологичных стволовых клеток или клеток-предшественников, был протестирован как потенциальный суррогат в медицине трансплантации легких [95–97]. Даже трупные легкие человека, взятые у людей с хроническими заболеваниями легких, были исследованы на предмет возможного использования в тканевой инженерии ex vivo [98]. Однако в свете текущих данных о том, что децеллюляризованные каркасы ВКМ от пациентов с IPF изменяют транскриптом и трансатом пересеянных фибробластов, остается интригующим открытым вопрос, могут ли такие суррогаты, полученные из патологических тканей легких, вообще использоваться для трансплантации легких.
продемонстрировал, что аберрантное микроокружение ECM в IPF преимущественно управляет изменениями экспрессии генов и белков, а не внутренними клеточными изменениями [94].Процесс децеллюляризации и успешной рецеллюляризации целых органов, в идеале с использованием аутологичных стволовых клеток или клеток-предшественников, был протестирован как потенциальный суррогат в медицине трансплантации легких [95–97]. Даже трупные легкие человека, взятые у людей с хроническими заболеваниями легких, были исследованы на предмет возможного использования в тканевой инженерии ex vivo [98]. Однако в свете текущих данных о том, что децеллюляризованные каркасы ВКМ от пациентов с IPF изменяют транскриптом и трансатом пересеянных фибробластов, остается интригующим открытым вопрос, могут ли такие суррогаты, полученные из патологических тканей легких, вообще использоваться для трансплантации легких.
Механофизиология
Современные концепции в этой области предполагают критические функции конкретных белков ЕСМ в точной настройке сигнальных путей за счет их способности модулировать передачу сигналов факторов роста [99–101] или важные эффекты жесткости тканей на прогрессирование заболевания. Жесткость ECM при фиброзных нарушениях увеличивается за счет ферментативного ковалентного сшивания коллагена и эластина членами семейства LOX и TG [34, 35]. Было показано, что при IPF экспрессия лизилоксидазоподобного 2 (LOXL2) и TG2 повышается в сыворотке и легких, соответственно, у пациентов с IPF [102, 103].Жесткость децеллюляризованной ткани IPF действительно выше, чем обычно, как показывает атомно-силовая микроскопия [13], и, соответственно, активность немышечного миозина-II, который управляет сократимостью клеток, также выше в фиброзных областях пациенты с ИЛФ [57]. Таким образом, активность и выживаемость активированных фибробластов при фиброзных заболеваниях можно в значительной степени контролировать с помощью механических сигналов. Действительно, ингибирование опосредованной миозином-II сократимости клеток с помощью ингибитора Rho-киназы индуцировало апоптоз миофибробластов и улучшало экспериментальный фиброз легких [57].Чумперлин и его коллеги использовали измерения экспериментального фиброза в легких, поврежденных блеомицином, с помощью атомно-силовой микроскопии, чтобы выявить резкое увеличение фиброзных зон с модулем упругости (который измеряет жесткость ткани в Паскалях), превышающим 2 кПа [68].
Жесткость ECM при фиброзных нарушениях увеличивается за счет ферментативного ковалентного сшивания коллагена и эластина членами семейства LOX и TG [34, 35]. Было показано, что при IPF экспрессия лизилоксидазоподобного 2 (LOXL2) и TG2 повышается в сыворотке и легких, соответственно, у пациентов с IPF [102, 103].Жесткость децеллюляризованной ткани IPF действительно выше, чем обычно, как показывает атомно-силовая микроскопия [13], и, соответственно, активность немышечного миозина-II, который управляет сократимостью клеток, также выше в фиброзных областях пациенты с ИЛФ [57]. Таким образом, активность и выживаемость активированных фибробластов при фиброзных заболеваниях можно в значительной степени контролировать с помощью механических сигналов. Действительно, ингибирование опосредованной миозином-II сократимости клеток с помощью ингибитора Rho-киназы индуцировало апоптоз миофибробластов и улучшало экспериментальный фиброз легких [57].Чумперлин и его коллеги использовали измерения экспериментального фиброза в легких, поврежденных блеомицином, с помощью атомно-силовой микроскопии, чтобы выявить резкое увеличение фиброзных зон с модулем упругости (который измеряет жесткость ткани в Паскалях), превышающим 2 кПа [68]. Интересно, что диапазон физиологической жесткости (0,2–2 кПа) поддерживает фибробласты легких в состоянии покоя, тогда как субстраты с более высокой жесткостью (2–35 кПа), наблюдаемые в фиброзных легких, вызывают профиброгенный фенотип с высокой пролиферацией и синтезом ВКМ. ставки [68].Мы показали, что (мио) фибробластам требуется комбинация α5β1-интегрина и гетеродимеров семейства αV-интегрина для эффективного ответа на жесткость богатого фибронектином тканевого микроокружения, которое присутствует в тканевом фиброгенезе [50]. Интересно, что устранение интегринов αV-семейства снижает фиброз в некоторых органах, включая легкие, на экспериментальных моделях мышей с травмой [104], что может указывать на то, что эти интегрины участвуют в механо-чувствительной реакции [50] и / или активации TGF-β. [105].
Интересно, что диапазон физиологической жесткости (0,2–2 кПа) поддерживает фибробласты легких в состоянии покоя, тогда как субстраты с более высокой жесткостью (2–35 кПа), наблюдаемые в фиброзных легких, вызывают профиброгенный фенотип с высокой пролиферацией и синтезом ВКМ. ставки [68].Мы показали, что (мио) фибробластам требуется комбинация α5β1-интегрина и гетеродимеров семейства αV-интегрина для эффективного ответа на жесткость богатого фибронектином тканевого микроокружения, которое присутствует в тканевом фиброгенезе [50]. Интересно, что устранение интегринов αV-семейства снижает фиброз в некоторых органах, включая легкие, на экспериментальных моделях мышей с травмой [104], что может указывать на то, что эти интегрины участвуют в механо-чувствительной реакции [50] и / или активации TGF-β. [105].
Протеомные сигнатуры ECM
Будущие протеомные исследования острых и хронических моделей повреждения легких и последующего фиброза могут позволить идентифицировать компоненты внеклеточной ниши, которые выборочно приводят к патологии в постоянном и прогрессирующем фенотипе рубцевания, как видно на IPF. Мы провели протеомное исследование с временным разрешением на модели мышей с острым повреждением легких блеомицином и, основываясь на наблюдаемой временной кинетике изобилия белков, мы смогли предсказать функции отдельных белков на ранних стадиях восстановления ткани, таких как мобилизация стволовых клеток. или поздние стадии, такие как разрешение фиброза.Неожиданные белки ЕСМ, которые не были изучены в контексте повреждения по сравнению с восстановлением и фиброза, такие как Эмилин-2 и коллаген-XXVIII, были обнаружены в высокой степени через 2 недели после повреждения [12]. Используя комбинацию метки стабильных изотопов, фракционирования растворимости децеллюляризованной легочной ткани и протеомного анализа, Декарис и его коллеги оценили кинетику синтеза и отложения ВКМ на модели блеомицина [106] и обнаружили, что скорость синтеза белка фибриллярных коллагенов (типов I, III и V) резко увеличивались как в растворимой, так и в нерастворимой фракциях во время позднего фиброзного ответа, тогда как небольшие богатые лейцином протеогликаны бигликан и декорин, а также фибронектин были повышены при раннем фиброзном ответе.
Мы провели протеомное исследование с временным разрешением на модели мышей с острым повреждением легких блеомицином и, основываясь на наблюдаемой временной кинетике изобилия белков, мы смогли предсказать функции отдельных белков на ранних стадиях восстановления ткани, таких как мобилизация стволовых клеток. или поздние стадии, такие как разрешение фиброза.Неожиданные белки ЕСМ, которые не были изучены в контексте повреждения по сравнению с восстановлением и фиброза, такие как Эмилин-2 и коллаген-XXVIII, были обнаружены в высокой степени через 2 недели после повреждения [12]. Используя комбинацию метки стабильных изотопов, фракционирования растворимости децеллюляризованной легочной ткани и протеомного анализа, Декарис и его коллеги оценили кинетику синтеза и отложения ВКМ на модели блеомицина [106] и обнаружили, что скорость синтеза белка фибриллярных коллагенов (типов I, III и V) резко увеличивались как в растворимой, так и в нерастворимой фракциях во время позднего фиброзного ответа, тогда как небольшие богатые лейцином протеогликаны бигликан и декорин, а также фибронектин были повышены при раннем фиброзном ответе. Однако в другом анализе ECM на основе MS децеллюляризованных IPF легких авт. Идентифицировали обогащение гликозаминокликанами, матриксным Gla белком и ассоциированными с микрофибриллами белками в ECM легких IPF [13]. Безусловно, ECM пораженных легких человека может содержать специфическую для заболевания и прогрессирования комбинацию секретируемых белков и протеолитических фрагментов компонентов ECM («сигнатуры»), что может иметь не только большую диагностическую и / или прогностическую ценность для точной медицины будущего. но также может дать новое понимание молекулярных механизмов патогенеза болезни.
Однако в другом анализе ECM на основе MS децеллюляризованных IPF легких авт. Идентифицировали обогащение гликозаминокликанами, матриксным Gla белком и ассоциированными с микрофибриллами белками в ECM легких IPF [13]. Безусловно, ECM пораженных легких человека может содержать специфическую для заболевания и прогрессирования комбинацию секретируемых белков и протеолитических фрагментов компонентов ECM («сигнатуры»), что может иметь не только большую диагностическую и / или прогностическую ценность для точной медицины будущего. но также может дать новое понимание молекулярных механизмов патогенеза болезни.
ХОБЛ и эмфизема
Патофизиологические аспекты ХОБЛ, которая в основном вызвана воздействием дыма, включают обструкцию воздушного потока и гиперинфляцию. Ограничение воздушного потока при ХОБЛ вызвано тремя взаимосвязанными процессами: ремоделирование малых дыхательных путей, приводящее к утолщению стенок дыхательных путей, потеря мелких дыхательных путей и увеличение дыхательных пространств в альвеолах, состояние, называемое эмфиземой [17]. Следовательно, распространение транспульмонального давления нарушается, вызывая гиперинфляцию легких.Эти структурные изменения вызывают биомеханические изменения, которые проявляются в потере упругой отдачи легких. Поскольку ВКМ представляет собой основной компонент дыхательной системы, несущий нагрузку, потеря упругой отдачи при эмфиземе легких предполагает, что эластин, центральный компонент эластичных волокон, является главной целью разложения (рис. 2d). На модели эмфиземы мышей как внутритрахеальная инстилляция эластолитического фермента эластазы, так и дефицит α1-антитрипсина, основного ингибитора эластазы нейтрофилов, привели к образованию эмфиземы [107].Дисбаланс протеазной и антипротеазной активности является широко принятой гипотезой о том, как разложение ткани может происходить при эмфиземе [108]. Высвобождение ферментов, разрушающих ECM, в значительной степени связано с воспалительными клетками, в основном макрофагами, нейтрофилами и Т-клетками [109]. Однако не только разрушение эластических волокон может быть ответственным за изменения биомеханики легких, поскольку есть также экспериментальные доказательства того, что ремоделирование коллагена в стенках альвеол вносит вклад в структурные и биомеханические изменения, обнаруживаемые при эмфиземе легких [110].
Следовательно, распространение транспульмонального давления нарушается, вызывая гиперинфляцию легких.Эти структурные изменения вызывают биомеханические изменения, которые проявляются в потере упругой отдачи легких. Поскольку ВКМ представляет собой основной компонент дыхательной системы, несущий нагрузку, потеря упругой отдачи при эмфиземе легких предполагает, что эластин, центральный компонент эластичных волокон, является главной целью разложения (рис. 2d). На модели эмфиземы мышей как внутритрахеальная инстилляция эластолитического фермента эластазы, так и дефицит α1-антитрипсина, основного ингибитора эластазы нейтрофилов, привели к образованию эмфиземы [107].Дисбаланс протеазной и антипротеазной активности является широко принятой гипотезой о том, как разложение ткани может происходить при эмфиземе [108]. Высвобождение ферментов, разрушающих ECM, в значительной степени связано с воспалительными клетками, в основном макрофагами, нейтрофилами и Т-клетками [109]. Однако не только разрушение эластических волокон может быть ответственным за изменения биомеханики легких, поскольку есть также экспериментальные доказательства того, что ремоделирование коллагена в стенках альвеол вносит вклад в структурные и биомеханические изменения, обнаруживаемые при эмфиземе легких [110]. Соответственно, утолщение коллагеновых фибрилл было продемонстрировано на ультраструктурном уровне у людей и на моделях мышей-грызунов [111]. Это довольно неожиданное открытие подтверждается in vivo доказательством того, что деградация эластазой компонентов ВКМ может запускать синтез коллагена [112], но описанный ответ также может быть результатом продуцирующих TGF-β1 макрофагов, которые стимулируют выработку коллагена эффекторными клетками. [111]. Однако аберрантное отложение коллагена при ХОБЛ по-разному влияет на разные отделы легких.В то время как электронные микрофотографии выявили высокое содержание коллагена и эластина в стенках альвеолярных перегородок эмфизематозной ткани [113], более низкая экспрессия коллагена I была обнаружена в дыхательных путях пациентов с ХОБЛ [114]. Annoni et al. проанализировал подробный состав внеклеточного матрикса пациентов с ХОБЛ по сравнению со здоровым контролем в различных отделах легких и показал, что в образцах умеренной ХОБЛ были изменения эластичных волокон, фибронектина, коллагенов, тенасцина-С и версикана во всех отделах легких.
Соответственно, утолщение коллагеновых фибрилл было продемонстрировано на ультраструктурном уровне у людей и на моделях мышей-грызунов [111]. Это довольно неожиданное открытие подтверждается in vivo доказательством того, что деградация эластазой компонентов ВКМ может запускать синтез коллагена [112], но описанный ответ также может быть результатом продуцирующих TGF-β1 макрофагов, которые стимулируют выработку коллагена эффекторными клетками. [111]. Однако аберрантное отложение коллагена при ХОБЛ по-разному влияет на разные отделы легких.В то время как электронные микрофотографии выявили высокое содержание коллагена и эластина в стенках альвеолярных перегородок эмфизематозной ткани [113], более низкая экспрессия коллагена I была обнаружена в дыхательных путях пациентов с ХОБЛ [114]. Annoni et al. проанализировал подробный состав внеклеточного матрикса пациентов с ХОБЛ по сравнению со здоровым контролем в различных отделах легких и показал, что в образцах умеренной ХОБЛ были изменения эластичных волокон, фибронектина, коллагенов, тенасцина-С и версикана во всех отделах легких. [114].В соответствии с этими выводами Roman et al. продемонстрировал индуцированное никотином усиление экспрессии фибронектина как in vitro , так и in vivo [115]. Более того, in vitro , клетки гладких мышц дыхательных путей (ASM), выделенные от пациентов с ХОБЛ, продуцировали более высокие уровни Col8a1, MMP1, MMP3 и MMP10 в ответ на экстракт сигаретного дыма [116]. Недавно было обнаружено, что мыши с дефицитом гликопротеина ЕСМ фибулина-4 имеют повышенную активность ММП и эластазы нейтрофилов в легких, что приводит к разрушению альвеол у новорожденных мышей и впоследствии к образованию эмфиземы [117].Было обнаружено, что при ХОБЛ уровни экспрессии остеопонтина, который представляет собой фосфорилированный кислый гликопротеин ВКМ с функциями клеточной адгезии и миграции, повышены в мокроте пациентов с ХОБЛ [118]. Повышенные уровни остеопонтина неспецифичны для ХОБЛ, поскольку аналогичная повышающая регуляция остеопонтина была описана в легких и жидкости бронхоальвеолярного лаважа пациентов с ИЛФ [119].
[114].В соответствии с этими выводами Roman et al. продемонстрировал индуцированное никотином усиление экспрессии фибронектина как in vitro , так и in vivo [115]. Более того, in vitro , клетки гладких мышц дыхательных путей (ASM), выделенные от пациентов с ХОБЛ, продуцировали более высокие уровни Col8a1, MMP1, MMP3 и MMP10 в ответ на экстракт сигаретного дыма [116]. Недавно было обнаружено, что мыши с дефицитом гликопротеина ЕСМ фибулина-4 имеют повышенную активность ММП и эластазы нейтрофилов в легких, что приводит к разрушению альвеол у новорожденных мышей и впоследствии к образованию эмфиземы [117].Было обнаружено, что при ХОБЛ уровни экспрессии остеопонтина, который представляет собой фосфорилированный кислый гликопротеин ВКМ с функциями клеточной адгезии и миграции, повышены в мокроте пациентов с ХОБЛ [118]. Повышенные уровни остеопонтина неспецифичны для ХОБЛ, поскольку аналогичная повышающая регуляция остеопонтина была описана в легких и жидкости бронхоальвеолярного лаважа пациентов с ИЛФ [119]. Было обнаружено, что AGE, которые в основном образуются в результате воспалительных процессов, накапливаются в коже пациентов с ХОБЛ.Это потенциально подразумевает роль AGEs и событий гликирования в ранних патологических фазах COPD, хотя прямое значение AGEs в ECM in vivo и в легких человека все еще остается неясным [120]. Кроме того, во время острых обострений ХОБЛ происходит ускоренный оборот белка ЕСМ, что приводит к продуцируемой протеазой фрагментации белков ЕСМ, таких как коллагены, версикан и эластины. Эти отпечатки пальцев белка ЕСМ, циркулирующего в крови, могут быть использованы в качестве мощных биомаркеров при прогнозировании прогрессирования ХОБЛ [121].
Было обнаружено, что AGE, которые в основном образуются в результате воспалительных процессов, накапливаются в коже пациентов с ХОБЛ.Это потенциально подразумевает роль AGEs и событий гликирования в ранних патологических фазах COPD, хотя прямое значение AGEs в ECM in vivo и в легких человека все еще остается неясным [120]. Кроме того, во время острых обострений ХОБЛ происходит ускоренный оборот белка ЕСМ, что приводит к продуцируемой протеазой фрагментации белков ЕСМ, таких как коллагены, версикан и эластины. Эти отпечатки пальцев белка ЕСМ, циркулирующего в крови, могут быть использованы в качестве мощных биомаркеров при прогнозировании прогрессирования ХОБЛ [121].
ЛАГ
ЛАГ — прогрессирующее заболевание с неблагоприятным прогнозом. Патофизиология ЛАГ характеризуется повышенной нагрузкой на правый желудочек сердца в результате нескольких процессов, таких как генетическая предрасположенность, воспаление, пролиферация клеток, вазоконстрикция и ремоделирование сосудов. Легочные артерии подвержены стойкому сужению сосудов и ремоделированию сосудов, что приводит к снижению эластичности легочной артерии [122]. При ЛАГ вся трехслойная архитектура артериальной стенки подвергается ремоделированию, что приводит к утолщению интимы, медиального и адвентициального каналов [123] (рис. 2а).Соответственно, исследования динамического включения с использованием радиоактивного индикатора показали быстрый синтез эластина и коллагена в легочных артериях во время гипоксической легочной гипертензии [124]. Кроме того, компонент ECM, тенасцин-C, был связан с прогрессированием заболевания. У пациентов с ЛАГ и на экспериментальных моделях заболевания тенасцин-C коррелировал с пролиферацией гладкомышечных клеток (ГМК) (рисунок 2e) и митогенным ответом на FGF2. Аналогичным образом, в легких мышей с фиброзом тенасцин-C отрицательно коррелировал с эластичностью легких, то есть большие количества этого белка были связаны с более жесткой тканью легких [12].Между тем, положительная корреляция между экспрессией тенасцина-C и пролиферацией SMC была обнаружена у пациентов с врожденным пороком сердца и на модели грызунов с монокроталином-индуцированной ЛАГ [125].
Легочные артерии подвержены стойкому сужению сосудов и ремоделированию сосудов, что приводит к снижению эластичности легочной артерии [122]. При ЛАГ вся трехслойная архитектура артериальной стенки подвергается ремоделированию, что приводит к утолщению интимы, медиального и адвентициального каналов [123] (рис. 2а).Соответственно, исследования динамического включения с использованием радиоактивного индикатора показали быстрый синтез эластина и коллагена в легочных артериях во время гипоксической легочной гипертензии [124]. Кроме того, компонент ECM, тенасцин-C, был связан с прогрессированием заболевания. У пациентов с ЛАГ и на экспериментальных моделях заболевания тенасцин-C коррелировал с пролиферацией гладкомышечных клеток (ГМК) (рисунок 2e) и митогенным ответом на FGF2. Аналогичным образом, в легких мышей с фиброзом тенасцин-C отрицательно коррелировал с эластичностью легких, то есть большие количества этого белка были связаны с более жесткой тканью легких [12].Между тем, положительная корреляция между экспрессией тенасцина-C и пролиферацией SMC была обнаружена у пациентов с врожденным пороком сердца и на модели грызунов с монокроталином-индуцированной ЛАГ [125]. Однако экспрессия in vitro эластина обратно коррелировала с пролиферацией SMCs [126]. Кроме того, в утолщенной интиме пораженных сосудов из тканей биопсии легких пациентов с ЛАГ повышенные уровни фибронектина и тенасцина-C были идентифицированы с помощью иммуногистохимии и гибридизации in situ [125].Повышенное отложение ГАГ, таких как гиалуроновая кислота (ГК), также наблюдается в реконструированных легочных артериях [127, 128]. Более того, патологическая модификация тяжелой цепи HA, которая, как предполагается, также способствует адгезии и активации лейкоцитов, была идентифицирована в легочной ткани пациентов с ЛАГ [129].
Однако экспрессия in vitro эластина обратно коррелировала с пролиферацией SMCs [126]. Кроме того, в утолщенной интиме пораженных сосудов из тканей биопсии легких пациентов с ЛАГ повышенные уровни фибронектина и тенасцина-C были идентифицированы с помощью иммуногистохимии и гибридизации in situ [125].Повышенное отложение ГАГ, таких как гиалуроновая кислота (ГК), также наблюдается в реконструированных легочных артериях [127, 128]. Более того, патологическая модификация тяжелой цепи HA, которая, как предполагается, также способствует адгезии и активации лейкоцитов, была идентифицирована в легочной ткани пациентов с ЛАГ [129].
Известно, что ММП играют решающую роль в ремоделировании легочных сосудов. In vitro и in situ Исследования SMC легочной артерии выявили дисбаланс MMP и TIMP при идиопатической ЛАГ [130]; Было обнаружено, что MMP3 подавляется, тогда как TIMP1 активируется в пораженных SMC [131].Nave et al. сообщил, что лизилоксидазы также участвуют в ремоделировании легочных сосудов при ЛГ, вызывая массивное поперечное сшивание ВКМ [132]. Несмотря на гиперплазию и гипертрофию сосудистой стенки, обнаруженные в легких с легочной гипертензией, они были успешно децеллюляризованы и рецеллюляризованы мезенхимальными стволовыми клетками [133]. При успешной рецеллюляризации стволовыми клетками децеллюляризованные каркасы 3D ECM из пораженных легких могут стать надежным источником для клинического использования для создания здоровых функциональных тканей.Однако предварительным условием является то, что процесс рецеллюляризации приводит к успешному ремоделированию пораженного гипертрофического ВКМ в децеллюляризованных каркасах, и, по крайней мере, при фиброзных заболеваниях наблюдается противоположный эффект [94].
Несмотря на гиперплазию и гипертрофию сосудистой стенки, обнаруженные в легких с легочной гипертензией, они были успешно децеллюляризованы и рецеллюляризованы мезенхимальными стволовыми клетками [133]. При успешной рецеллюляризации стволовыми клетками децеллюляризованные каркасы 3D ECM из пораженных легких могут стать надежным источником для клинического использования для создания здоровых функциональных тканей.Однако предварительным условием является то, что процесс рецеллюляризации приводит к успешному ремоделированию пораженного гипертрофического ВКМ в децеллюляризованных каркасах, и, по крайней мере, при фиброзных заболеваниях наблюдается противоположный эффект [94].
Астма
Патология астмы характеризуется хроническим воспалением подслизистых областей малых дыхательных путей с ассоциированной гиперплазией бокаловидных клеток, повышенной секрецией слизи, гипертрофией гладких мышц и бронхоспазмом (рисунок 2f).На структуру легких влияет ремоделирование дыхательных путей, вызванное гиперплазией ASM, с сопутствующим измененным профилем ECM вокруг структур дыхательных путей. Эти структурные изменения проявляются в биомеханических дисфункциях. Соответственно, уменьшается упругая отдача легких, что может быть вызвано нарушением передачи упругой нагрузки между паренхимой легкого и дыхательными путями. Аберрантное накопление ВКМ ранее было обнаружено в легких, страдающих астмой, с его основной локализацией в подслизистой и адвентициальной областях как больших, так и малых дыхательных путей [134].Отложения ВКМ, которые возникают даже при легкой форме астмы, включают коллагены I, III и V в субэпителиальной области, а также фибронектин в ретикулярной пластинке бронхиального эпителия [135] (рисунок 2f). Кроме того, при астме со смертельным исходом сообщалось об увеличении эластических волокон, MMP-9 и MMP-12 в крупных дыхательных путях [136]. Интересно отметить, что состав ВКМ центральных и дистальных дыхательных путей пациентов со стойкими симптомами астмы, несмотря на терапию кортикостероидами (неконтролируемая астма), отличается от такового у пациентов с чувствительной к кортикостероидам (контролируемой) астмой.
Эти структурные изменения проявляются в биомеханических дисфункциях. Соответственно, уменьшается упругая отдача легких, что может быть вызвано нарушением передачи упругой нагрузки между паренхимой легкого и дыхательными путями. Аберрантное накопление ВКМ ранее было обнаружено в легких, страдающих астмой, с его основной локализацией в подслизистой и адвентициальной областях как больших, так и малых дыхательных путей [134].Отложения ВКМ, которые возникают даже при легкой форме астмы, включают коллагены I, III и V в субэпителиальной области, а также фибронектин в ретикулярной пластинке бронхиального эпителия [135] (рисунок 2f). Кроме того, при астме со смертельным исходом сообщалось об увеличении эластических волокон, MMP-9 и MMP-12 в крупных дыхательных путях [136]. Интересно отметить, что состав ВКМ центральных и дистальных дыхательных путей пациентов со стойкими симптомами астмы, несмотря на терапию кортикостероидами (неконтролируемая астма), отличается от такового у пациентов с чувствительной к кортикостероидам (контролируемой) астмой. В сущности, при неконтролируемой по сравнению с контролируемой астмой было обнаружено, что отложение коллагена увеличивается в альвеолярной паренхиме, тогда как версикан увеличивается в центральных дыхательных путях, а декорин и бигликан увеличиваются в обоих отделах [137]. Различия между дистальными отделами дыхательных путей и бронхиальным ремоделированием могут быть основаны на изменении статуса секреции ВКМ фибробластов, происходящих из этих разных областей [138]. Эти данные указывают на высокую клиническую значимость ремоделирования ВКМ при астме.Было показано, что в ASM присутствие растворимых форм фибронектина и коллагена I может уменьшать сократительную способность, но увеличивать пролиферативную способность ASM, тогда как культивирование клеток в присутствии только экзогенного растворимого ламинина не влияло ни на пролиферацию, ни на сократительную способность [ 139]. Однако механизм, объясняющий, как белки ЕСМ в их растворимых, не депонированных формах по-разному влияют на фенотип и сократительные функции в ASMs, остается неясным.
В сущности, при неконтролируемой по сравнению с контролируемой астмой было обнаружено, что отложение коллагена увеличивается в альвеолярной паренхиме, тогда как версикан увеличивается в центральных дыхательных путях, а декорин и бигликан увеличиваются в обоих отделах [137]. Различия между дистальными отделами дыхательных путей и бронхиальным ремоделированием могут быть основаны на изменении статуса секреции ВКМ фибробластов, происходящих из этих разных областей [138]. Эти данные указывают на высокую клиническую значимость ремоделирования ВКМ при астме.Было показано, что в ASM присутствие растворимых форм фибронектина и коллагена I может уменьшать сократительную способность, но увеличивать пролиферативную способность ASM, тогда как культивирование клеток в присутствии только экзогенного растворимого ламинина не влияло ни на пролиферацию, ни на сократительную способность [ 139]. Однако механизм, объясняющий, как белки ЕСМ в их растворимых, не депонированных формах по-разному влияют на фенотип и сократительные функции в ASMs, остается неясным. Таким образом, изменения в ECM могут управлять механизмами, ведущими к усиленному росту ASM (рис. 2f), что является ключевым событием в молекулярной патологии астмы [140].Более того, in vitro исследований ASMs предполагают, что изменения в ECM также происходят на посттрансляционных уровнях при астме [140]. Аберрантное отложение компонентов ВКМ по-разному влияет на биомеханические свойства легких. Отложение ВКМ вокруг дыхательных путей усиливает сужение дыхательных путей и вызывает изменения жесткости тканей.
Таким образом, изменения в ECM могут управлять механизмами, ведущими к усиленному росту ASM (рис. 2f), что является ключевым событием в молекулярной патологии астмы [140].Более того, in vitro исследований ASMs предполагают, что изменения в ECM также происходят на посттрансляционных уровнях при астме [140]. Аберрантное отложение компонентов ВКМ по-разному влияет на биомеханические свойства легких. Отложение ВКМ вокруг дыхательных путей усиливает сужение дыхательных путей и вызывает изменения жесткости тканей.
Рак легкого
Признаками рака у человека, которые были подробно описаны Ханаханом и Вайнбергом [141], являются многоступенчатые биологические возможности, которые включают устойчивую пролиферацию, уклонение от подавления роста, устойчивость к смерти, репликативное бессмертие, индуцированный ангиогенез, инициирование инвазия и метастазирование, а также нарушение регуляции клеточной энергетики и воспалительные процессы (рисунок 2g).Поскольку ЕСМ по своим биохимическим и биофизическим свойствам является регулятором клеточных ответов, лежащих в основе признаков рака, изучение влияния ЕСМ на неопластическое прогрессирование становится важным [142]. Например, мелкоклеточный рак легких (SCLC) окружен обширной стромой ECM, которая содержит высокие уровни фибронектина, ламинина, коллагена IV и тенасцина-C [143]. Кроме того, строма опухоли развитой склеротической опухолевой ткани богата коллагеном I, тогда как коллаген III очень распространен в менее зрелой строме [144].Трансляционные исследования показали, что у пациентов с опухолями SCLC, которые окружены обширной стромой, время выживания было сокращено, поскольку связывание клеток SCLC с ECM защищает раковые клетки от апоптоза, вызванного химиотерапией [143]. Ремоделирование стромы опухоли сильно влияет на жесткость ткани, что, в свою очередь, влияет на механобиологию клеток и запускает клеточные реакции (рисунок 2g). Поскольку коллаген, как сообщается, вносит основной вклад в прочность на разрыв в структуре легких, метаболизм коллагена играет решающую роль в укреплении стромы опухоли.Помимо аберрантного отложения и обмена коллагена, при раке легких наблюдались изменения в перекрестном связывании коллагена.
Например, мелкоклеточный рак легких (SCLC) окружен обширной стромой ECM, которая содержит высокие уровни фибронектина, ламинина, коллагена IV и тенасцина-C [143]. Кроме того, строма опухоли развитой склеротической опухолевой ткани богата коллагеном I, тогда как коллаген III очень распространен в менее зрелой строме [144].Трансляционные исследования показали, что у пациентов с опухолями SCLC, которые окружены обширной стромой, время выживания было сокращено, поскольку связывание клеток SCLC с ECM защищает раковые клетки от апоптоза, вызванного химиотерапией [143]. Ремоделирование стромы опухоли сильно влияет на жесткость ткани, что, в свою очередь, влияет на механобиологию клеток и запускает клеточные реакции (рисунок 2g). Поскольку коллаген, как сообщается, вносит основной вклад в прочность на разрыв в структуре легких, метаболизм коллагена играет решающую роль в укреплении стромы опухоли.Помимо аберрантного отложения и обмена коллагена, при раке легких наблюдались изменения в перекрестном связывании коллагена. Совсем недавно Chen et al. сообщил, что строма опухоли демонстрирует высокие уровни поперечных сшивок коллагена, производных гидроксилизинового альдегида (HLCC), и более низкие уровни поперечных связей, производных лизинового альдегида (LCC) [145] (рисунок 2g). Механически этот переход от преимущественно LCC в здоровых к HLCC в опухолевой ткани легкого был связан с ферментом лизилгидроксилазой 2 (Lh3).Сопутствующее увеличение жесткости стромы, в свою очередь, способствовало инвазии опухолевых клеток и метастазированию [145]. В соответствии с этими открытиями известно, что опухолевые клетки экспрессируют высокие уровни LOX, и фармакологические вмешательства, направленные на это семейство ферментов, подавляли метастазирование у животных с опухолями [146]. Mouw et al. показали, что при раке груди жесткость ECM индуцирует miR-18a для снижения экспрессии фосфатазы и гомолога тензина (PTEN), что, в свою очередь, приводит к прогрессированию опухоли [147]. Кроме того, повышенная жесткость ECM в опухолях возвращается к клеткам Rho-зависимым образом, увеличивая напряжение цитоскелета и стабилизируя фокальные спайки [148].
Совсем недавно Chen et al. сообщил, что строма опухоли демонстрирует высокие уровни поперечных сшивок коллагена, производных гидроксилизинового альдегида (HLCC), и более низкие уровни поперечных связей, производных лизинового альдегида (LCC) [145] (рисунок 2g). Механически этот переход от преимущественно LCC в здоровых к HLCC в опухолевой ткани легкого был связан с ферментом лизилгидроксилазой 2 (Lh3).Сопутствующее увеличение жесткости стромы, в свою очередь, способствовало инвазии опухолевых клеток и метастазированию [145]. В соответствии с этими открытиями известно, что опухолевые клетки экспрессируют высокие уровни LOX, и фармакологические вмешательства, направленные на это семейство ферментов, подавляли метастазирование у животных с опухолями [146]. Mouw et al. показали, что при раке груди жесткость ECM индуцирует miR-18a для снижения экспрессии фосфатазы и гомолога тензина (PTEN), что, в свою очередь, приводит к прогрессированию опухоли [147]. Кроме того, повышенная жесткость ECM в опухолях возвращается к клеткам Rho-зависимым образом, увеличивая напряжение цитоскелета и стабилизируя фокальные спайки [148]. Поскольку микросреда опухоли создается раком и стромальными клетками, активация стромальных клеток происходит аутокринным и паракринным образом. В частности, активированные фибробласты, так называемые фибробласты, ассоциированные с раком, играют важную роль в прогрессировании опухоли, существенно ремоделируя ECM опухоли, подавляя иммунный ответ и высвобождая факторы, способствующие росту опухоли [149]. Таким образом, опухолевый ЕСМ обеспечивает аберрантные сигналы микросреды, благоприятствующие пролиферации и метастазированию, а также ингибируя апоптоз опухолевых клеток.Соответственно, на первичных участках и участках метастазов инкапсулирующая строма опухоли может придавать устойчивость к химиотерапии. При SCLC было продемонстрировано, что адгезия опухолевых клеток через интегрин-β1 к белкам ECM является решающим событием в устойчивости клеток к химиотерапии [143]. Безусловно, патологические изменения в ECM при раке легких, такие как повышенная экспрессия коллагена, изменение перекрестного связывания коллагена и последующее увеличение жесткости тканей, напоминают изменения, также обнаруженные в IPF, который выступает за сходство между этими двумя заболеваниями.
Поскольку микросреда опухоли создается раком и стромальными клетками, активация стромальных клеток происходит аутокринным и паракринным образом. В частности, активированные фибробласты, так называемые фибробласты, ассоциированные с раком, играют важную роль в прогрессировании опухоли, существенно ремоделируя ECM опухоли, подавляя иммунный ответ и высвобождая факторы, способствующие росту опухоли [149]. Таким образом, опухолевый ЕСМ обеспечивает аберрантные сигналы микросреды, благоприятствующие пролиферации и метастазированию, а также ингибируя апоптоз опухолевых клеток.Соответственно, на первичных участках и участках метастазов инкапсулирующая строма опухоли может придавать устойчивость к химиотерапии. При SCLC было продемонстрировано, что адгезия опухолевых клеток через интегрин-β1 к белкам ECM является решающим событием в устойчивости клеток к химиотерапии [143]. Безусловно, патологические изменения в ECM при раке легких, такие как повышенная экспрессия коллагена, изменение перекрестного связывания коллагена и последующее увеличение жесткости тканей, напоминают изменения, также обнаруженные в IPF, который выступает за сходство между этими двумя заболеваниями. Интересно, что сообщается о многих патогенных аналогиях между раком и IPF: общие факторы риска (, например, курение, воздействие окружающей среды, вирусные инфекции и хроническое повреждение тканей), отсроченный апоптоз, активация специфических сигнальных путей, как эпигенетические, так и генетические изменения, измененная экспрессия микроРНК и аберрантная пролиферация и инвазия клеток [150–154]. Есть практические основания рассматривать IPF как рак, подобное заболеванию, что в конечном итоге может привести к новым клиническим испытаниям противораковых препаратов для IPF [154].
Интересно, что сообщается о многих патогенных аналогиях между раком и IPF: общие факторы риска (, например, курение, воздействие окружающей среды, вирусные инфекции и хроническое повреждение тканей), отсроченный апоптоз, активация специфических сигнальных путей, как эпигенетические, так и генетические изменения, измененная экспрессия микроРНК и аберрантная пролиферация и инвазия клеток [150–154]. Есть практические основания рассматривать IPF как рак, подобное заболеванию, что в конечном итоге может привести к новым клиническим испытаниям противораковых препаратов для IPF [154].
Модельные системы ECM
Состав ECM и его биомеханические свойства влияют на клеточную морфологию [155], подвижность, распространение, жизнеспособность клеток и апоптоз, а также на пролиферацию и дифференцировку [5]. Следовательно, поскольку клеточное поведение и ECM сильно взаимосвязаны, необходимы системы культур клеток in vitro , которые точно имитируют физиологические и патологические условия, обнаруженные in vivo . Множественные модели in vivo на животных , отражающие патогенез заболеваний легких человека, были разработаны в прошлом.Поскольку подробное обсуждение животных моделей, представляющих заболевания легких, далеко выходит за рамки этого обзора, мы отсылаем читателя к ряду превосходных обзоров для дальнейшего чтения [156–162]. В частности, исследования мезенхимальных клеток, которые физиологически встроены в ЕСМ, могут быть полезны с помощью моделей in vitro, , in vivo, или ex vivo, , которые очень похожи по структуре и биомеханике интерстициального легочного ВКМ [163–165] . В прошлом применялись различные системы трехмерных культур клеток [166].Самая упрощенная модель — это пластик для тканевой культуры, покрытый молекулами ЕСМ. Благодаря своей упрощенной конструкции его можно использовать для изучения взаимодействия определенных молекул ЕСМ с клетками, хотя здесь клетки прикреплены к двумерной (2D) поверхности, а не встроены в ЕСМ. Более того, жесткость пластика для клеточных культур намного превосходит физиологически обнаруженный in vivo ; Согласно измерениям с помощью атомно-силовой микроскопии, модуль Юнга (измеренный в паскалях) пластика клеточной культуры колеблется от 2 до 4 ГПа, тогда как нормальная ткань легких колеблется от 0.
Множественные модели in vivo на животных , отражающие патогенез заболеваний легких человека, были разработаны в прошлом.Поскольку подробное обсуждение животных моделей, представляющих заболевания легких, далеко выходит за рамки этого обзора, мы отсылаем читателя к ряду превосходных обзоров для дальнейшего чтения [156–162]. В частности, исследования мезенхимальных клеток, которые физиологически встроены в ЕСМ, могут быть полезны с помощью моделей in vitro, , in vivo, или ex vivo, , которые очень похожи по структуре и биомеханике интерстициального легочного ВКМ [163–165] . В прошлом применялись различные системы трехмерных культур клеток [166].Самая упрощенная модель — это пластик для тканевой культуры, покрытый молекулами ЕСМ. Благодаря своей упрощенной конструкции его можно использовать для изучения взаимодействия определенных молекул ЕСМ с клетками, хотя здесь клетки прикреплены к двумерной (2D) поверхности, а не встроены в ЕСМ. Более того, жесткость пластика для клеточных культур намного превосходит физиологически обнаруженный in vivo ; Согласно измерениям с помощью атомно-силовой микроскопии, модуль Юнга (измеренный в паскалях) пластика клеточной культуры колеблется от 2 до 4 ГПа, тогда как нормальная ткань легких колеблется от 0. 44 и 7,5 кПа, в зависимости от измеряемой области, а фиброзная ткань легкого человека у пациентов с ИЛФ в среднем составляет 16,52 кПа [13, 167, 168]. Однако механически настраиваемые 2D-модели с использованием синтетических матриц на основе акриламида или полиэтиленгликоля дают возможность индуцировать образование градиента и жесткий контроль жесткости ECM [166, 169]. Помимо этих искусственно синтезированных макромолекулярных структур, нативные и сконструированные биополимеры, состоящие из коллагенов [170], эластина [171], фибрина [172] или ламинина [173], широко используются в модельных системах in vitro ECM [174].Гели экстракта базальной мембраны и децеллюляризованные матриксы на основе фибробластов также используются в настоящее время [175], и они более точно имитируют состав, трехмерную структуру и биомеханику физиологического ВКМ. Однако ни одна из этих моделей не может имитировать уникальную пространственную геометрию легочной ткани. Чтобы обойти эти биомиметические ограничения, можно использовать нарезанные вибратомом матрицы ex vivo , взятые из различных моделей болезней животных, а также из пораженных тканей человека в их нативных или децеллюляризованных формах [13, 176–178].
44 и 7,5 кПа, в зависимости от измеряемой области, а фиброзная ткань легкого человека у пациентов с ИЛФ в среднем составляет 16,52 кПа [13, 167, 168]. Однако механически настраиваемые 2D-модели с использованием синтетических матриц на основе акриламида или полиэтиленгликоля дают возможность индуцировать образование градиента и жесткий контроль жесткости ECM [166, 169]. Помимо этих искусственно синтезированных макромолекулярных структур, нативные и сконструированные биополимеры, состоящие из коллагенов [170], эластина [171], фибрина [172] или ламинина [173], широко используются в модельных системах in vitro ECM [174].Гели экстракта базальной мембраны и децеллюляризованные матриксы на основе фибробластов также используются в настоящее время [175], и они более точно имитируют состав, трехмерную структуру и биомеханику физиологического ВКМ. Однако ни одна из этих моделей не может имитировать уникальную пространственную геометрию легочной ткани. Чтобы обойти эти биомиметические ограничения, можно использовать нарезанные вибратомом матрицы ex vivo , взятые из различных моделей болезней животных, а также из пораженных тканей человека в их нативных или децеллюляризованных формах [13, 176–178]. Ex vivo Модели , использующие децеллюляризованную легочную ткань, помогут в дальнейшем механистически определить влияние ECM на патологии легких. Наконец, в будущем технологии трехмерной биопечати или методы аддитивного производства могут открыть многообещающие и захватывающие новые способы создания биосовместимых каркасов ECM, которые биомеханически напоминают настоящую ткань. Такие изготовленные каркасы могут быть использованы либо в качестве настраиваемых моделей in vitro для изучения инструктивной природы ECM, либо, в конечном итоге, при успешном пересеве с клетками, в качестве биоинженерной ткани, готовой заменить больные ткани или целые органы [179].
Ex vivo Модели , использующие децеллюляризованную легочную ткань, помогут в дальнейшем механистически определить влияние ECM на патологии легких. Наконец, в будущем технологии трехмерной биопечати или методы аддитивного производства могут открыть многообещающие и захватывающие новые способы создания биосовместимых каркасов ECM, которые биомеханически напоминают настоящую ткань. Такие изготовленные каркасы могут быть использованы либо в качестве настраиваемых моделей in vitro для изучения инструктивной природы ECM, либо, в конечном итоге, при успешном пересеве с клетками, в качестве биоинженерной ткани, готовой заменить больные ткани или целые органы [179].
Заключение и перспективы на будущее
Хронические респираторные заболевания возникают в результате сложного взаимодействия факторов риска окружающей среды, эпигенетических влияний и генетических влияний. Считается, что неблагоприятные воздействия окружающей среды во время жизни плода и младенца приводят к стойким изменениям в структуре и функции легких. Такое «программирование» на ранних этапах жизни могло бы ошибочно переделать ECM и, следовательно, проложить путь к развитию хронических респираторных заболеваний во взрослом возрасте. Регулируемое ремоделирование внеклеточного матрикса, особенно в процессе заживления ран, с помощью его резидентных клеток, является предпосылкой для поддержания гомеостаза тканей.При патологических событиях качества ECM, такие как его состав и топологические особенности, биомеханические свойства, PTM или роль резервуара для секретируемых медиаторов, действуют как поучительные сигналы, которые влияют на поведение фибробластов и других типов клеток. Как только гомеостаз ткани нарушается повторным повреждением и восстановлением, аберрантные механизмы обратной связи между клетками и их реконструированным ECM запускают порочный круг, который приводит к прогрессированию заболевания. Во время прогрессирования заболевания взаимодействие между клетками и ECM может быть очень сложным, может включать различные типы клеток и может происходить в пространственно различных компартментах.
Такое «программирование» на ранних этапах жизни могло бы ошибочно переделать ECM и, следовательно, проложить путь к развитию хронических респираторных заболеваний во взрослом возрасте. Регулируемое ремоделирование внеклеточного матрикса, особенно в процессе заживления ран, с помощью его резидентных клеток, является предпосылкой для поддержания гомеостаза тканей.При патологических событиях качества ECM, такие как его состав и топологические особенности, биомеханические свойства, PTM или роль резервуара для секретируемых медиаторов, действуют как поучительные сигналы, которые влияют на поведение фибробластов и других типов клеток. Как только гомеостаз ткани нарушается повторным повреждением и восстановлением, аберрантные механизмы обратной связи между клетками и их реконструированным ECM запускают порочный круг, который приводит к прогрессированию заболевания. Во время прогрессирования заболевания взаимодействие между клетками и ECM может быть очень сложным, может включать различные типы клеток и может происходить в пространственно различных компартментах. Например, успешное метастазирование требует раннего ремоделирования ВКМ в метастатической нише, которая пространственно удалена от локальной ниши первичной опухоли, чтобы помочь циркулирующим опухолевым клеткам прижиться в отдаленных органах [180]. Следовательно, определение молекулярного состава ЕСМ в пораженных легких с помощью современных технологий, таких как протеомика, управляемая МС или секвенирование следующего поколения, является важным шагом на пути к идентификации диагностических биомаркеров прогрессирования заболевания и одинаковая терапия.Будущие попытки разработать методы для понимания сложной функциональной и физической топологии ECM in situ на системном уровне будут ключевыми для понимания его роли в тканевой (патофизиологии). Для того чтобы увидеть прорывы в разработке новых терапевтических вмешательств, крайне важно понять сложные взаимодействия и лежащие в основе механизмы обратной связи, которые происходят между основной матрисомой, факторами, связанными с матрисомой, и клетками [168, 181].
Например, успешное метастазирование требует раннего ремоделирования ВКМ в метастатической нише, которая пространственно удалена от локальной ниши первичной опухоли, чтобы помочь циркулирующим опухолевым клеткам прижиться в отдаленных органах [180]. Следовательно, определение молекулярного состава ЕСМ в пораженных легких с помощью современных технологий, таких как протеомика, управляемая МС или секвенирование следующего поколения, является важным шагом на пути к идентификации диагностических биомаркеров прогрессирования заболевания и одинаковая терапия.Будущие попытки разработать методы для понимания сложной функциональной и физической топологии ECM in situ на системном уровне будут ключевыми для понимания его роли в тканевой (патофизиологии). Для того чтобы увидеть прорывы в разработке новых терапевтических вмешательств, крайне важно понять сложные взаимодействия и лежащие в основе механизмы обратной связи, которые происходят между основной матрисомой, факторами, связанными с матрисомой, и клетками [168, 181]. Потенциальные терапевтические средства для лечения фиброзных заболеваний включают ферменты, которые воздействуют на жесткость ECM путем разрушения аномального ECM, а также антитела, которые ингибируют активность ферментов сшивания ECM, таких как лизилоксидазы, а также активность MMP и TGF-β1 [73].Кроме того, ингибиторы клеточных рецепторов, таких как рецептор эпидермального фактора роста, или лекарства, нацеленные на механизм механотрансдукции через интегрины , в настоящее время тестируются в качестве терапевтических средств при таких заболеваниях, как рак легких и фиброзные расстройства [73). Кроме того, молекулы и пути, участвующие в реакции легких на окислительный стресс, обсуждаются как потенциальные терапевтические мишени [38]. Также растет интерес к использованию клеток-предшественников, таких как мезенхимальные стволовые клетки, которые могут обладать регенеративным потенциалом, в качестве усилителей восстановления тканей [168].Однако на данный момент трансплантация легких остается единственным действенным методом лечения терминальной стадии заболеваний легких, но нехватка донорских легких и необходимость интенсивной иммуносупрессии для предотвращения отторжения аллотрансплантата ограничивают их клиническое применение.
Потенциальные терапевтические средства для лечения фиброзных заболеваний включают ферменты, которые воздействуют на жесткость ECM путем разрушения аномального ECM, а также антитела, которые ингибируют активность ферментов сшивания ECM, таких как лизилоксидазы, а также активность MMP и TGF-β1 [73].Кроме того, ингибиторы клеточных рецепторов, таких как рецептор эпидермального фактора роста, или лекарства, нацеленные на механизм механотрансдукции через интегрины , в настоящее время тестируются в качестве терапевтических средств при таких заболеваниях, как рак легких и фиброзные расстройства [73). Кроме того, молекулы и пути, участвующие в реакции легких на окислительный стресс, обсуждаются как потенциальные терапевтические мишени [38]. Также растет интерес к использованию клеток-предшественников, таких как мезенхимальные стволовые клетки, которые могут обладать регенеративным потенциалом, в качестве усилителей восстановления тканей [168].Однако на данный момент трансплантация легких остается единственным действенным методом лечения терминальной стадии заболеваний легких, но нехватка донорских легких и необходимость интенсивной иммуносупрессии для предотвращения отторжения аллотрансплантата ограничивают их клиническое применение. Следовательно, биоартификационные каркасы ВКМ станут важными элементами терапии на основе стволовых клеток в регенеративной медицине. Дальнейшие усилия позволят определить, могут ли синтетические (напечатанные на 3D-принтере) каркасы или децеллюляризованные каркасы ECM целых органов и их рецеллюляризация аутологичными предшественниками или стволовыми клетками привести к полностью функциональным и трансплантируемым органам.Изготовление таких суррогатов легких по-прежнему далеко от реальности, но фундаментальные исследования архитектуры и функции ECM, а также тканевой инженерии, вероятно, дадут новые идеи для внедрения в клиническую практику.
Следовательно, биоартификационные каркасы ВКМ станут важными элементами терапии на основе стволовых клеток в регенеративной медицине. Дальнейшие усилия позволят определить, могут ли синтетические (напечатанные на 3D-принтере) каркасы или децеллюляризованные каркасы ECM целых органов и их рецеллюляризация аутологичными предшественниками или стволовыми клетками привести к полностью функциональным и трансплантируемым органам.Изготовление таких суррогатов легких по-прежнему далеко от реальности, но фундаментальные исследования архитектуры и функции ECM, а также тканевой инженерии, вероятно, дадут новые идеи для внедрения в клиническую практику.
Помощь с составом внеклеточного матрикса
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает
или больше ваших авторских прав, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее
то
информацию, описанную ниже, назначенному ниже агенту. Если репетиторы вуза предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Если репетиторы вуза предпримут действия в ответ на
ан
Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент
средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении может быть направлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы искажать информацию о том, что продукт или действие нарушают ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись владельца авторских прав или лица, уполномоченного действовать от их имени;
Идентификация авторских прав, которые, как утверждается, были нарушены;
Описание характера и точного расположения контента, который, по вашему мнению, нарушает ваши авторские права, в \
достаточно подробностей, чтобы позволить преподавателям Varsity Tutors найти и точно идентифицировать этот контент; например нам требуется
а
ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание
к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении прав, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
д. — относится ваша жалоба;
Ваше имя, адрес, номер телефона и адрес электронной почты; и
Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает
ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все
информация, содержащаяся в вашем Уведомлении о нарушении прав, является точной, и (c) под страхом наказания за лжесвидетельство, что вы
либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон
Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105
Или заполните форму ниже:
5.6A: Внеклеточный матрикс клеток животных
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые термины
- Внеклеточный матрикс клеток животных
Внеклеточный матрикс клеток животных удерживает клетки вместе, образуя ткань и позволяя тканям общаться друг с другом.
Задачи обучения
- Объяснить роль внеклеточного матрикса в клетках животных
Ключевые моменты
- Внеклеточный матрикс клеток животных состоит из белков и углеводов.
- Связь клеток внутри тканей и формирование тканей — основные функции внеклеточного матрикса клеток животных.
- Тканевая коммуникация запускается, когда молекула в матрице связывает рецептор; Конечными результатами являются конформационные изменения, которые вызывают химические сигналы, которые в конечном итоге изменяют деятельность внутри клетки.
Ключевые термины
- коллаген : Любой из более чем 28 типов гликопротеинов, образующих удлиненные волокна, обычно обнаруживаемый во внеклеточном матриксе соединительной ткани.
- протеогликан : любой из многих гликопротеинов, которые имеют гетерополисахаридные боковые цепи
- внеклеточный матрикс : Все соединительные ткани и волокна, которые не являются частью клетки, но обеспечивают поддержку.

Внеклеточный матрикс животных клеток
Большинство клеток животных выделяют материалы во внеклеточное пространство.Основными компонентами этих материалов являются белки. Коллаген — самый распространенный из белков. Его волокна переплетены с углеводсодержащими белковыми молекулами, называемыми протеогликанами. В совокупности эти материалы называются внеклеточным матриксом. Мало того, что внеклеточный матрикс удерживает клетки вместе, образуя ткань, он также позволяет клеткам внутри ткани связываться друг с другом.
Рисунок \ (\ PageIndex {1} \): Внеклеточный матрикс : Внеклеточный матрикс состоит из сети белков и углеводов. Как происходит эта сотовая связь? Клетки имеют белковые рецепторы на внеклеточных поверхностях их плазматических мембран. Когда молекула в матрице связывается с рецептором, это изменяет молекулярную структуру рецептора. Рецептор, в свою очередь, изменяет конформацию микрофиламентов, расположенных внутри плазматической мембраны. Эти конформационные изменения вызывают внутри клетки химические сигналы, которые достигают ядра и включают или выключают транскрипцию определенных участков ДНК.Это влияет на выработку ассоциированных белков, тем самым изменяя активность внутри клетки.
Эти конформационные изменения вызывают внутри клетки химические сигналы, которые достигают ядра и включают или выключают транскрипцию определенных участков ДНК.Это влияет на выработку ассоциированных белков, тем самым изменяя активность внутри клетки.
Пример роли внеклеточного матрикса в клеточной коммуникации можно увидеть в свертывании крови. Когда клетки, выстилающие кровеносный сосуд, повреждены, они обнаруживают белковый рецептор, называемый тканевым фактором. Когда тканевой фактор связывается с другим фактором внеклеточного матрикса, он заставляет тромбоциты прилипать к стенке поврежденного кровеносного сосуда и стимулирует соседние гладкомышечные клетки кровеносного сосуда к сокращению (таким образом, сужая кровеносный сосуд).Впоследствии инициируется серия шагов, которые затем побуждают тромбоциты вырабатывать факторы свертывания крови.
Анализ состава внеклеточного матрикса во висцеральных мышцах мутантных личинок Nidogen у дрозофилы
Новое открытие
Анализ состава внеклеточного матрикса во висцеральных мышцах мутантных личинок Nidogen у Drosophila
Uwe Töp0002 Uwe Töp 1Technische Universität Dresden, Institute of Genetics
2Justus-Liebig-Universität Giessen, Institut für Allgemeine und Spezielle Zoologie, Allgemeine Zoologie und Entwicklungsbiologie
Рис. личинки. (A) Схематическое изображение основных компонентов ECM. Гетеротримеры ламинина закреплены на рецепторах клеточной поверхности и организованы как тройные узлы, выстраивающие сеть. Гетеротримеры ламинина A и ламинина Wb состоят либо из α-субъединицы ламинина A (LanA, красный), либо из α-субъединицы ламинина Wb (LanWb, красный), β-субъединицы ламинина B1 (LanB1, темно-красный) и γ -субъединица Ламинин B2 (LanB2, светло-красный). Коллатеральное соединение между сетями ЕСМ опосредуется Perlecan (Pcan, желтый; кодируется геном trol ), а также Nidogen (Ndg, синий), который связывается с ламинином, Perlecan и коллагеном IV.Тройная спираль коллагена IV состоит из двух субъединиц α1 (коллаген IV α1, Col4α1, темно-зеленый) и одной субъединицы α2 (Viking, Vkg, светло-зеленый). Секретируемый белок, кислый, богатый цистеином (SPARC, пурпурный) связывается с сетью Collagen IV. (B) Схематическое изображение морфологии висцеральных мышц средней кишки личинки. Круговые мышцы выделены светло-оранжевым цветом, а продольные мышцы — темно-оранжевым.
личинки. (A) Схематическое изображение основных компонентов ECM. Гетеротримеры ламинина закреплены на рецепторах клеточной поверхности и организованы как тройные узлы, выстраивающие сеть. Гетеротримеры ламинина A и ламинина Wb состоят либо из α-субъединицы ламинина A (LanA, красный), либо из α-субъединицы ламинина Wb (LanWb, красный), β-субъединицы ламинина B1 (LanB1, темно-красный) и γ -субъединица Ламинин B2 (LanB2, светло-красный). Коллатеральное соединение между сетями ЕСМ опосредуется Perlecan (Pcan, желтый; кодируется геном trol ), а также Nidogen (Ndg, синий), который связывается с ламинином, Perlecan и коллагеном IV.Тройная спираль коллагена IV состоит из двух субъединиц α1 (коллаген IV α1, Col4α1, темно-зеленый) и одной субъединицы α2 (Viking, Vkg, светло-зеленый). Секретируемый белок, кислый, богатый цистеином (SPARC, пурпурный) связывается с сетью Collagen IV. (B) Схематическое изображение морфологии висцеральных мышц средней кишки личинки. Круговые мышцы выделены светло-оранжевым цветом, а продольные мышцы — темно-оранжевым. (C, D) Окрашивание антителом к нидогену в контроле ( белый 1118 , C) и Ndg Δ1.4 мутантных личинок (D). (E, F) Окрашивание блистерных антител к ламинину A и (G, H) Laminin Wing в контроле ( белый 1118 , E и G) и Ndg Δ1,4 мутантных личинок (F и H). (I, J) Окрашивание антителом GFP в контроле ( трол: GFP , I) и мутант Ndg ( трол :: GFP ; Ndg Δ1,4 , J), (K, L) а также в контроле ( vkg :: GFP , K) и мутантных личинок Ndg ( vkg :: GFP , Ndg Δ1.4 , л). (M, N) Окрашивание антителом SPARC в контроле ( белый 1118 , M) и Ndg Δ1,4 мутантных личинок (N). Масштабные линейки = 50 мкм.
(C, D) Окрашивание антителом к нидогену в контроле ( белый 1118 , C) и Ndg Δ1.4 мутантных личинок (D). (E, F) Окрашивание блистерных антител к ламинину A и (G, H) Laminin Wing в контроле ( белый 1118 , E и G) и Ndg Δ1,4 мутантных личинок (F и H). (I, J) Окрашивание антителом GFP в контроле ( трол: GFP , I) и мутант Ndg ( трол :: GFP ; Ndg Δ1,4 , J), (K, L) а также в контроле ( vkg :: GFP , K) и мутантных личинок Ndg ( vkg :: GFP , Ndg Δ1.4 , л). (M, N) Окрашивание антителом SPARC в контроле ( белый 1118 , M) и Ndg Δ1,4 мутантных личинок (N). Масштабные линейки = 50 мкм.
Группа высококонсервативных белков внеклеточного матрикса (ЕСМ), которые обогащены базальными мембранами во всех метазоа, образуют так называемый «набор инструментов для базальных мембран» (Hynes, 2012; Hynes and Zhao, 2000). Эти важные компоненты организованы в два слоя, соединенные друг с другом посредством линкерных белков Perlecan и Nidogen (рис.1А). Внутренний слой образован самособирающейся сетью гетеротримеров ламинина, каждая из которых состоит из α-, β- и γ-субъединицы. Внешняя сеть состоит из коллагена IV, который образует тройную спираль с двумя α1-субъединицами и одной α2-субъединицей. В Drosophila melanogaster небольшой набор генов кодирует эти компоненты. Четыре гена кодируют субъединицы ламинина: два гена α-субъединиц, ( Laminin A , LanA и крыловой волдырь , wb , обозначаемые здесь как ‘ LanWb ‘ ) , и только один Ген кодирует β- ( Laminin B1 , LanB1 ), и один ген кодирует субъединицу γ ( Laminin B2 , LanB2 ).Кроме того, один ген кодирует субъединицы коллагена IV α1 ( Collagen IV α 1 , Col4 α 1 ) и α2 ( viking , vkg ), а также линкерные белки Perlecan ( Ужасно уменьшенные зрительные доли , троль , ) и нидоген ( Ndg ).
Эти важные компоненты организованы в два слоя, соединенные друг с другом посредством линкерных белков Perlecan и Nidogen (рис.1А). Внутренний слой образован самособирающейся сетью гетеротримеров ламинина, каждая из которых состоит из α-, β- и γ-субъединицы. Внешняя сеть состоит из коллагена IV, который образует тройную спираль с двумя α1-субъединицами и одной α2-субъединицей. В Drosophila melanogaster небольшой набор генов кодирует эти компоненты. Четыре гена кодируют субъединицы ламинина: два гена α-субъединиц, ( Laminin A , LanA и крыловой волдырь , wb , обозначаемые здесь как ‘ LanWb ‘ ) , и только один Ген кодирует β- ( Laminin B1 , LanB1 ), и один ген кодирует субъединицу γ ( Laminin B2 , LanB2 ).Кроме того, один ген кодирует субъединицы коллагена IV α1 ( Collagen IV α 1 , Col4 α 1 ) и α2 ( viking , vkg ), а также линкерные белки Perlecan ( Ужасно уменьшенные зрительные доли , троль , ) и нидоген ( Ndg ). Ndg соединяет ламинин с сетью коллагена IV посредством связывания перлекана и коллагена IV с γ-субъединицей ламинина, и предполагается, что он играет важную роль в сборке ECM (рис.1А; Fox et al. , 1991; Hopf et al. , 2001а; Mann et al. , 1989; Рейнхардт и др. , 1993). Однако, в отличие от мутантов других компонентов базальной мембраны у Drosophila , мутанты Ndg жизнеспособны и, по-видимому, не играют роли в общей сборке ЕСМ (Dai et al. , 2018; Wolfstetter et al. , 2019), тогда как дальнейший ультраструктурный анализ выявил нарушенный ECM висцеральных мышц личинки (Wolfstetter et al., 2019). Неизвестно, соответствуют ли эти ультраструктурные изменения в личиночных висцеральных мышцах мутантов Ndg изменению в распределении или сборке других компонентов базальной мембраны, поэтому в этом исследовании мы исследуем распределение белков основных компонентов ЕСМ у мутантов Ndg . .
Ndg соединяет ламинин с сетью коллагена IV посредством связывания перлекана и коллагена IV с γ-субъединицей ламинина, и предполагается, что он играет важную роль в сборке ECM (рис.1А; Fox et al. , 1991; Hopf et al. , 2001а; Mann et al. , 1989; Рейнхардт и др. , 1993). Однако, в отличие от мутантов других компонентов базальной мембраны у Drosophila , мутанты Ndg жизнеспособны и, по-видимому, не играют роли в общей сборке ЕСМ (Dai et al. , 2018; Wolfstetter et al. , 2019), тогда как дальнейший ультраструктурный анализ выявил нарушенный ECM висцеральных мышц личинки (Wolfstetter et al., 2019). Неизвестно, соответствуют ли эти ультраструктурные изменения в личиночных висцеральных мышцах мутантов Ndg изменению в распределении или сборке других компонентов базальной мембраны, поэтому в этом исследовании мы исследуем распределение белков основных компонентов ЕСМ у мутантов Ndg . .
Здесь мы проанализировали релевантность Ndg для сборки ECM в висцеральных мышцах личинок третьего возраста и сравнили локализацию белков базальной мембраны в висцеральных мышцах аморфных мутантов Ndg с контролем посредством мечения специфическими антителами и линиями ловушек для экзонов GFP. Как и ожидалось, Ndg равномерно распределяется по всем висцеральным мышцам в контроле (рис. 1C), тогда как мутанты Ndg не демонстрируют этот сигнал (рис. 1D), хотя висцеральные мышцы правильно сформированы, что определяется контрольным окрашиванием F-актина. (данные не показаны). Сборка гетеротримеров ламинина важна для правильного включения других компонентов ECM, таких как Ndg (Wolfstetter and Holz, 2012; Wolfstetter et al. , 2019). Поскольку висцеральные мышцы экспрессируют оба возможных гетеротримеров ламинина и между ними может существовать некоторая функциональная избыточность (Martin et al., 1999; Вольфштеттер и Хольц, 2012; Yarnitzky and Volk, 1995), мы изучили распределение обеих α-субъединиц ламинина (LanA на рис. 1E и F и LanWb на рис. 1G и H). В соответствии с ролью сети Laminin в инициации базальной мембраны (Hohenester and Yurchenco, 2013), потеря Ndg не влияет ни на Laminin A, ни на отложение гетеротримеров Wing в личиночных висцеральных мышцах в целом (Fig.
Как и ожидалось, Ndg равномерно распределяется по всем висцеральным мышцам в контроле (рис. 1C), тогда как мутанты Ndg не демонстрируют этот сигнал (рис. 1D), хотя висцеральные мышцы правильно сформированы, что определяется контрольным окрашиванием F-актина. (данные не показаны). Сборка гетеротримеров ламинина важна для правильного включения других компонентов ECM, таких как Ndg (Wolfstetter and Holz, 2012; Wolfstetter et al. , 2019). Поскольку висцеральные мышцы экспрессируют оба возможных гетеротримеров ламинина и между ними может существовать некоторая функциональная избыточность (Martin et al., 1999; Вольфштеттер и Хольц, 2012; Yarnitzky and Volk, 1995), мы изучили распределение обеих α-субъединиц ламинина (LanA на рис. 1E и F и LanWb на рис. 1G и H). В соответствии с ролью сети Laminin в инициации базальной мембраны (Hohenester and Yurchenco, 2013), потеря Ndg не влияет ни на Laminin A, ни на отложение гетеротримеров Wing в личиночных висцеральных мышцах в целом (Fig. 1E-H). Предполагается, что линкерный белок Pcan действует как коллатеральный линкер между сетями ламинина и коллагена, кроме того, он также способен связывать Ndg (Battaglai et al., 1992, Hopf et al. , 2001а, 2001б). Мы проанализировали локализацию Pcan с линией ловушек экзонов trol :: GFP (Morin et al. , 2001). Сравнение сигналов GFP в контроле и мутантов Ndg не показывает очевидных различий (Fig. 1I и J), предполагая, что Ndg не требуется для локализации Pcan в базальной мембране. Локализация сети Collagen IV была изучена с помощью линии ловушки экзонов vkg :: GFP (Morin et al. , 2001), которая отражает распределение тройной спирали Collagen IV.Сравнимые сигналы от контролей и мутантов Ndg (рис. 1K и L) указывают на отсутствие роли Ndg для соединения сетей ламинина и коллагена, что можно объяснить избыточной функцией Pcan и Ndg (рис. 1A). Эта модель подтверждается недавним исследованием, которое показало более сильный фенотип двойного нокдауна трол , Ndg по сравнению с одним нокдауном трол к (Dai et al. , 2018). Подобно другим протестированным компонентам ЕСМ, локализация коллаген-связывающего гликопротеина SPARC не затрагивается у мутантов Ndg по сравнению с контролем (рис.1М и Н).
1E-H). Предполагается, что линкерный белок Pcan действует как коллатеральный линкер между сетями ламинина и коллагена, кроме того, он также способен связывать Ndg (Battaglai et al., 1992, Hopf et al. , 2001а, 2001б). Мы проанализировали локализацию Pcan с линией ловушек экзонов trol :: GFP (Morin et al. , 2001). Сравнение сигналов GFP в контроле и мутантов Ndg не показывает очевидных различий (Fig. 1I и J), предполагая, что Ndg не требуется для локализации Pcan в базальной мембране. Локализация сети Collagen IV была изучена с помощью линии ловушки экзонов vkg :: GFP (Morin et al. , 2001), которая отражает распределение тройной спирали Collagen IV.Сравнимые сигналы от контролей и мутантов Ndg (рис. 1K и L) указывают на отсутствие роли Ndg для соединения сетей ламинина и коллагена, что можно объяснить избыточной функцией Pcan и Ndg (рис. 1A). Эта модель подтверждается недавним исследованием, которое показало более сильный фенотип двойного нокдауна трол , Ndg по сравнению с одним нокдауном трол к (Dai et al. , 2018). Подобно другим протестированным компонентам ЕСМ, локализация коллаген-связывающего гликопротеина SPARC не затрагивается у мутантов Ndg по сравнению с контролем (рис.1М и Н).
Наши данные подтверждают, что на базовый состав исследованных белков ЕСМ не влияет потеря Ndg и, следовательно, Ndg, по-видимому, не является важным единичным игроком для соединения различных слоев базальной мембраны.
Запросить подробный протоколИммунофлуоресцентное окрашивание
Окрашивание антителами Drosophila блуждающих личинок третьего возраста проводили, как описано Müller (2008), и модифицировали, как описано в Wolfstetter et al. (2019). Были использованы следующие первичные антитела: кроличий анти-зеленый флуоресцентный белок (GFP, 1: 500, Abcam, ab290), анти-ламинин А морской свинки (LanA, 1: 500; Harpaz and Volk, 2012), кроличий блистер против Wing. (LanWb, 1: 100; Martin и др. , 1999), кроличьи антитела против нидогена (Ndg, 1: 1.000; Wolfstetter и др. , 2009), кроличьи антитела против SPARC (SPARC, 1: 500; Martinek et al., , 2002), конъюгированные с Cy3 козьи IgG против морских свинок (1: 200, Dianova) и DyLight 488, конъюгированные с козьими вторичными антителами против кроликов (1: 1000; Vector Laboratories).Сайты неспецифического связывания блокировали 5% козьей сывороткой. Ткани помещали в Fluoromount G (Southern Biotech) и отображали с помощью конфокальной микроскопии (Leica TCS SP2) с одинаковой интенсивностью лазера для каждого эксперимента.Мухи и генетика
Мух выращивали в стандартных условиях (Ashburner, 1989), скрещивания проводили при 25 ° C. В качестве контрольных запасов мы использовали белых 1118 ( w 1118 , FBal0018186), trol :: GFP (FBal0243609) и vkg :: GFP (FBal01
) в качестве экзоновых ловушек 928. и другие., 2001). Для анализов в фоновом мутанте Ndg , Ndg Δ1,4 (Wolfstetter et al. , 2019, FBal0346270), trol :: GFP; Использовались Ndg Δ1,4 и vkg :: GFP, Ndg Δ1,4 .Мы благодарим Фондовый центр Bloomington Drosophila (NIH P40OD018537), Фондовый центр KYOTO при Киотском технологическом институте, Мориса Рингетта, Талилу Волк и Стефана Баумгартнера за присланные материалы и запас мух, а также Иветт фон Бредоу и Кристоф-Рюдигера фон Бредоу за критику комментарии к рукописи.
Эшбернер, М. (1989). Дрозофила. Лабораторный справочник. (Пресса лаборатории Колд-Спринг-Харбор). Батталья, К., Майер, У., Аумайли, М., и Тимпл, Р. (1992). Гепарансульфатный протеогликан базальной мембраны связывается с ламинином своими гепарансульфатными цепями и с нидогеном посредством участков в ядре белка. Евро. J. Biochem. 208 , 359–366 Дай, Дж., Эстрада, Б., Якобс, С., Санчес-Санчес, Б.Дж., Тан, Дж., Ма, М., Магадан-Корпус, П., Пастор-Пареха, JC, и Мартин-Бермудо, доктор медицины (2018). Рассмотрение функции Nidogen у Drosophila выявляет тканеспецифические механизмы сборки базальной мембраны.PLOS Genet. 14 , e1007483.Fox, JW, Mayer, U., Nischt, R., Aumailley, M., Reinhardt, D., Wiedemann, H., Mann, K., Timpl, R., Krieg, T., Engel, J., et al. (1991). Рекомбинантный нидоген состоит из трех глобулярных доменов и опосредует связывание ламинина с коллагеном IV типа. EMBO J. 10 , 3137–3146.Harpaz, N., and Volk, T. (2012). Новый метод получения полутонких поперечных срезов сердца дрозофилы и их мечения множественными антителами. Методы 56 , 63–68.Гогенестер Э., Юрченко П. (2013). Ламинины в сборке базальной мембраны. Cell Adh. Мигр. 7 , 56–63. Хопф, М., Геринг, В., Манн, К., и Тимпл, Р. (2001a). Картирование сайтов связывания нидогенов, фибулина-2, фибронектина и гепарина с различными модулями IG перлекана. J. Mol. Биол. 311 , 529–541. Хопф, М., Геринг, В., Рис, А., Тимпл, Р., и Хоэнестер, Э. (2001b). Кристаллическая структура и мутационный анализ перлекан-связывающего фрагмента нидогена-1. Nat. Struct.Биол. 8 , 634–640.Hynes, R.O. (2012). Эволюция внеклеточного матрикса многоклеточных животных. J. Cell Biol. 196 , 671–679. Хайнс, Р.О., и Чжао, К. (2000). Эволюция клеточной адгезии. J. Cell Biol. 150 , F89 – F96.Манн, К., Дойцманн, Р., Аумайли, М., Тимпл, Р., Раймонди, Л., Ямада, Ю., Пан, Т.С., Конвей, Д., и Чу, ML (1989). Аминокислотная последовательность нидогена мыши, многодоменного белка базальной мембраны с активностью связывания ламинина, коллагена IV и клеток.EMBO J. 8 , 65–72. Мартин, Д., Зусман, С., Ли, X., Уильямс, Э.Л., Кхаре, Н., ДаРоча, С., Чике-Эрисманн, Р., и Баумгартнер, С. (1999). wing blister, Новая α-цепь ламинина дрозофилы, необходимая для клеточной адгезии и миграции во время эмбрионального и воображаемого развития. J. Cell Biol. 145 . Мартинек, Н., Зоу, Р., Берг, М., Содек, Дж., И Рингетт, М. (2002). Эволюционная консервация и ассоциация SPARC с базальной пластинкой у Drosophila. Dev. Genes Evol. 212 , 124–133.Морин X., Данеман Р., Завортинк М. и Чиа У. (2001). Стратегия белковой ловушки для обнаружения GFP-меченых белков, экспрессируемых из своих эндогенных локусов у Drosophila. Proc. Natl. Акад. Sci. U. S. A. 98 , 15050–15055.Müller, H.-A.J. (2008). Иммуномечение эмбрионов. In Drosophila — Methods and Protocols, (Humana Press), стр. 207-218 Рейнхардт, Д., Манн, К., Ништ, Р., Фокс, Дж. У., Чу, М.Л., Криг, Т., и Тимпл, Р. . (1993). Картирование сайтов связывания нидогена для коллагена типа IV, гепарансульфат-протеогликана и цинка.J. Biol. Chem. 268 , 10881–10887. Вольфстеттер, Г., и Хольц, А. (2012). Роль LamininB2 (LanB2) в дифференцировке мезодермы у дрозофилы. Клетка. Мол. Life Sci. 69 , 267–282.Wolfstetter, G., Shirinian, M., Stute, C., Grabbe, C., Hummel, T., Baumgartner, S., Palmer, RH, and Holz, A. (2009) . Слияние круговых и продольных мышц у Drosophila не зависит от энтодермы, но дальнейшая дифференцировка висцеральных мышц требует тесного контакта между мезодермой и энтодермой.Мех. Dev. 126 , 721–736.Вольфстеттер, Г., Далиц, И., Пфайфер, К., Тёпфер, У., Альт, Дж. А., Пфайфер, округ Колумбия, Лейкс-Харлан, Р., Баумгартнер, С., Палмер, RH, и Holz, A. (2019). Характеристика нидогена / энтактина дрозофилы выявляет роль в стабильности базальной мембраны, барьерной функции и формировании паттерна нервной системы. Разработка 146 , dev168948. Ярницкий Т., Фольк Т. (1995). Ламинин необходим для развития сердца, соматических мышц и кишечника у эмбриона дрозофилы.Dev. Биол. 169 , 609–618.Эта работа была поддержана Deutsche Forschungsgemeinschaft (Ho-2559 / 5-1 — AH).
Уве Тёпфер: концептуализация, исследование, методология, формальный анализ, курирование данных, проверка, визуализация, написание — первоначальный черновик, написание — обзор и редактирование
Энн Хольц: концептуализация, расследование, получение финансирования, ресурсы, надзор, проверка, написание — просмотр и редактирование.
Стивен Мэриголд и анонимный
Получено: 13 апреля 2020 г.
Получено: 1 мая 2020 г.
Принято: 15 января 1970 г.
Опубликовано: 17 мая 2020 г.
© 2020 by авторы.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution 4.0 International (CC BY 4.0), которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Töpfer, U; Хольц, А (2020). Анализ состава внеклеточного матрикса висцеральных мышц мутантных личинок Nidogen у Drosophila . микропубликация Биология. 10.17912 / micropub.biology.000251.Загрузить: RIS BibTeX
Extracellular Matrix Proteins & Antibodies
Внеклеточный матрикс (ЕСМ) — это неклеточный компонент, который обеспечивает структурную основу для окружающих клеток.Он также предоставляет критическая биохимическая поддержка, необходимая для внутриклеточной коммуникации, дифференциации и гомеостаза.SouthernBiotech предлагает очищенные белки ЕСМ, включая коллагены, фибронектин и ламинин.
Коллаген
Коллаген является основным структурным белком внеклеточного пространства и наиболее распространенным белком в ВКМ.Они разделены на два класса — фибриллярные (типы I, II, III, V) и нефибриллярные (типы IV, VI).
Наши высокоочищенные коллагены человека, крупного рогатого скота, мыши и крысы проходят проверку качества с помощью SDS-PAGE и / или ELISA для обеспечения чистоты. Они есть обычно используется в качестве стандартов в таких приложениях, как ELISA и в культуре клеток, для облегчения прикрепления, роста, дифференциации клеток, миграция и морфогенез тканей.
Фибронектин
Фибронектин представляет собой высокомолекулярный гликопротеин ЕСМ, состоящий из двух почти идентичных мономеров (220-250 кДа), связанных дисульфидом. облигации. Он присутствует в двух формах — растворимой форме (основной компонент плазмы крови, который в основном продуцируется гепатоцитами). и нерастворимая форма (основной компонент ЕСМ, который секретируется различными клетками перед сборкой в нерастворимую матрица).Связываясь с другими компонентами ЕСМ, такими как коллаген, интегрины и гепарин, фибронектин играет важную роль в адгезии, миграции, росте и дифференцировке клеток.
Наш высокоочищенный фибронектин проходит проверку качества с помощью SDS-PAGE для обеспечения чистоты.
Ламинин
Ламинины представляют собой высокомолекулярные белки ЕСМ, которые являются основным компонентом базальной пластинки базальной мембраны.Они состоят из α-цепи, β-цепи и γ-цепи, которые образуют крестообразную структуру, которая связывается с клеточными мембранами и другими белками ECM. Ламинины способствуют прикреплению, дифференцировке и подвижности клеток.
Наш высокоочищенный ламинин проходит проверку качества с помощью SDS-PAGE и ELISA, чтобы гарантировать чистоту. Он использовался при адгезии и миграции анализы.
SouthernBiotech предлагает поликлональные и моноклональные антитела к белкам ЕСМ, включая коллагены, фибронектин и матрикс. металлопротеиназы. Они часто используются в ELISA, иммуногистохимии / иммуноцитохимии, электронной микроскопии, вестерн-блоттинг и иммунопреципитация.
.

 При меньшей потребности в протеине, можно смешать половину мерной ложки с 4 унциями (моё примечание: 120 мл) воды или молока. Обратите внимание на дополнительные калории, когда смешиваете с молоком. Употребляйте матрикс два-три раза в день для удовлетворения вашей потребности в протеине. Запомните, лучшее время для употребления протеина: сразу после пробуждения утром; после интенсивной физической активности, такой как силовая тренировка; и перед сном. Матрикс отлично смешивается ложкой и имеет прекрасный вкус…гарантированно!
При меньшей потребности в протеине, можно смешать половину мерной ложки с 4 унциями (моё примечание: 120 мл) воды или молока. Обратите внимание на дополнительные калории, когда смешиваете с молоком. Употребляйте матрикс два-три раза в день для удовлетворения вашей потребности в протеине. Запомните, лучшее время для употребления протеина: сразу после пробуждения утром; после интенсивной физической активности, такой как силовая тренировка; и перед сном. Матрикс отлично смешивается ложкой и имеет прекрасный вкус…гарантированно! Таким образом, это незаменимый компонент для употребления после тренировки, позволяя быстро восстанавливать мышцы и предупреждать повышение уровня кортизола, то есть предупреждать катаболизм.
Таким образом, это незаменимый компонент для употребления после тренировки, позволяя быстро восстанавливать мышцы и предупреждать повышение уровня кортизола, то есть предупреждать катаболизм.




 09.2020 17:26
09.2020 17:26 01.2020 14:05
01.2020 14:05 12.2019 16:07
12.2019 16:07 За эти деньги качество более чем хорошее
За эти деньги качество более чем хорошее 09.2019 18:27
09.2019 18:27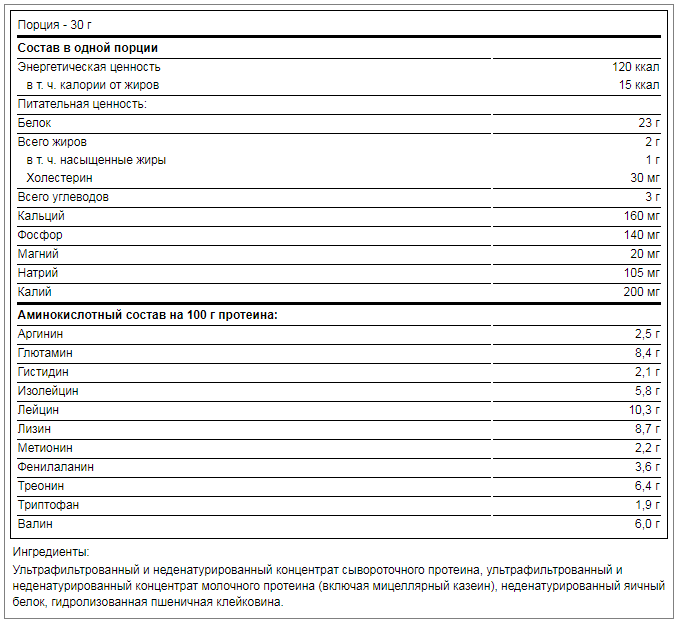 А “печеньки” пьются очень долго без проблем.
А “печеньки” пьются очень долго без проблем.