Строение белков — урок. Химия, 8–9 класс.
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Аминокислотные остатки соединены в макромолекулах белков пептидной группой −NH−CO−, поэтому белки относят к полипептидам.
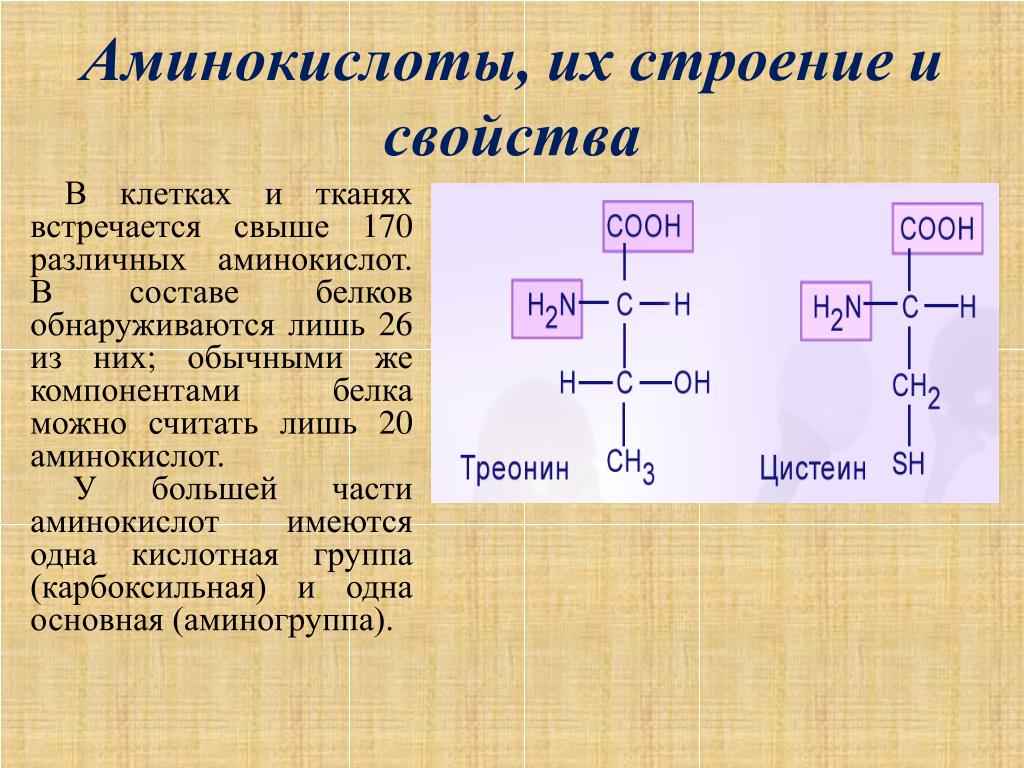
В состав белков входят двадцать аминокислот строения Nh3−C|H−COOHR. Аминокислотные остатки соединяются в макромолекулы белков в различной последовательности. Число аминокислотных остатков в молекулах тоже может быть разное. Поэтому многообразие белков практически безгранично. Каждый организм на Земле имеет свой собственный неповторимый набор белков.
Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов.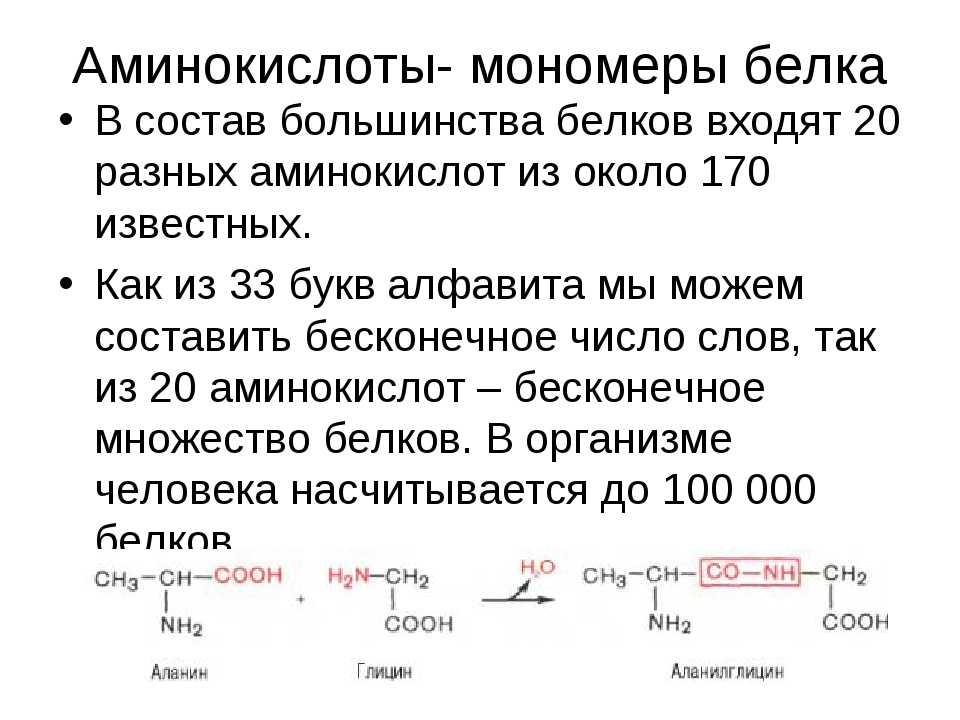 Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Последовательность аминокислотных остатков в макромолекуле называется первичной структурой белка.
Первичная структура
Существуют вторичная (спираль) и третичная (клубок) структуры белковых молекул. Они образуются в результате внутримолекулярного взаимодействия частей полипептидной цепи.
Вторичная структура
Третичная структура
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.
Четвертичная структура
Источники:
Рудзитис Г. Е., Фельдман Ф. Г. Химия. 9 класс. М.: Просвещение, 2009. — 170 с.
Габриелян О. С. Химия. 9 класс. Учебник для общеобразовательных учреждений.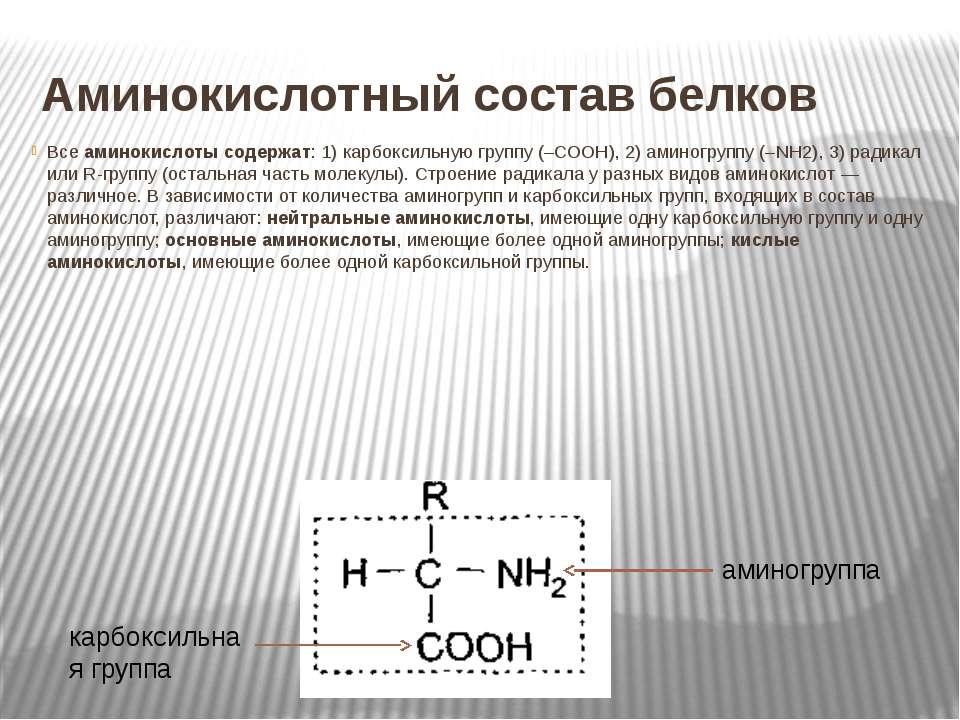 М.: Дрофа, 2011. — 226 с.
М.: Дрофа, 2011. — 226 с.
Вишневская Е. И., Ельницкий А. П. и др. Химия. 9 класс. Минск: Нар. асвета, 2012. — 199 с.
Роль аминокислот в программах омоложения
Аминокислоты — мономеры белков.В состав белков входят 20 разновидностей АК. Они связываются между собой пептидными связями и образуют молекулу полимера — полипептид.
Как воздействуют аминокислоты на процессы похудения?
Помощь белковых «кирпичиков» состоит в следующем:
- «разгоняют» скорость метаболизма;
- сжигают излишки жира в зонах его скопления;
- снижают аппетит;
- уменьшают количество холестерина и сахара;
- являются источником дополнительной энергии;
- относятся к группе антиоксидантов;
- наращивают мышечные ткани, вместо жировых прослоек;
- помогают сбросить вес в ходе тренировок.
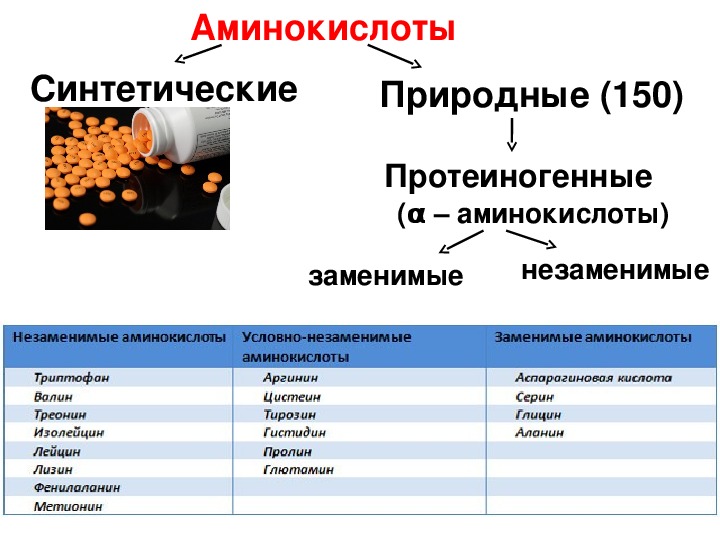
 ). 12 из них относятся к заменимым, которые синтезируются в ходе метаболизма самим организмом и 8 являются незаменимыми, поступающими извне.
). 12 из них относятся к заменимым, которые синтезируются в ходе метаболизма самим организмом и 8 являются незаменимыми, поступающими извне. Какие же аминокислоты жизненно необходимы для человека?
1) Незаменимые аминокислоты:
- Валин
- Лейцин
- Изолейцин
- Лизин
- Метионин
- Треонин
- Фенилаланин
- Триптофан
- Гликокол
- Аланин
- Цитруллин
- Серин
- Цистин
- Аспарагиновая кислота
- Глютаминовая кислота
- Тирозин
- Пролин
- Оксипролин
- Аргинин
- Гистидин

L-карнитин же, который принято считать жиросжигателем, тоже относится формально к аминокислотам. На самом деле, он участвует в процессе похудения, доставляя жиры к месту их расщепления интенсивнее, чем этот процесс идет обычно, потому и усиливает эффект физических нагрузок для похудения.
«Содержание незаменимых аминокислот в пищевых продуктах»:
- Лизин: злаковые и молочные продукты, яйца, орехи, рыба
- Гистидин: бобовые и мясные продукты
- Триптофан: кунжут, финики, бананы
- Треонин: яйца и молочные продукты
- Фенилаланин: крупы, бобовые, мясные продукты
Убихинон (Q10) — присутствует в любой клетке организма.
 Защищает организм от воздействия свободных радикалов. Обязательная составляющая часть программ лечения ожирения, гипертонии, диабета. Но главное, способно замедлять процессы старения
Защищает организм от воздействия свободных радикалов. Обязательная составляющая часть программ лечения ожирения, гипертонии, диабета. Но главное, способно замедлять процессы старенияТерапевтический эффект после 45 лет — 60-90 мг в сутки
Креатин — белок, поставляющий энергию для сокращения мышц;
Организм синтезирует этот белок из аминокислот аргинина, глицина, метионина. Терапевтический эффект наступает при приеме 20 г в сутки.
Повышение качества жизни и энергичности
Следить за рационом питания, в котором, в котором много белка и мало простых сахаров
Необходимы: Магний 400-800 мг, Глутатион 0,5-1г, Витамин С3-5 г, Витамин Е 600-1000 МЕ (высвобождает эстроген из жировых клеток).
Целлюлит — это интоксикация соединительно -тканного матрикса дермы и гиподермы. Причина — нарушение клеточного дренажа, циркуляторного,иммунного, гормонального нарушения в организме.
Необходимо улучшить крово-и лимфообращение, стимулировать метаболизм адипоцитов, проводить детоксикации подкожно-жировой клетчатки, активизировать липолиз, нормализовать гормональную сферу.
Посмотреть бесплатный вебинар о роли аминокислот в программах омоложения и коррекции фигуры.
Сколько аминокислот входит в состав белка
Опубликовано: 20.03.2020Время на чтение: 4 минуты1730
Какие аминокислоты входят в состав белкаАминокислоты, или аминокарбоновые, кислоты (АМК) — очень крупная группа соединений. Известное на сегодня количество таких веществ, существующих природе, достигает пятисот. Но в клетках и тканях человеческого организма их намного меньше: порядка 170. А в составе белка, ответственного за передачу генетической информации, совсем «мало» — двадцать три. Наиболее важными для организма человека являются следующие аминокарбоновые соединения:
- аланин,
- аспарагин,
- валин,
- гамма-аминомасляная кислота,
- глютаминовая кислота,
- глютамин,
- глютатион,
- глицин,
- гистидин,
- диметилглицин,
- изолейцин,
- карнитин,
- лейцин,
- лизин,
- метионин,
- орнитин,
- пролин,
- серин,
- таурин,
- треонин,
- триптофан,
- тирозин,
- фенилаланин,
- цитруллин,
- цистеин и цистин.

Каждая аминокислота играет собственную роль как в синтезе белка, так и в других процессах, определяющих здоровье человека, его уровень энергии, умственные способности и пр.
Как посчитать количество
Сколько аминокислот в белке, определяется самим белком. В полноценном протеине (он так и называется — полноценный) обнаруживается весь аминокарбоновый состав. В неполноценном отсутствует несколько АМК. Кроме того, белки могут быть простыми (в их состав входят только аминокислоты) и сложными (аминокислотный «комплекс» дополнен другими химическими соединениями). Но во всех случаях именно аминокарбоновые кислоты являются основой для построения молекулы протеина, и без этих веществ невозможна правильная работа организма.
Весь «набор» аминокислот можно распределить в такие группы:
- Заменимые. Эти вещества, входящие в состав белка, могут синтезироваться в организме человека из веществ, которые поступают вместе с пищей.
 При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент. - Незаменимые. Эти аминокислоты неспособны синтезироваться организмом и могут поступать в него только в готовом виде, вместе с пищей.
- Условно-незаменимые. В эту группу входят аминокислоты, которые в норме синтезируются в организме человека. Но после перенесенных заболеваний, при высоком уровне стресса, проживании в неблагоприятной экологической обстановке и др. их синтез резко снижается или прекращается вовсе.
Когда речь заходит о белке в организме человека, с ним ассоциируют набор мышечной массы. Соответственно, белок рассматривают в качестве «топлива» для мышц. Но это лишь одна из функций протеина, который в теле человека представлен огромным разнообразием. Белок — это комплекс аминокислот, соединенных между собой пептидами.
- коллаген — естественный «каркас», обеспечивающий упругость кожи, входящий в состав хрящевой ткани и пр.;
- нейромедиаторы — соединения, которые обеспечивают правильную интерпретацию нервных сигналов и их передачу между всеми органами и тканями;
- гормоны — вещества, регулирующие все функции организма: от работы репродуктивной системы до психических реакций.
Этот список можно еще продолжать.
Причины дефицита аминокислот
Даже при современном уровне доступности любой информации продолжает существовать заблуждение о том, что весь набор аминокислот можно получить только из пищи животного происхождения.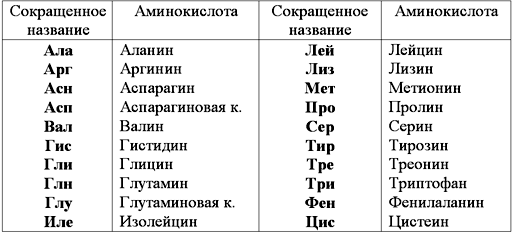 На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
Вегетарианство. Людям, придерживающимся принципов веганства, следует более тщательно контролировать свой рацион, чтобы гарантированно получать из пищи незаменимые аминокислоты.
Высокие нагрузки. Еще одна группа риска — люди, подвергающиеся чрезмерным физическим или психическим нагрузкам. При таких обстоятельствах расход аминокислот существенно выше, так как им приходится восстанавливать клеточные и тканевые ресурсы, израсходованные во время тренировок или стресса.
Некоторые заболевания. Они также могут быть причиной дефицита аминокислот. В частности, нарушения всасывания питательных веществ, при которых определенные вещества, потребляемые вместе с пищей, проходят через организм «транзитом» и неспособны принять участие в синтезе аминокислот или восполнении их дефицита.
Контроль над сбалансированным и регулярным питанием — основа поддержания аминокислотного состава на нужном уровне. Но это не всегда возможно, и вот почему. Если использовать только продукты питания, невозможно положить в тарелку только аминокислоты. Приходится учитывать еще и калорийность приема пищи, содержание в блюде жиров, углеводов, клетчатки и пр. В итоге число потребленных аминокислот может ограничиваться двумя-тремя, но быть серьезно «обремененным» лишними калориями. Эта проблема особенно актуальна для спортсменов, людей, следящих за фигурой, и тех, кому жирная или калорийная пища нежелательна с точки зрения здоровья.
Niteworks от HERBALIFE Nutrition
В описанных выше ситуациях на помощь могут прийти специальные добавки, например Niteworks от HERBALIFE Nutrition*. В состав продукта входят аминокислоты, поддерживающие правильную работу сердца и сосудов, повышающие эластичность стенок сосудов.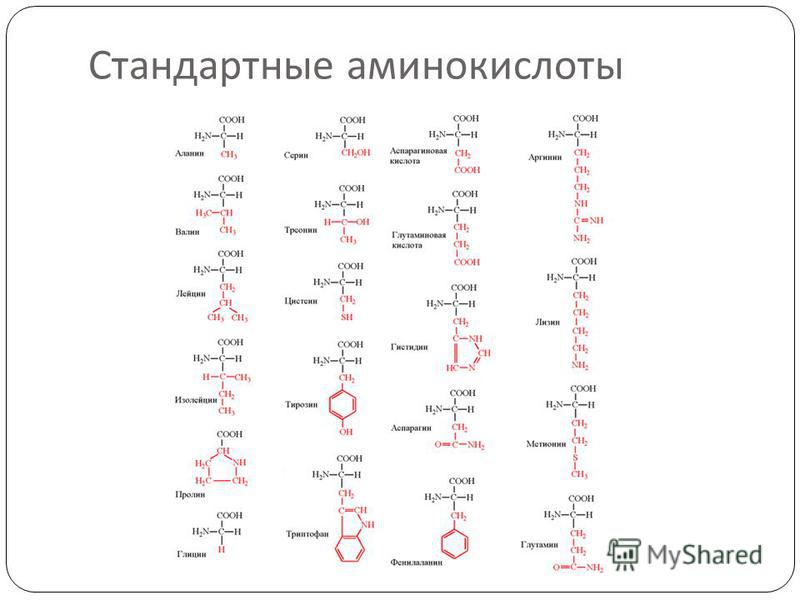 Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
При дефиците аминокислот в организме могут возникать следующие неприятные симптомы:
- быстрая умственная и физическая утомляемость;
- мышечная слабость;
- боль в суставах, нарушение их подвижности;
- отеки;
- «необъяснимые» приступы голода;
- снижение остроты зрения;
- ухудшение состояния волос, ногтей, кожи.
На перечисленные симптомы особенно важно обратить внимание, если вы длительное время придерживаетесь ограничительной диеты, испытываете стрессы, подвергаетесь тяжелым физическим нагрузкам, перенесли какое-либо заболевание. Но во всех случаях следует предварительно проконсультироваться с врачом, так как признаки белкового дефицита неспецифичны и схожи с симптомами ряда заболеваний.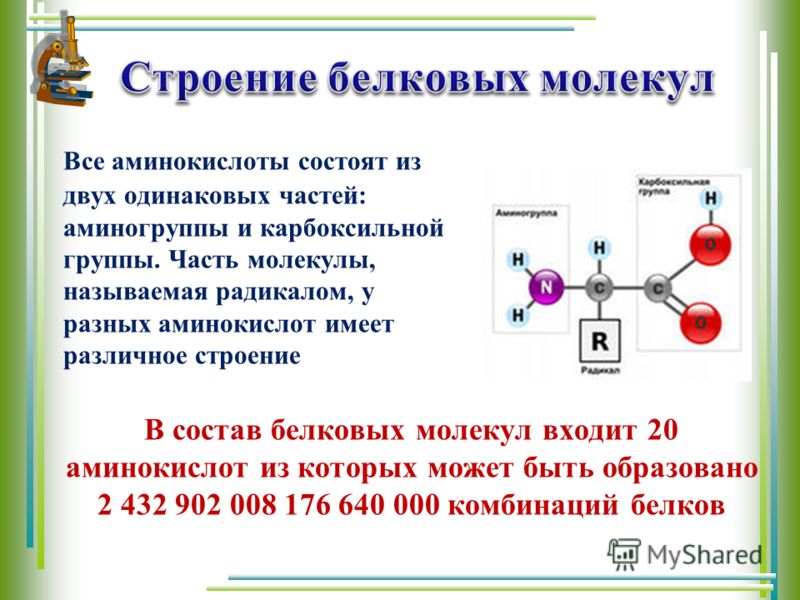
* БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Узнайте, как питатьсясбалансированно
и контролировать
свой весУзнать больше 2020-03-20
Автор: Будь в Форме
Оцените материал!
Добавить отзыв
Состав белков — Справочник химика 21
Важнейшее значение для питания растений имеют азот, фосфор и калий, от которых зависят обмен веществ в растении и его рост. Азот входит в состав белков и хлорофилла, принимает участие в фотосинтезе. Соединения фосфора играют важную роль в дыхании и размножении растений, участвуя в процессах превращения углеводов и азотсодержащих веществ. Калий регулирует жизненные процессы, происходящие в растении, улучшает водный режим, способствует обмену веществ и образованию углеводов в тканях растений. [c.240]
[c.240] Фосфатная группа легко образует ряд ковалентных соединений от простых эфиров (триметил- или триэтилфосфаты) до сложных макромолекул (ДНК или РНК)- Многие из этих соединений важны в биологическом отношении, и их роль никак не связана со структурой ДНК и РНК. Действительно, точно так же, как ряд аминокислот не обязательно входит в состав белков [c.118]
Сульфидная сера имеет большое биологическое значение и в виде группы SH или -S—S- входит в состав белков и аминокислот (цистеин, цистин, глутатион). Сульфидные (дисульфидные) связи поддерживают (наряду с водородными связями) вторичную структуру белковой цепи. [c.192]
Аминокислоты отличаются друг от друга пе только величиной, но и числом входящих в них групп ЫНг и СООН, а также наличием в их составе атомов других элементов, таких, как 8, Вг, I. В настоящее время открыто около 26 различных аминокислот, входящих в состав белков. Примерно половина этого количества содержит лишь по одной группе Nh3 и СООН они являются простыми, или моноаминокислотами. Другие содержат две группы СООН на одну аминогруппу и обладают характерными кислыми свойствами. Третья группа аминокислот обладает явно выраженными основными свойствами, она содержит одну группу СООН на две аминогруппы. Кроме того, в состав белков входят несколько циклических аминокислот, более сложных по составу и структуре их радикала К. [c.337]
Примерно половина этого количества содержит лишь по одной группе Nh3 и СООН они являются простыми, или моноаминокислотами. Другие содержат две группы СООН на одну аминогруппу и обладают характерными кислыми свойствами. Третья группа аминокислот обладает явно выраженными основными свойствами, она содержит одну группу СООН на две аминогруппы. Кроме того, в состав белков входят несколько циклических аминокислот, более сложных по составу и структуре их радикала К. [c.337]
В состав белков входят углерод, водород, кислород, азот, v часто сера, фосфор, нелезо. Молекулярные массы белков очень велики — от 1500 до нескольких миллионов. [c.498]
Хотя все аминокислоты, входящие в состав белков, имеют ь-конфигурацию, некоторые аминокислоты, не участвующие в построении белковых молекул, относятся к о-аминокислотам. Значение конфигурации для построения и функционирования белков будет понятно при более подробном обсуждении биоорганических процессов.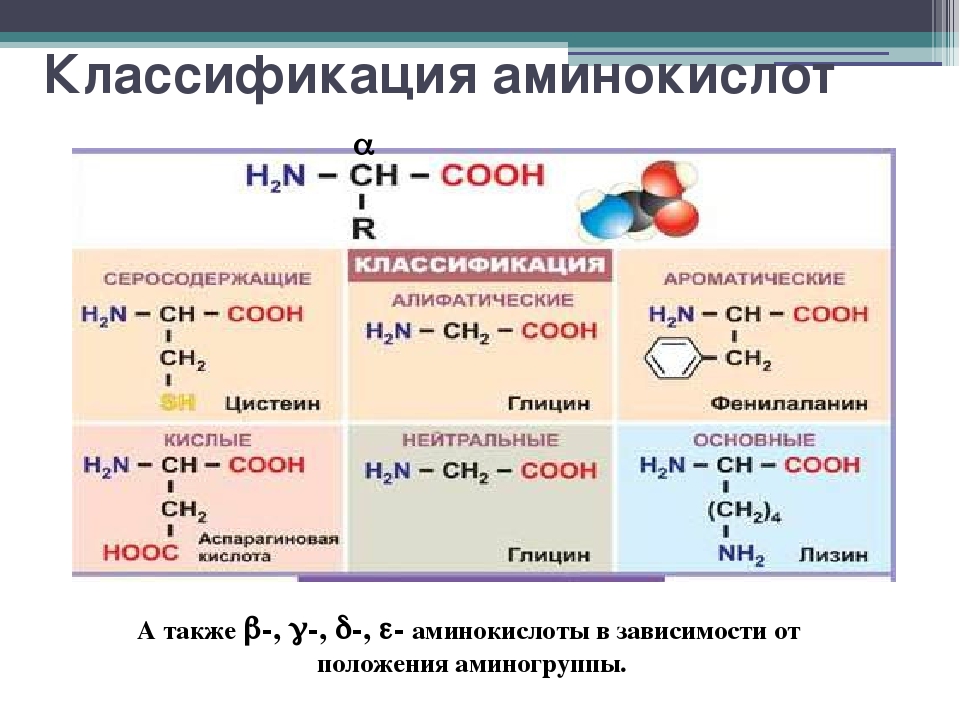 [c.31]
[c.31]
Электрокинетические явления находят практическое применение. Так, с помощью электрофореза проводят формование различных изделий из тонких взвесей с последующим их спеканием. Метод электрофореза щироко применяют для разделения, выделения и исследования биоколлоидов, особенно белков. Простой его вариант, называемый электрофорезом на бумаге, состоит в том, что нанесенное на полоску бумаги пятно исследуемой смеси белков разделяется на компоненты по величине их заряда, а следовательно, и скорости движения в поле постоянного электрического тока. Этим методом исследуют качественный и количественный состав белков крови и других биологических жидкостей. [c.308]
Круговорот серы в природе поддерживается микроорганизмами. При их участии сульфиды окисляются до сульфатов, сульфаты поглощаются живыми организмами, где сера восстанавливается и входит в состав белков. При гниении отмерших организмов сера возвращается в круговорот.
 [c.113]
[c.113]Стереохимические отнощения в ряду природных аминокислот, входящих в состав белков, в настоящее время достаточно ясны. В их исследовании можно различить две стадии — во-первых, установление стерических отношений между аминокислотами и, во-вторых, установление абсолютной конфигурации. Решающую роль в изучении обеих проблем сыграло химическое превращение различных соединений друг в друга -без затрагивания асимметрического атома углерода, иными словами, непосредственное установление конфигурационного соответствия химическим путем. [c.365]
Следует отметить, что все аминокислоты, входящие в состав белков, относятся к -ряду. [c.222]
О том, как происходил отбор структур, каков его механизм, сказать довольно трудно. Но этот процесс оставил нам своего рода. музей. Подобно тому как из 107 химических элементов только 6 органогенов да 10—15 других элементов отобраны природой, чтобы составить основу биосистем, так же в результате эволюции происходил тщательный отбор и химических соединений. Из миллионов органических соединений в построении живого участвуют лишь несколько сотен из 100 известных аминокислот в состав белков входит только 20 лишь четыре нуклеотида лежат в основе-всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах. [c.196]
Из миллионов органических соединений в построении живого участвуют лишь несколько сотен из 100 известных аминокислот в состав белков входит только 20 лишь четыре нуклеотида лежат в основе-всех сложных полимерных нуклеиновых кислот, ответственных за наследственность и регуляцию белкового синтеза в любых живых организмах. [c.196]
По своей природе каждое звено — остаток одной нз аминокислот. Они образуют полипептидные цепи, из которых каждая содержит десятки и даже сотни остатков различных амииокислот. Все другие аминокислоты, входящие в состав белка, относятся к а-аминокислотам, у которых аминогруппа ЫНг связана с тем же атомом углерода, с которым связана и карбоксильная группа СООН. Все -аминокислоты (за исключением гетероциклических) могут быть выражены общей формулой [c.337]
Три важных фактора — индуктивный эффект, эффект поля и резонансный эффект — могут сильно влиять на поведение органических кислот и оснований, включая и биологически важные а-аминокислоты. В водном растворе, обычной среде нротекания биологических реакций, эти эффекты обусловливают большое разнообразие свойств, так что процессы диссоциации могут происходить во всем диапазоне pH. Это валпринимать участие в кислотно-основных превращениях. Действительно, в упрощенном виде диссоциацию аминокислот можно рассматривать как миниатюрную модель диссоциации белка. В биохимических реакциях важные функции выполняют белки, и аналогия с аминокислотами может слу кить основой для понимания процессов передачи протонов. Однако такая модель слишком упрощена. Она не учитывает кооперативные взаимодействия. Например, как поведет себя лизин при диссоциации под действием линейно-расположенных положительно заряженных аминокислотных остатков, входящих в состав белка Далее, каким образом близко расположенная гидрофобная область белковой молекулы (т. е. область с более Ш13-кой диэлектрической проницаемостью) влияет на ее диссоциацию в данном химическом процессе То, что в этом случае можно ожидать значительных изменений, видно из поведения глицина при диссоциации в среде с низкой диэлектрической проницаемостью например, в 95%-ном этаноле (рКа карбоксильной группы глицина равен 3,8, а аминогруппы 10,0).
В водном растворе, обычной среде нротекания биологических реакций, эти эффекты обусловливают большое разнообразие свойств, так что процессы диссоциации могут происходить во всем диапазоне pH. Это валпринимать участие в кислотно-основных превращениях. Действительно, в упрощенном виде диссоциацию аминокислот можно рассматривать как миниатюрную модель диссоциации белка. В биохимических реакциях важные функции выполняют белки, и аналогия с аминокислотами может слу кить основой для понимания процессов передачи протонов. Однако такая модель слишком упрощена. Она не учитывает кооперативные взаимодействия. Например, как поведет себя лизин при диссоциации под действием линейно-расположенных положительно заряженных аминокислотных остатков, входящих в состав белка Далее, каким образом близко расположенная гидрофобная область белковой молекулы (т. е. область с более Ш13-кой диэлектрической проницаемостью) влияет на ее диссоциацию в данном химическом процессе То, что в этом случае можно ожидать значительных изменений, видно из поведения глицина при диссоциации в среде с низкой диэлектрической проницаемостью например, в 95%-ном этаноле (рКа карбоксильной группы глицина равен 3,8, а аминогруппы 10,0). Можно было бы подумать, что в этом случае но кислотности глицин близок к уксусной кислоте, но это не так, поскольку для последней р/( равен 7,1. [c.42]
Можно было бы подумать, что в этом случае но кислотности глицин близок к уксусной кислоте, но это не так, поскольку для последней р/( равен 7,1. [c.42]
Микроорганизмы могут быть ауксотрофными по одной или более из 20 аминокислот, которые входят в состав белков. Часто аминокислоты заменяют пептидами с низкой молекулярной массой. Пептиды действуют как эффективный переносчик аминокислоты в клетку микроорганизма. [c.283]
В результате гидролиза белков образуются смеси а-ами-нокислот. В состав белков входят до 25 различных аминокислот. Определенная последовательность аминокислот, реализующаяся в линейной структуре макромолекулы, как это было показано на схеме, определяет так называемую [c.170]
Глицин (а-аминоуксусная кислота, гликокол) — СНа — СООН — однй из самых распространенных в природе аминокислот, входит в состав белков бесцветные кристаллы, т. пл. 232— 236° С, растворимы в воде. Г. выделяют из желатина, фиброина, шелка, а также синтезируют. Г. применяется для органического синтеза, для приготовления буферных растворов, в аналитической химии в качестве стандарта для определения аминокислот, для количественного определения Си, Ag. [c.78]
Г. применяется для органического синтеза, для приготовления буферных растворов, в аналитической химии в качестве стандарта для определения аминокислот, для количественного определения Си, Ag. [c.78]
Сероводород — бесцветный газ с неприятным запахом (тухлых яиц). I л его при нормальных условиях весит 1,54 г. Образуется при разложении органических веществ без доступа воздуха, за счет серы, входящей в состав белков и других органических соединений (в частности, выделяется при порче яиц). Сероводород ядовит. Вдыхание значительных количеств его опасно (может вызвать смерть). [c.503]
В состав белка гемоглобина, переносящего кислород и диоксид углерода в крови млекопитающих. [c.22]
Следовательно, необходимо, чтобы состав белков мог меняться в широких пределах, так чтобы они узнавали различные субстраты и взаимодействовали с ними. Для некоторых белков требуется присутствие других соединений (небелковой природы) для участия в процессах узнавания и превращения. Такие соединения называются коферментами. Поэтому можно заранее сказать, что катализаторы белковой природы, или ферменты, должны обладать высокой степенью упорядоченности и организации. Кроме того, вся необходимая информация должна быть записана наиболее компактным образом. Такие упорядоченные биополимеры, с помощью которых работает и самовоспроизводится двигатель внутреннего сгорания клетки, также должны совершеиио точно воспроизводиться. Было установлено, что действие ферментов высокоспецифичио структуре субстратов. Следовательно, информация о молекулярной организации белков (ферментов) должна надежно храниться, будучи записанной на стабильном, относительно консервативном языке. И вот тут-то выходят на сцену нуклеиновые кислоты. Значит, существует еще одно соответствие [c.15]
Такие соединения называются коферментами. Поэтому можно заранее сказать, что катализаторы белковой природы, или ферменты, должны обладать высокой степенью упорядоченности и организации. Кроме того, вся необходимая информация должна быть записана наиболее компактным образом. Такие упорядоченные биополимеры, с помощью которых работает и самовоспроизводится двигатель внутреннего сгорания клетки, также должны совершеиио точно воспроизводиться. Было установлено, что действие ферментов высокоспецифичио структуре субстратов. Следовательно, информация о молекулярной организации белков (ферментов) должна надежно храниться, будучи записанной на стабильном, относительно консервативном языке. И вот тут-то выходят на сцену нуклеиновые кислоты. Значит, существует еще одно соответствие [c.15]
Напишите формулы наиболее важных а-аминокислот, которые входят в состав белков. Дайте названия этим аминокислотам. [c.91]
Наиболее важными для жизни органическими соединениями являются белковые вещества. Повсюду, где мы встречаем жизнь, мы находим, что она связана с -каким-либо белковым телом (Энгельс). В состав белков, кроме углерода (50—55%), водорода (6,5—7,5), кислорода (19—24) и азота (15—19), входит обычно сера (до 2,5%), а иногда и некоторые другие элементы (Р, Fe, u и т. д.). Структурные формулы природных белковых веществ известны только для отдельных их представителей. Изучение продуктов их распада показало, что основную роль при образовании белковых молекул играют органические соединения, содержащие в своем составе группы Nh3 и СООН, так называемые аминокислоты. Соединения эти, характеризующиеся одновременным наличием у них функций основной (из-за группы ЫНг) и кислотной (из-за группы СООН), способны присоединяться друг к другу, образуя сложные частицы, приближающиеся по свойствам к молекулам простейших белков. Таким образом, искусственный синтез важнейших натуральных белков еще не осуществлен, но на пути к нему уже сделаны некоторые важные шаги. [c.541]
Повсюду, где мы встречаем жизнь, мы находим, что она связана с -каким-либо белковым телом (Энгельс). В состав белков, кроме углерода (50—55%), водорода (6,5—7,5), кислорода (19—24) и азота (15—19), входит обычно сера (до 2,5%), а иногда и некоторые другие элементы (Р, Fe, u и т. д.). Структурные формулы природных белковых веществ известны только для отдельных их представителей. Изучение продуктов их распада показало, что основную роль при образовании белковых молекул играют органические соединения, содержащие в своем составе группы Nh3 и СООН, так называемые аминокислоты. Соединения эти, характеризующиеся одновременным наличием у них функций основной (из-за группы ЫНг) и кислотной (из-за группы СООН), способны присоединяться друг к другу, образуя сложные частицы, приближающиеся по свойствам к молекулам простейших белков. Таким образом, искусственный синтез важнейших натуральных белков еще не осуществлен, но на пути к нему уже сделаны некоторые важные шаги. [c.541]
Веществами, из которых образуются иутресцин и кадаверин, являются две входящие в состав белков аминокислоты — аргинин и лизин (стр. 353). При разложении аргинина сначала получается орнитин, который затем под влиянием бактерий декарбоксилируется до путресцина подобным же образом происходит отщепление двуокиси углерода от лизина, приводящее к образованию кадаверина (стр. 354). [c.311]
353). При разложении аргинина сначала получается орнитин, который затем под влиянием бактерий декарбоксилируется до путресцина подобным же образом происходит отщепление двуокиси углерода от лизина, приводящее к образованию кадаверина (стр. 354). [c.311]
Некоторые а-аминокислоты, входящие в состав белков [c.281]
В данном случае и кислотные, и основные функции определяются свойствами одной и той же группы ОН . Но существуют ам-фолиты и другого типа. Их кислотные и основные свойства определяются нал 1чием двух различных функциональных групп. Наиболее характерным примером соединений подобного типа М01 ут служить аминокислоты ЫНгНСООН. Аминокислоты входят и состав белков, поэтому исследование последних невозможно без учета явлений, обусловленных амфотерными свойствами аминокислот. [c.509]
Ответ. Состав белка кератина характеризуется сравнительно высоким содержанием цистина, ys-S y (до 8-12%). При воздействии на меж- и внутримолекулярные дисульфидные связи Н2О2 или другого окислителя происходит их разрыв с образованием сульфоцистеиновых групп [c. 358]
358]
Новейшие работы показали, что белковые молекулы, несмотря на их исключительную сложность, состоят из комбинаций сравнительно небольшого числа а-аминокислот. Тем не менее и. это количество уводит нас в теорию больших чисел. Известно, что в образовании белковых молекул участвует до 28 а-а-минокислот. Если допустить, что в состав белков входит лишь 10 различных аминокислот, из которых каждая встречается только один раз, то можно получить 401=3 628 800 изомерных молекул, в случае 15 различных аминокислот 15 = 1 307 947 368 ООО изомерных молекул, не считая таутомерных, скрученных, циклических и обладаклцих водородными связями форм. [c.540]
Характерной особенностью а-аминокислот является их способность взаимодействовать между собой, образуя пептидную связь. В дипептиде (соединение двух аминокислот) у одного из аминокислотных остатков имеется свободная аминогруппа, а у другого — свободная кар-боксигруппа, поэтому он может взаимодействовать с третьей аминокислотой, формируя трипептид, и т.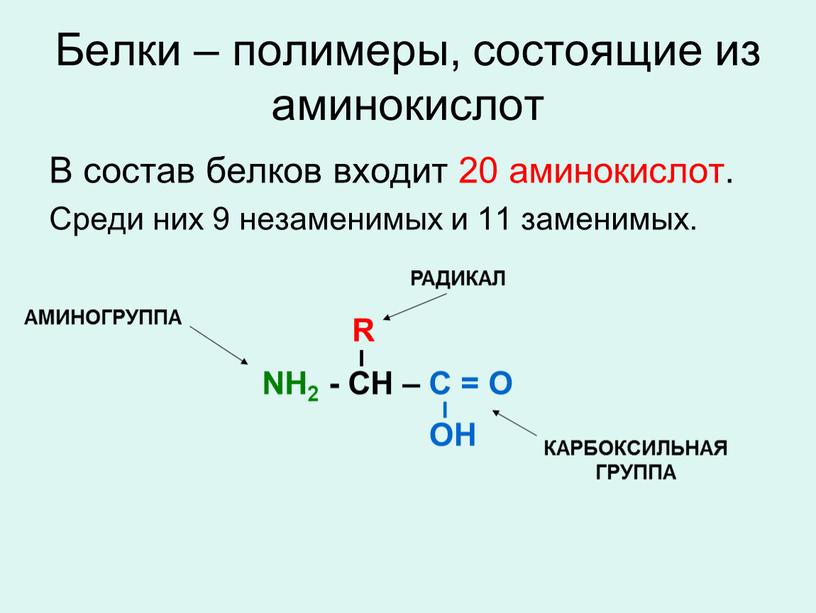 д. Полипептиды входят в состав белков. [c.362]
д. Полипептиды входят в состав белков. [c.362]
В некоторых микроорганизмах синтез пептидной связи происходит по более простому, примитивному, механизму. В этом случае пептидный синтез идет очень эффективно, хотя и в отсутствие высокоупорядоченного синтезирующего аппарата, обеспечиваемого структурами рибосомы и тРНК. Поэтому таким путем синтезируются лишь короткие белки (полипептиды), например грамицидин S [5]. Грамицидин S считается интересным антибиотиком по нескольким причинам. Во-первых, он содержит фенилаланин в D-конфигурации. d-Аминокислоты встречаются в природе очень редко, а в белках присутствуют только ь-аминокислоты. Во-вторых, грамицидин S содержит аминокислоту орнитин, которая обычно не входит в состав белков. [c.61]
Аминокислоты входят в состав белков, которые служат питательными веществами, регулируют обмен веществ, способствуют поглощению кислорода, играют важную роль в функционировании nqaBHoii системы, являются механической основой мышечной гкани, участвуют в передаче генетической информации и т. д. [c.236]
д. [c.236]
Из природных вешеств, являющихся производными пиррола, здесь следует упомянуть пролин, оксипролин и триптофан, входяпдие в состав белков, индикан, представляющий собой основное вещество индиго, многие алкалоиды, такие, как никотин, атропин и кокаин, а также красящее вещество крови и хлорофилл. [c.969]
Сера, как фосфор и азот, входит в состав белковых веществ живой клетки, поэтому совершенно необходима для синтеза органического клеточного вещества. Наиболее важным серусодвржащим компонентом клетки является аминокислота цистин, которая входит в состав белка. Атомы серы в цистине находятся в виде тиоло-вой группы (—5Н). К производным пистиыа относятся метионин, биотин, тиамин, глутатион и др. Источником серы для большинства микроорганизмов служит сульфатный ион (—8042-), тиосуль-фатный ион (—ЗгОз -). В процессе жизнедеятельности микроорганизмы восстанавливают серу до 3 . Некоторые микроорганизмы не восстанавливают сульфаты и нуждаются в восстановленной сере (как, например, сероводород и цистеин). [c.284]
[c.284]
АМИНОКИСЛОТЫ — органические (карбоновые) кислоты, содержащие одну или несколько аминогрупп. В зависимости от положения аминогруппы относительно карбоксила различают а-, Р-, 7 йминокислоты и др. Например, СНз—СН (ННз) — СООН — а-аминопро-пионовая и НгЫ—СНз—СНз—СООН — Р-аминопропионовая кислоты. Ио числу карбоксильных групп различают моно-и дикарбоновые кислоты, по числу аминогрупп — моноаминокислоты, диами-нокислсты и т. д. А. широко распространены в природе. В состав белков входят только а-А. Почти все природные А. [c.22]
НУКЛЕИНОВЫЕ КИСЛОТЫ (лат. nu leus — ядро) — высокомолекулярные органические соединения биологического происхождения, входящие в состав белков-нуклеопротоидов и играющие важную роль в процессах жизнедеятельности всех живых организмов, Н. к. построены из большого количества мононуклеотидов, в состав которых входят фосфорная кислота и так называемые пуриновые и пиримидиновые основания (нуклеоз ды). Различают дезоксирибонуклеиновую (ДНК) и рибонуклеиновую (РНК) кислоты. ДНК сосредоточена преимущественно в ядрах всех клеток, в хромосомах РНК находится главным образом в цитоплазме. Считают, что ДНК имеет большое значение в передаче наследственных свойств организмов, а РНК — в синтезе белков. [c.177]
ДНК сосредоточена преимущественно в ядрах всех клеток, в хромосомах РНК находится главным образом в цитоплазме. Считают, что ДНК имеет большое значение в передаче наследственных свойств организмов, а РНК — в синтезе белков. [c.177]
ЮНаО, тяжелого шпата BaS04, горькой соли MgSOi 7НаО и др. Далее, сера входит в состав белков (следовательно, содержится в растительных и животных организмах), каменного угля, в небольших количествах содержится в нефти, в i морской воде и т. д. [c.501]
Белки являются главным носителем жизни. Состав белков колеблется в небольших пределах углерода 50—52%, водорода 6—8%, кислорода 19—24%, азота 15—18%, серы 0,5—2,0%. Молекулярная масеа белков различна от нескольких десятков тысяч до миллионов углеродных единиц. [c.257]
Глицин является простейшей из 20 различных аминокислот, входящих в состав белков человеческого тела. Все они относятся к т. н. а-аминокислотам, т. е. содержат группы —ЫНг и —СООН при одном и том же атоме углерода.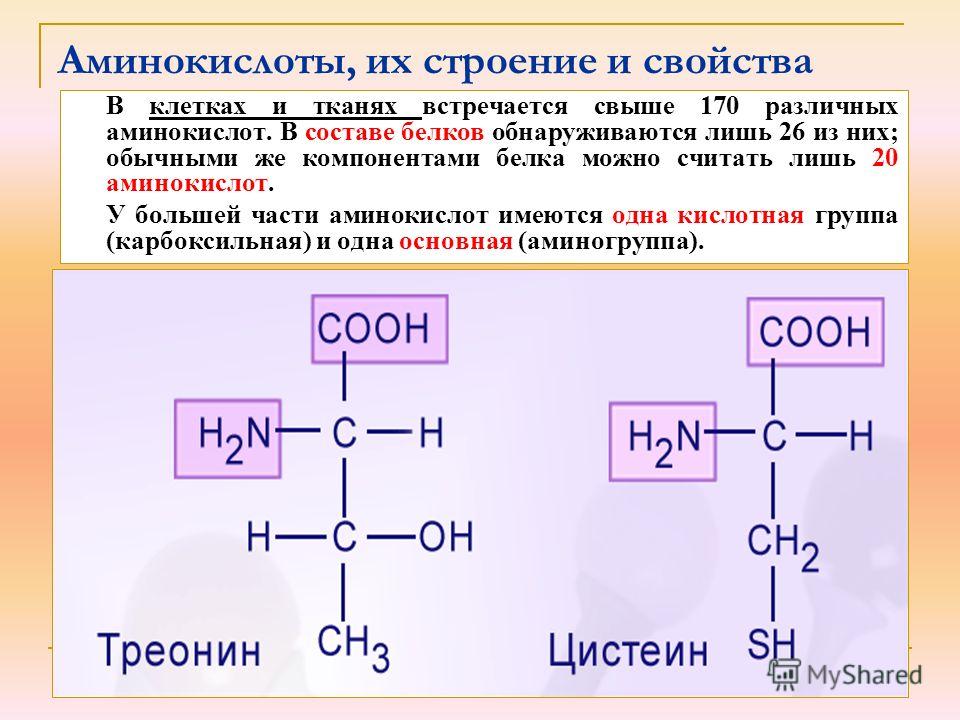 Их общая формула, как правило, имеет вид НгЫС (Н) (Н)СООН с различными радикалами К. Часть этих аминокислот (одиннадцать) может быть синтезирована самим человеческим организмом, а остальные (девять) являются незаменимыми, т. е. должны входить в состав пищи. По использованию смесей аминокислот в питании человека имеется обзорная статья . [c.566]
Их общая формула, как правило, имеет вид НгЫС (Н) (Н)СООН с различными радикалами К. Часть этих аминокислот (одиннадцать) может быть синтезирована самим человеческим организмом, а остальные (девять) являются незаменимыми, т. е. должны входить в состав пищи. По использованию смесей аминокислот в питании человека имеется обзорная статья . [c.566]
В полипептидной цепи эта группа, как предполагалось в модели Лаки и Коулсона, отцает четыре электрона для образования общей я-орбитали. Согласно этой модели белок является полупроводником, причем л-электронные орбитали располагаются перпендикулярно оси полипептидной цепи. Позже Эванс и Герей, рассматривая пептидную группу как элементарную ячейку, пришли к выводу о наличии в молекуле белка трех энергетических зон, из которых одна свободна. Более точные расчеты показали, что ширина запрещенной зоны в белках довольно велика и равна 5 эВ. Бриллюэн предложил модель, в которой зоны проводимости белка получаются за счет перекрытия ст-связей. В этой модели ширина запрещенных зон еще больше (8—10 эВ). Проблема полупроводи-мости белковых систем пока ждет решения. Эксперимент показывает, что энергия фотовозбуждения отдельных групп, связанных с белковой цепью, может мигрировать на значительные расстояния и вызывать флуоресценцию других групп. Комплекс миоглобина с оксидом углерода (II) отщепляет СО при действии излучения, которое не поглощается гемином (т. е. группой, непосредственно связанной с СО), но поглощается триптофаном и тирозином — аминокислотами, остатки которых входят в состав белка миоглобина. Здесь энергия мигрирует от белка к геминовой группе. Эти важные свойства белков показывают, что белки в некоторых случаях способны передавать энергию возбуждения, т. е., в общем случае, сигналы . В ходе эволюции функции передачи сигналов в форме серии дискретных импульсов, частота которых зависит от силы раздражения, перешли к более совершенной системе — нейронам нервной сети. [c.348]
В этой модели ширина запрещенных зон еще больше (8—10 эВ). Проблема полупроводи-мости белковых систем пока ждет решения. Эксперимент показывает, что энергия фотовозбуждения отдельных групп, связанных с белковой цепью, может мигрировать на значительные расстояния и вызывать флуоресценцию других групп. Комплекс миоглобина с оксидом углерода (II) отщепляет СО при действии излучения, которое не поглощается гемином (т. е. группой, непосредственно связанной с СО), но поглощается триптофаном и тирозином — аминокислотами, остатки которых входят в состав белка миоглобина. Здесь энергия мигрирует от белка к геминовой группе. Эти важные свойства белков показывают, что белки в некоторых случаях способны передавать энергию возбуждения, т. е., в общем случае, сигналы . В ходе эволюции функции передачи сигналов в форме серии дискретных импульсов, частота которых зависит от силы раздражения, перешли к более совершенной системе — нейронам нервной сети. [c.348]
Глицин и аланин — простейшие из аминокислот, входящих в состав белков. Из природных белковых веществ выделено свыше 20 различных аминокислот. Среди них имеются и другие одноосновные моноаминокислоты, подобные глицину и аланину, а также двухосновные и диаминокислоты. Многие из аминокислот белков содержат, кроме карбоксильных и аминогрупп, и другие группировки гидроксильные, серусодержащие, радикалы ароматических (стр. 330) и гетероциклических (стр. 411, 424) соединений и др. [c.279]
Из природных белковых веществ выделено свыше 20 различных аминокислот. Среди них имеются и другие одноосновные моноаминокислоты, подобные глицину и аланину, а также двухосновные и диаминокислоты. Многие из аминокислот белков содержат, кроме карбоксильных и аминогрупп, и другие группировки гидроксильные, серусодержащие, радикалы ароматических (стр. 330) и гетероциклических (стр. 411, 424) соединений и др. [c.279]
Цистеин и цистин. Особое значение имеют входящие в состав белков аминокислоты, содержащие серу. На стр. 271 уже упомянут цистеин — а-аштокнслота, представляющая собой производное аланина, в котором при Р-углеродном атоме имеется остаток сероводорода—сульфгидрильная группа, или меркаптогруппа, —ЗН (стр. 132). За счет этой группы цистеин легко окисляется две его молекулы соединяются — возникает дисульфидная связь —3—3— (стр. 132) и образуется аткгинокислота — цистин [c.287]
Белки
Белки — наиболее важные биологические вещества живых организмов.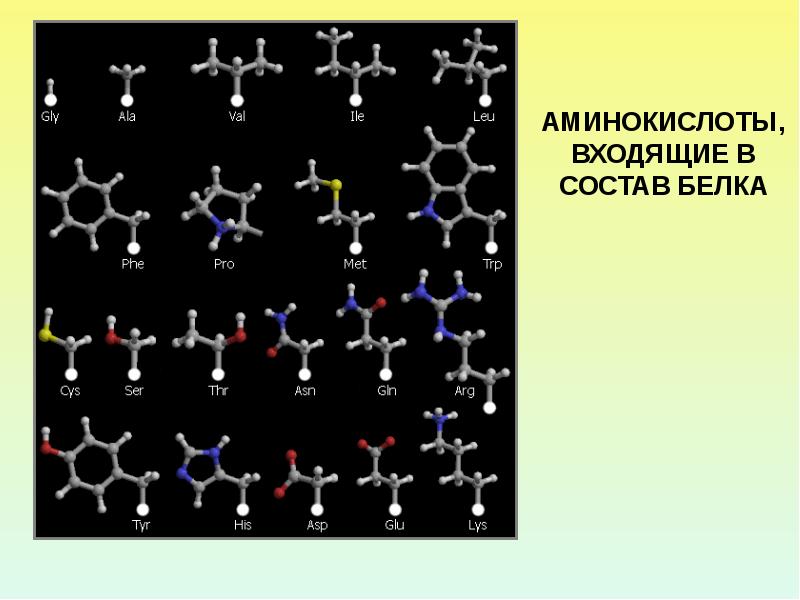 Они являются основным строительным материалом, из которого строятся клетки, ткани и органы человека. Энергетическая ценность 1 г белка равна 4,1 ккал (16,7 кДж).
Они являются основным строительным материалом, из которого строятся клетки, ткани и органы человека. Энергетическая ценность 1 г белка равна 4,1 ккал (16,7 кДж).
Недостаток белка приводит к ряду тяжелых расстройств в организме взрослых, а у детей —к задержке роста.
В состав белков входят аминокислоты. Некоторые из них могут синтезироваться из других веществ, их называют заменимыми. Девять аминокислот, названных незаменимыми, должны поступать в организм в готовом виде. Белки, содержащие весь комплекс незаменимых аминокислот, называют Полноценными (белки рыбы, мяса, молока, яиц и др.). Белки, в состав которых не входит хотя бы одна из незаменимых аминокислот называют неполноценными.
Белки находятся в организме животных и растений в жидком состоянии (молоко, кровь), полужидком (яйца) и твердом (волосы, ногти, сухожилия).
По составу белки подразделяют на простые (протеины) и сложные (протеиды):
— простые белки — альбумины, глобулины, глютелины, проламины, протамины и гистоны;
— сложные белки — фосфоропротеиды, глюкопротеиды,_хромопротеиды, липопротеиды, нуклеопротеиды.
Под действием ферментов кислот, щелочей происходит расщепление белков — гидролиз (созревание сыров). При глубоком расщеплении белков появляется неприятный гнилостный запах (порча мяса, рыбы).
В воде большинство белков набухает и увеличивается в объеме. Процесс набухания белков играет важную роль при производстве макаронных и мучных кондитерских изделий. Яичный белок при взбивании образует пену. Это свойство используется при изготовлении кондитерских изделий.
При нагревании свыше 60°С белки свертываются — денатурируют, выпадают в осадок и вновь в воде уже не растворяются. Денатурация белков наблюдается при варке яиц, а также при производстве кисломолочных продуктов и сыров (образуется сгусток). Кроме того, денатурация белков происходит в процессе длительного хранения круп, бобовых культур, мороженого мяса, рыбы и др. В результате «старения» белки постепенно уплотняются, теряют способность к набуханию и растворимости, и продукты приобретают жесткую консистенцию, труднее развариваются и усваиваются.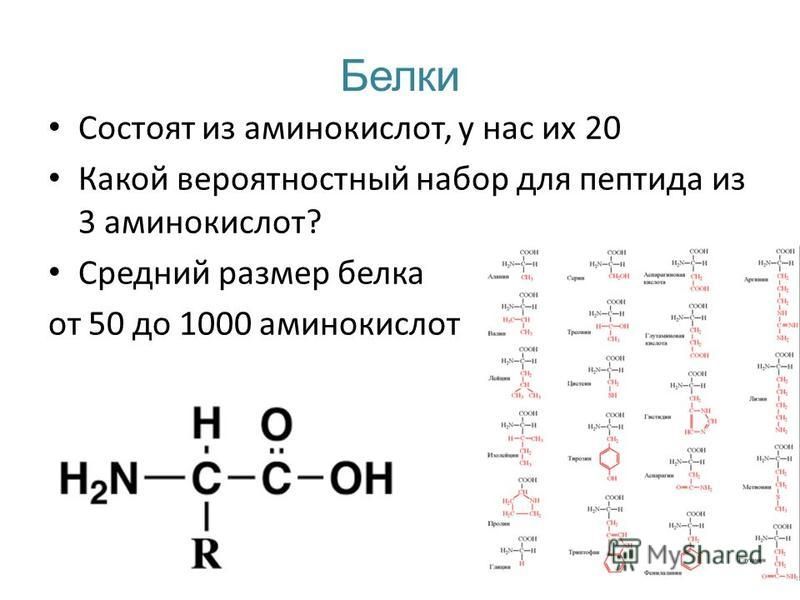
Суточная потребность взрослого человека в белках составляет 80—100 г, половину должны составлять животные белки.
Белки в питании
Белки (протеины, полипептиды) – сложные высокомолекулярные органические вещества, состоящие из L-аминокислот, соединенных пептидной связью в цепочку. Простые белки – протеины – состоят только из аминокислот. В состав сложных белков – протеидов – помимо аминокислот входят нуклеиновая и фосфорная кислоты, углеводы и другие вещества.
Белок является важным компонентом каждой клетки в организме. Также белок используется организмом для создания и восстановления тканей, производства ферментов, гормонов и других химических веществ, необходимых для нормальной жизнедеятельности организма. Функции белка в организме разнообразны: транспортная, защитная, структурная, двигательная, рецепторная и другие.
Белок является важным компонентом костей, мышц, хрящей, кожи и крови. Волосы и ногти в основном состоят из белка. Как и жир, и углеводы, белок является макроэлементом, то есть организм нуждается в относительно больших его количествах. Но, в отличие от жиров и углеводов, организм не накапливает белок и не имеет его резервов.
Как и жир, и углеводы, белок является макроэлементом, то есть организм нуждается в относительно больших его количествах. Но, в отличие от жиров и углеводов, организм не накапливает белок и не имеет его резервов.
Ряд аминокислот, из которых состоят белки, не синтезируются в организме человека (так называемые незаменимые аминокислоты), а поступают только с белковой пищей. В процессе пищеварения ферменты разрушают белки до аминокислот, которые, в свою очередь, используются для синтеза собственных белков организма или подвергаются дальнейшему распаду для получения энергии.
Усвояемость белка – это показатель, характеризующий долю абсорбированного в организме азота от общего количества, потребленного с пищей. Биологическая ценность – показатель качества белка, характеризующий степень задержки азота и эффективность его утилизации для растущего организма или для поддержания азотистого равновесия у взрослых. Качество белка определяется наличием в нем полного набора незаменимых аминокислот в определенном соотношении как между собой, так и с заменимыми аминокислотами.
Наибольшей биологической ценностью обладают белки животного происхождения. В белках растительного происхождения обычно отсутствует от одной до нескольких незаменимых кислот. Также усвояемость растительных белков ниже, чем животных (так, например, усвояемость белков мяса/рыбы составляет 93-95 %, а усвояемость бобовых – 70 %).
Потребность в белке зависит от возраста, пола, характера трудовой деятельности. Физиологическая потребность в белке для взрослого населения составляет от 65 до 117 г/сутки для мужчин, и от 58 до 87 г/сутки для женщин. Физиологические потребности в белке детей до 1 года – 2,2—2,9 г/кг массы тела, а для детей старше 1 года от 36 до 87 г/сутки.
Лучшими источниками белка, содержащими все необходимые аминокислоты, в том числе и незаменимые, являются продукты животного происхождения: молоко и молочные продукты, мясо, яйца, рыба и морепродукты. К растительным продуктам, богатым белками, относятся спирулина, соя, фасоль, чечевица, горох, шпинат, киноа.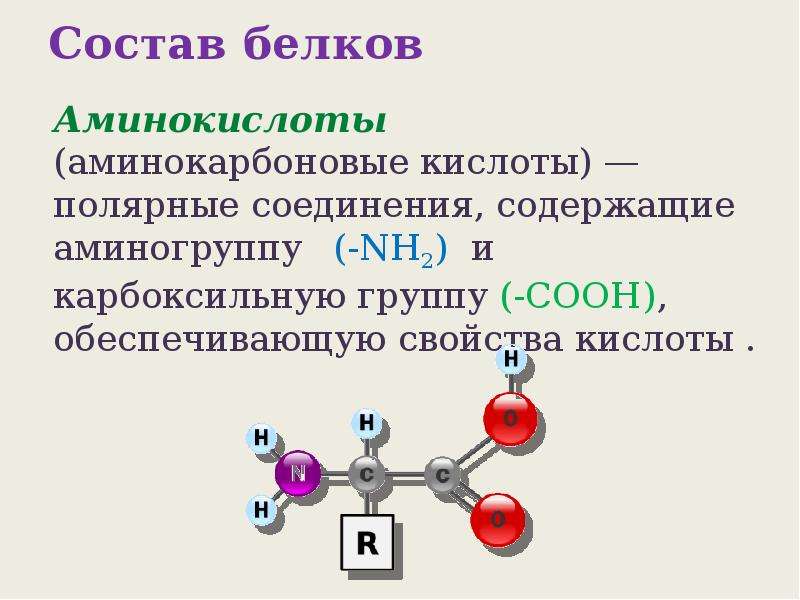
Литература:
1. Т.Л. Пилат, А.А. Иванов «Биологически активные добавки к пище (теория, производство, применение)», М.: Авваллон, 2002. — с.77-80
2. МР 2.3.1.2432-08 «Нормы физиологических потребностей в энергии и пищевых веществах для различных групп населения Российской Федерации», М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. – с. 6, 11-12
3. Neil Osterweil «The Benefits of Protein. Beef up your knowledge of protein and good dietary sources» (https://www.webmd.com/men/features/benefits-protein#1)
| 1. В молекуле белка содержится один атом серы и массовая доля серы в белке 0,32%. Вычислите значение молярной массы (г/моль) белка: | |
| 2. Качественной реакцией на белки является взаимодействие с: | |
3. Денатурация белков происходит под действием: Денатурация белков происходит под действием: | |
| б) хлорида натрия | |
| в) хлорида ртути | г) карбоната кальция |
| 4. Качественной реакцией на белки является взаимодействие с: | |
| 5. Массовая доля какого элемента в белках наибольшая: | |
| 6. Появление желтой окраски при взаимодействии раствора белка с концентрированной азотной кислотой указывает на наличие в белке остатков аминокислот, содержащих: | |
| а) бензольное кольцо | б) гидроксильную группу |
| в) альдегидную группу | г) аминогруппу |
7. Белки можно обнаружить: Белки можно обнаружить: | |
| а) ксантопротеиновой реакцией | б) действием индикатора |
| в) с помощью перманганата калия | г) действием щелочи |
| 8. Какие утверждения о белках верны? | |
| а) в макромолекуле белка присутствуют пептидные связи | б) при гидролизе белков образуются аминокислоты |
| в) в макромолекуле белков присутствуют водородные связи | г) все ответы верны |
| 9. При горении белков ощущается запах: | |
| в) жженого пера | г) горелой резины |
10. Укажите, к какой
группе веществ относится гемоглобин: Укажите, к какой
группе веществ относится гемоглобин: | |
| а) аминокислоты | б) моносахариды |
| г) полисахариды | |
20 аминокислот, входящих в состав белков | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Как известно, различные аминокислоты являются основными компонентами, из которых состоят белки. Аминокислоты составляют важную часть человеческого тела и диеты. Они чрезвычайно важны для правильного функционирования человеческого тела; следовательно, важно понимать, сколько аминокислот составляют белки. Давайте перейдем к выяснению, сколько аминокислот действительно составляют белки.
Сколько аминокислот помогает вырабатывать белки?
В природе идентифицировано примерно 500 аминокислот, но только 20 аминокислот составляют белки, обнаруженные в организме человека.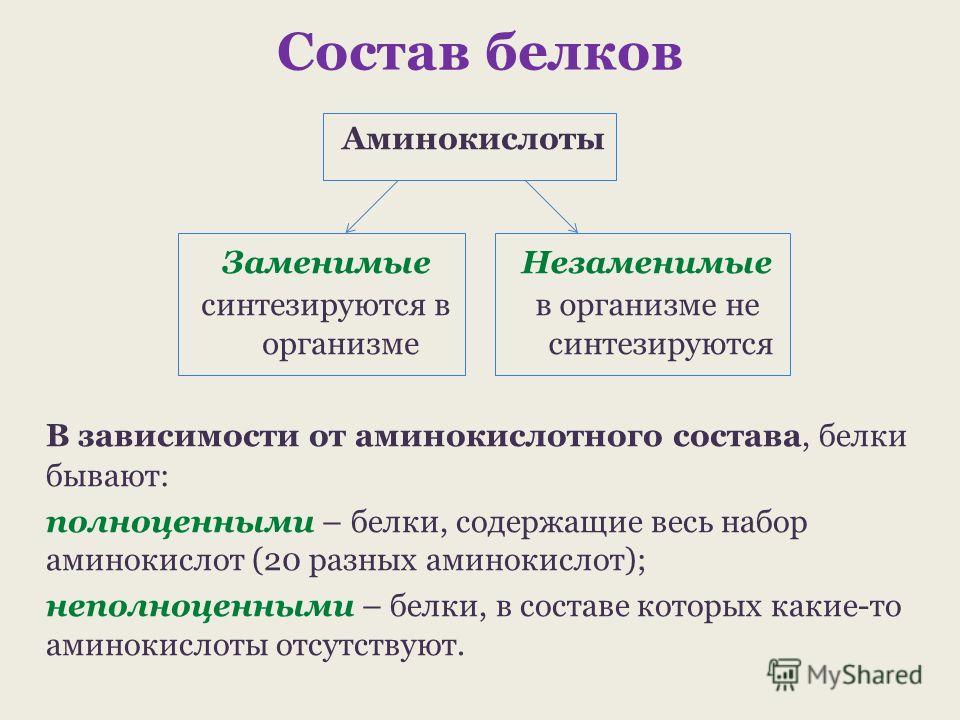 Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.
Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.
Типы всех аминокислот
Все 20 аминокислот подразделяются на две разные аминокислотные группы. Незаменимые и заменимые аминокислоты вместе составляют 20 аминокислот.Из 20 аминокислот 9 являются незаменимыми аминокислотами, а остальные — заменимыми аминокислотами. Давайте посмотрим на каждую аминокислоту в соответствии с их классификацией.
Незаменимые аминокислоты
BCAA (валин, лейцин и изолейцин)
Аминокислоты с разветвленной цепью (BCAA) представляют собой группу из трех аминокислот (валин, лейцин и изолейцин), которые имеют молекулярную структуру с разветвлением. BCAA богаты мышечными белками, они стимулируют рост мышц в организме и обеспечивают энергию во время упражнений.
Лизин
Лизин — одна из наиболее часто упоминаемых незаменимых аминокислот. Такие продукты, как хлеб и рис, как правило, содержат мало лизина. Например, по сравнению с идеальным аминокислотным составом пшеница имеет низкое содержание лизина. Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, которые зависят от пшеницы как источника белка, и обнаружил недостаток лизина в их рационе. Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, которые зависят от пшеницы как источника белка, и обнаружил недостаток лизина в их рационе. Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Треонин
Незаменимая аминокислота, которая используется для создания активного центра ферментов.
фенилаланин
Незаменимая аминокислота, которая используется для производства многих типов полезных аминов.
метионин
Незаменимая аминокислота, которая используется для производства множества различных веществ, необходимых организму.
Гистидин
Незаменимая аминокислота, которая используется для производства гистамина.
Триптофан
Незаменимая аминокислота, используемая для производства многих типов полезных аминов.
Незаменимые аминокислоты
Глютамин
Глютамин — одна из самых распространенных аминокислот в организме.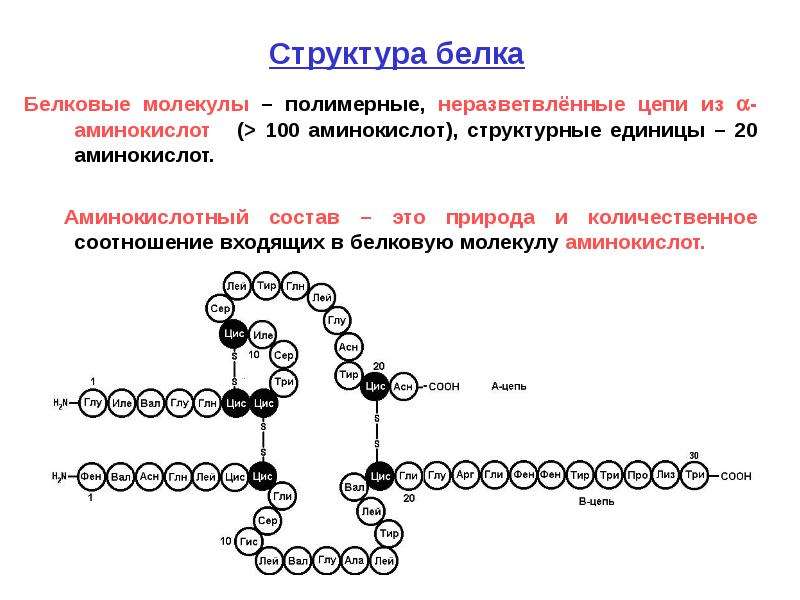 Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глутамин используется для выработки энергии в желудочно-кишечном тракте. Глютамин способствует метаболизму алкоголя для защиты печени.
Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глутамин используется для выработки энергии в желудочно-кишечном тракте. Глютамин способствует метаболизму алкоголя для защиты печени.
Аспартат
Аспартат — одна из аминокислот, наиболее пригодных для получения энергии. Аспартат является одной из аминокислот, наиболее близко расположенных к циклу трикарбоновых кислот (ТСА) в организме, который производит энергию.Цикл TCA подобен двигателю, который приводит в движение автомобили. Каждая клетка нашего тела производит энергию.
Глутамат
Бульон комбу, используемый в японской кулинарии, содержит глутамат. Глутамат является основой умами, а свободный глутамат содержится в комбу, помидорах и сыре. Внутри организма глутамат используется как важный источник незаменимых аминокислот.
Аргинин
Аргинин играет важную роль в открытии вен для улучшения кровотока.Оксид азота, который открывает вены, сделан из аргинина. Аргинин — полезная аминокислота для удаления избытка аммиака из организма.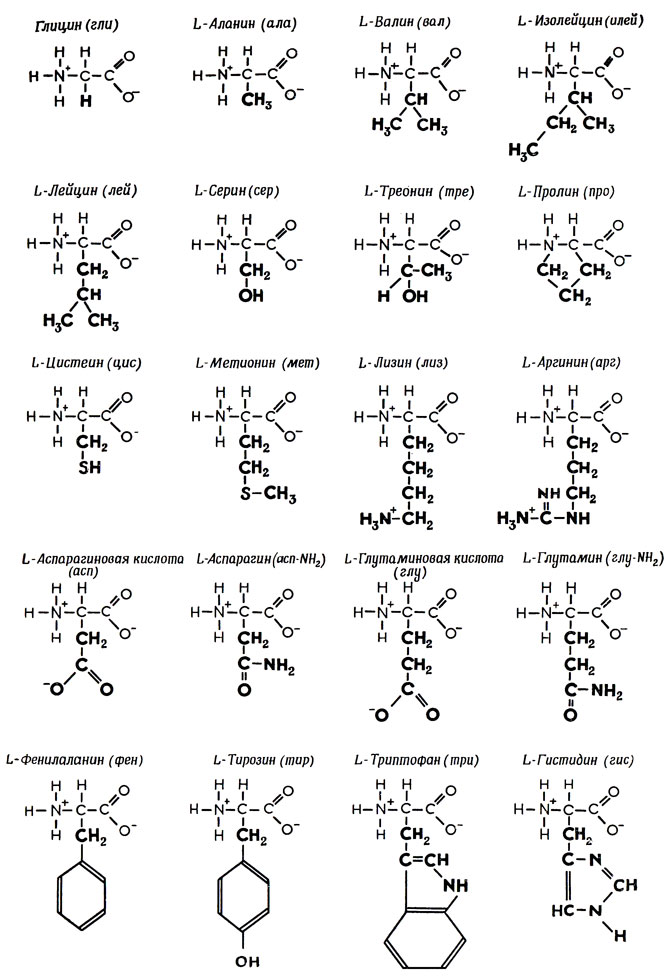 Аргинин повышает иммунитет.
Аргинин повышает иммунитет.
Аланин
Аланин поддерживает функцию печени. Аланин используется для производства глюкозы, необходимой организму. Аланин улучшает метаболизм алкоголя.
Proline
Пролин — одна из аминокислот, содержащихся в коллагене, который составляет ткань кожи. Пролин — одна из важнейших аминокислот естественного увлажняющего фактора (NMF), который сохраняет кожу влажной.
Цистеин
Цистеин снижает количество производимой черной пигментации меланина. Цистеина много в волосах на голове и теле. Цистеин увеличивает количество желтого меланина, производимого вместо черного меланина.
Аспарагин
Аминокислота, обнаруженная из спаржи. И аспарагин, и аспартат расположены близко к циклу трикарбоновой кислоты (TCA), который производит энергию.
Серин
Аминокислота, используемая для производства фосфолипидов и глицериновой кислоты.
Глицин
Незаменимая аминокислота, вырабатываемая в организме.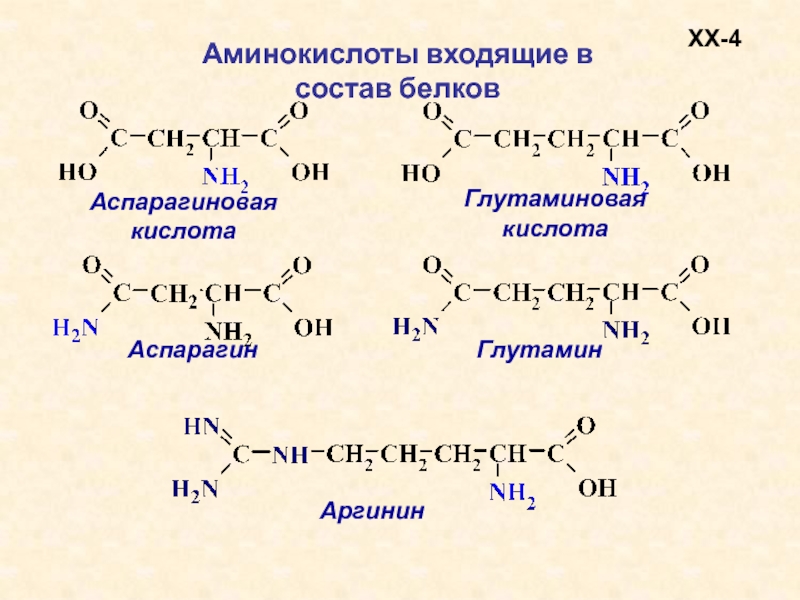 В организме много глицина. Он действует как передатчик в центральной нервной системе и помогает регулировать функции организма, такие как движение и сенсорное восприятие. Глицин составляет одну треть коллагена.
В организме много глицина. Он действует как передатчик в центральной нервной системе и помогает регулировать функции организма, такие как движение и сенсорное восприятие. Глицин составляет одну треть коллагена.
Тирозин
Тирозин используется для получения многих типов полезных аминов. Тирозин относится к группе ароматических аминокислот вместе с фенилаланином и триптофаном.
Контент, который может вам понравиться
Базовый
Структура Гли до лей Asp к Gln Ала к Трп Тест
себя Автор
из 1 буквенных кодов | The Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков, так и
как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в
белки передают широкий спектр химической универсальности. В
точное содержание аминокислот и последовательность этих аминокислот
конкретный белок, определяется последовательностью оснований в
ген, кодирующий этот белок.Химические свойства аминокислот
белков определяют биологическую активность белка. Белки
не только катализируют все (или большую часть) реакций в живых клетках, они
контролировать практически все клеточные процессы. Кроме того, белки содержат
в их аминокислотных последовательностях необходимая информация для определения
как этот белок сворачивается в трехмерную структуру, и
устойчивость полученной конструкции. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства белка.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота. кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин. Тирозин вырабатывается из фенилаланина, поэтому при дефиците в рационе в фенилаланине также потребуется тирозин.Незаменимая аминокислота кислоты — аргинин (необходим молодым, но не взрослым), гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, и валин. Эти аминокислоты необходимы в рационе. Растения, конечно, должен уметь производить все аминокислоты. С другой стороны, люди делают не иметь всех ферментов, необходимых для биосинтеза всех аминокислоты. Зачем изучать эти структуры
и свойства? | Атомы
в аминокислотах |
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота Ala Аланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке. Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
У человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован человеческим организмом в оксид азота, химическое вещество, которое расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.Аргинин также может быть произведен синтетическим путем, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.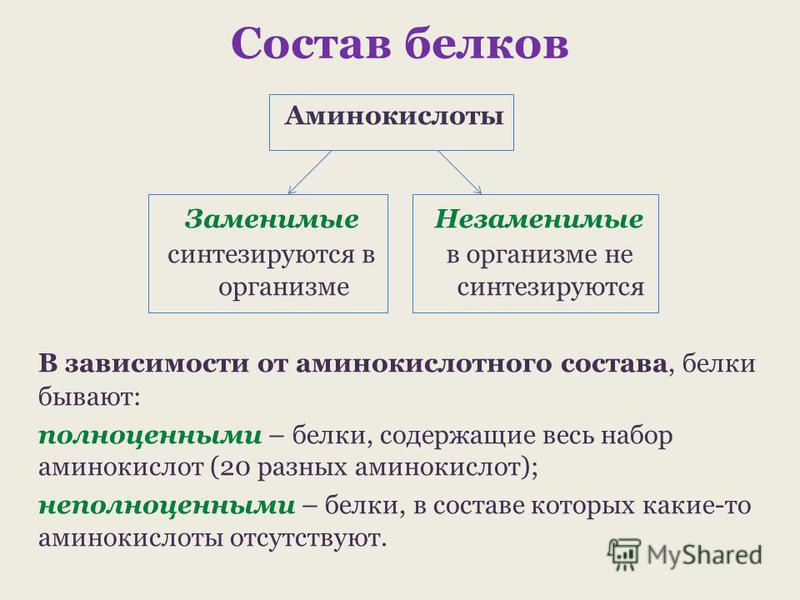
В 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 г. аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка. Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере белков млекопитающих.
Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере белков млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная аминокислота в нашем организме, которая выполняет несколько важных функций. У человека глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Глутаминовая кислота была выделена из глютена пшеницы в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди могут синтезировать из обычного промежуточного продукта α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (без d- или l-стереоизомеров). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислотного серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислотного серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле-аминокислота Изолейцин был выделен из патоки свекловичного сахара в 1904 году. Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она включена.
Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые она включена.
У людей, страдающих редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота LeuЛейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может разлагаться на более простые соединения ферментами организма. Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Лизиновая кислота Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году. Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Лизин важен для связывания ферментов с коферментами и играет важную роль в функционировании гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете. Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота MetМетионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Организм человека обычно способен расщеплять фенилаланин на тирозин, однако у людей с наследственным заболеванием фенилкетонурия (PKU), фермент, который выполняет это преобразование, неактивен. Если его не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислота В 1900 году был химически синтезирован пролин. В следующем году он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих. Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года. Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем соединения с остатком серина в активном центре ацетилхолинэстеразы, полностью подавляя фермент.Активность эстеразы необходима для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr Треонин был выделен из фибрина в 1935 году и синтезирован в том же году.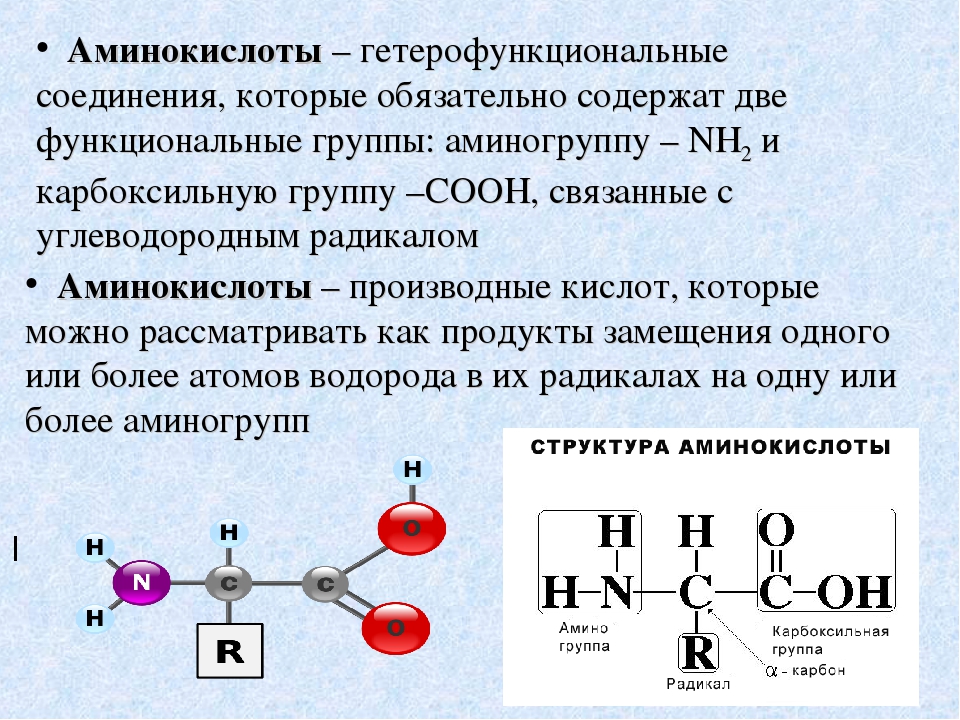 Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих. В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году. Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норэпинефрина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Присутствует только в l-стереоизомере в белки млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норэпинефрина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина.В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурией (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится отчетливой и темнеет при контакте с воздухом.
Val аминокислота Структура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году.В белке млекопитающих появляется только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным, если его не лечить.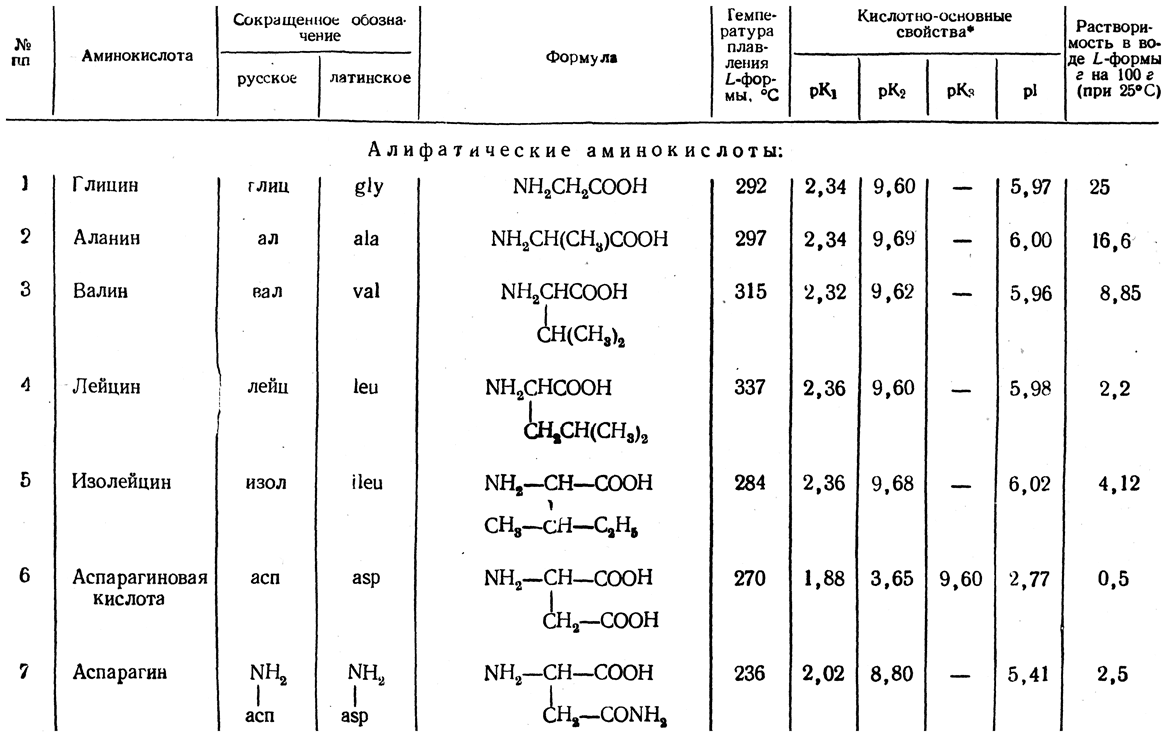
Chem4Kids.com: Биохимия: аминокислоты
Первое, что вы можете спросить: «Что такое аминокислота?» Их больше пятидесяти, и каждый из них немного отличается. Аминокислоты используются в каждой клетке вашего тела для создания белков, необходимых для выживания.Все организмы нуждаются в некоторых белках, независимо от того, используются ли они в мышцах или в виде простых структур клеточной мембраны. Несмотря на то, что все организмы имеют различия, у них все же есть одна общая черта: потребность в основных химических строительных блоках.
Аминокислоты имеют двухуглеродную связь. Один из атомов углерода является частью группы, называемой карбоксильной группой (COO —). Карбоксильная группа состоит из одного атома углерода (C) и двух атомов кислорода (O). Эта карбоксильная группа имеет отрицательный заряд , поскольку это карбоновая кислота (-COOH), которая потеряла свой атом водорода (H). То, что осталось — карбоксильная группа — называется основанием конъюгата . Второй углерод связан с аминогруппой. Амино означает, что с атомом углерода связана группа NH 2 . На изображении вы видите «+» и «-». Эти положительные и отрицательные знаки присутствуют потому, что в аминокислотах один атом водорода перемещается на другой конец молекулы. Дополнительная буква «H» дает вам положительный заряд.
То, что осталось — карбоксильная группа — называется основанием конъюгата . Второй углерод связан с аминогруппой. Амино означает, что с атомом углерода связана группа NH 2 . На изображении вы видите «+» и «-». Эти положительные и отрицательные знаки присутствуют потому, что в аминокислотах один атом водорода перемещается на другой конец молекулы. Дополнительная буква «H» дает вам положительный заряд.
Основные аминокислоты: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.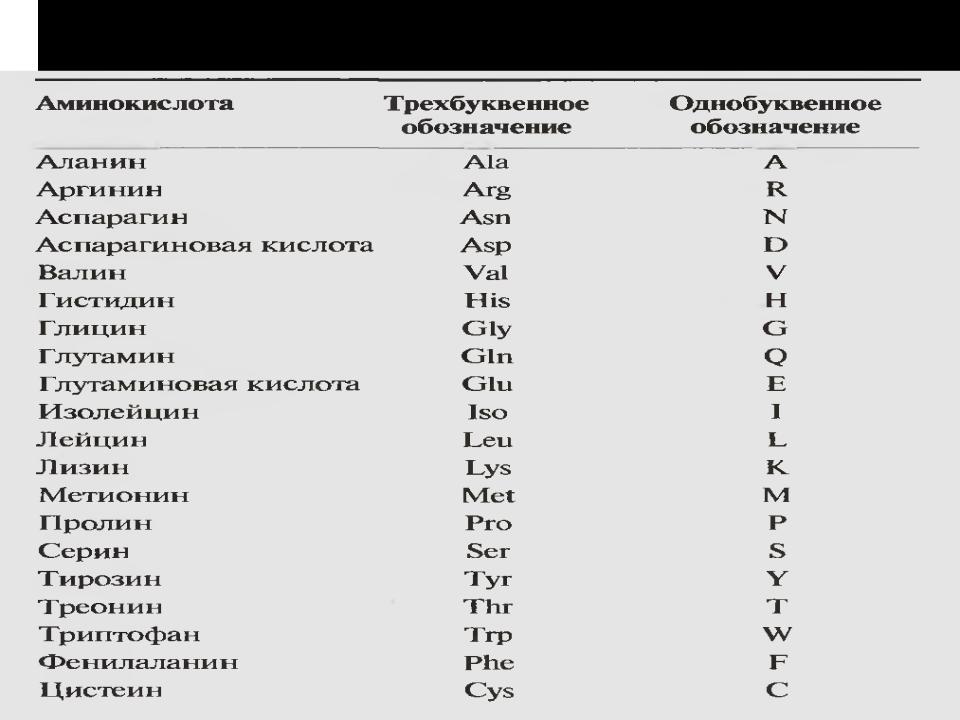
Заменимые аминокислоты: Аланин, аспарагин, аспарагиновая кислота, глутаминовая кислота.
Условные аминокислоты: Аргинин (необходим для детей, а не для взрослых), цистеин, глутамин, глицин, пролин, серин и тирозин.

Аминокислоты в асторидах? (Видео Science @ NASA)
Незаменимые аминокислоты: определение, преимущества и продукты питания
Организму необходимо 20 различных аминокислот для поддержания хорошего здоровья и нормального функционирования.Люди должны получать девять из этих аминокислот, называемых незаменимыми аминокислотами, с пищей. Хорошие диетические источники включают мясо, яйца, тофу, сою, гречку, киноа и молочные продукты.
Аминокислоты — это соединения, которые образуют белки. Когда человек ест пищу, содержащую белок, его пищеварительная система расщепляет белок на аминокислоты. Затем организм комбинирует аминокислоты различными способами для выполнения функций организма.
Здоровый организм может вырабатывать другие 11 аминокислот, поэтому они обычно не нуждаются в поступлении в организм с пищей.
Аминокислоты укрепляют мышцы, вызывают химические реакции в организме, переносят питательные вещества, предотвращают болезни и выполняют другие функции.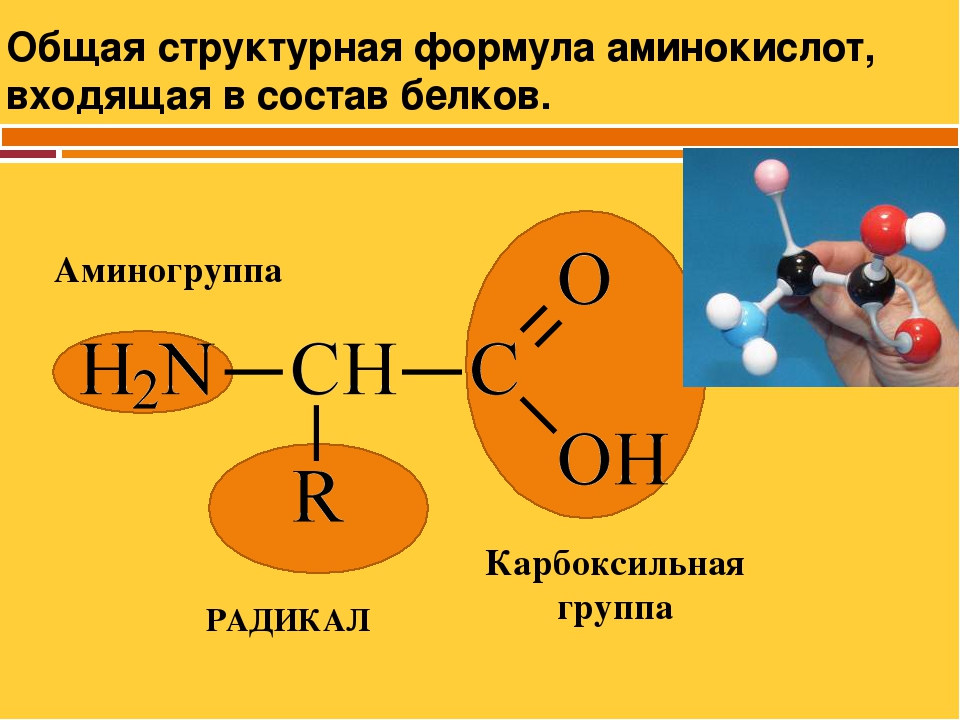 Дефицит аминокислот может привести к снижению иммунитета, проблемам с пищеварением, депрессии, проблемам с фертильностью, снижению умственной активности, замедлению роста у детей и многим другим проблемам со здоровьем.
Дефицит аминокислот может привести к снижению иммунитета, проблемам с пищеварением, депрессии, проблемам с фертильностью, снижению умственной активности, замедлению роста у детей и многим другим проблемам со здоровьем.
Каждая из незаменимых аминокислот играет различную роль в организме, и симптомы дефицита соответственно различаются.
Существует много типов незаменимых аминокислот, в том числе:
Лизин
Лизин играет жизненно важную роль в наращивании мышц, поддержании прочности костей, восстановлении после травм или хирургических вмешательств и регулировании гормонов, антител и ферментов.Он также может иметь противовирусное действие.
Существует не так много исследований дефицита лизина, но исследование на крысах показывает, что дефицит лизина может приводить к вызванной стрессом тревоге.
Гистидин
Гистидин способствует росту, образованию клеток крови и восстановлению тканей. Он также помогает поддерживать особое защитное покрытие нервных клеток, которое называется миелиновой оболочкой.
В организме гистидин превращается в гистамин, который имеет решающее значение для иммунитета, репродуктивного здоровья и пищеварения.Результаты исследования, в котором приняли участие женщины с ожирением и метаболическим синдромом, показывают, что добавки гистидина могут снизить ИМТ и инсулинорезистентность.
Дефицит может вызвать анемию, а низкий уровень в крови чаще встречается у людей с артритом и заболеванием почек.
Треонин
Треонин необходим для здоровья кожи и зубов, так как он входит в состав зубной эмали, коллагена и эластина. Он помогает метаболизму жиров и может быть полезен для людей с расстройством желудка, тревожностью и легкой депрессией.
Исследование 2018 года показало, что дефицит треонина у рыб привел к снижению устойчивости этих животных к болезням.
Метионин
Метионин и заменимая аминокислота цистеин играют важную роль в здоровье и эластичности кожи и волос. Метионин также помогает сохранять ногти крепкими.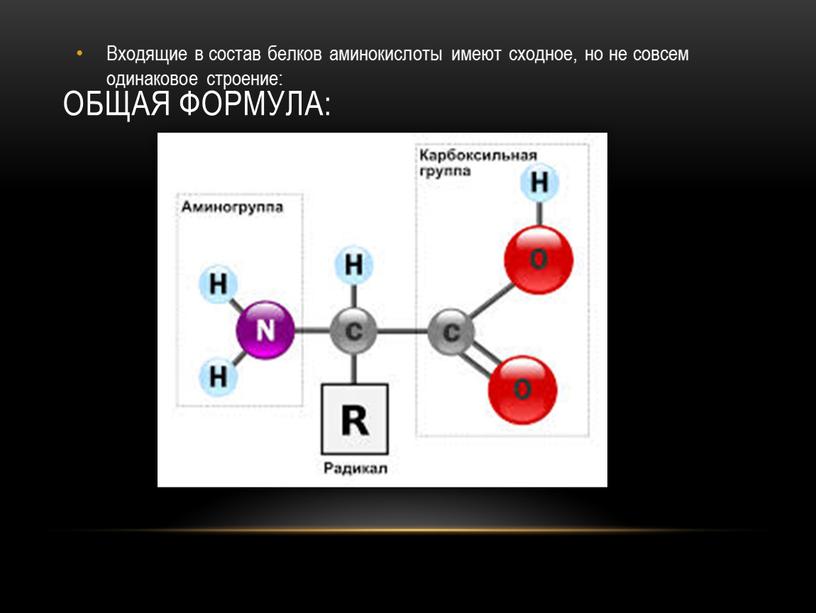 Он способствует правильному всасыванию селена и цинка и удалению тяжелых металлов, таких как свинец и ртуть.
Он способствует правильному всасыванию селена и цинка и удалению тяжелых металлов, таких как свинец и ртуть.
Валин
Валин необходим для умственной сосредоточенности, координации мышц и эмоционального спокойствия.Люди могут использовать добавки валина для роста мышц, восстановления тканей и получения энергии.
Дефицит может вызвать бессонницу и снижение умственной функции.
Изолейцин
Изолейцин помогает заживлению ран, укреплению иммунитета, регуляции уровня сахара в крови и выработке гормонов. Он в основном присутствует в мышечной ткани и регулирует уровень энергии.
Пожилые люди могут быть более предрасположены к дефициту изолейцина, чем молодые люди. Этот недостаток может вызвать мышечное истощение и тряску.
Лейцин
Лейцин помогает регулировать уровень сахара в крови и способствует росту и восстановлению мышц и костей.Он также необходим для заживления ран и выработки гормона роста.
Дефицит лейцина может привести к кожной сыпи, выпадению волос и усталости.
Фенилаланин
Фенилаланин помогает организму использовать другие аминокислоты, а также белки и ферменты. Организм превращает фенилаланин в тирозин, который необходим для определенных функций мозга.
Дефицит фенилаланина, хотя и встречается редко, может привести к плохой прибавке в весе у младенцев. Это также может вызвать экзему, усталость и проблемы с памятью у взрослых.
Фенилаланин часто входит в состав искусственного подсластителя аспартама, который производители используют для приготовления диетических газированных напитков. Большие дозы аспартама могут повышать уровень фенилаланина в головном мозге, вызывать беспокойство и нервозность, а также влиять на сон.
Люди с редким генетическим заболеванием, называемым фенилкетонурией (ФКУ), не могут метаболизировать фенилаланин. В результате им следует избегать употребления продуктов, содержащих высокий уровень этой аминокислоты.
Триптофан
Триптофан необходим для нормального роста младенцев и является предшественником серотонина и мелатонина. Серотонин — нейромедиатор, регулирующий аппетит, сон, настроение и боль. Мелатонин также регулирует сон.
Серотонин — нейромедиатор, регулирующий аппетит, сон, настроение и боль. Мелатонин также регулирует сон.
Триптофан является седативным средством и входит в состав некоторых снотворных. Одно исследование показывает, что добавление триптофана может улучшить умственную энергию и эмоциональную обработку у здоровых женщин.
Дефицит триптофана может вызвать состояние, называемое пеллагрой, которое может привести к деменции, кожной сыпи и проблемам с пищеварением.
Многие исследования показывают, что низкий уровень белка и незаменимых аминокислот влияет на мышечную силу и работоспособность.
Согласно исследованию 2014 года, недостаток незаменимых аминокислот может вызвать снижение мышечной массы у пожилых людей.
Дополнительное исследование показывает, что аминокислотные добавки могут помочь спортсменам восстановиться после тренировки.
Раньше врачи считали, что люди должны есть продукты, содержащие все девять незаменимых аминокислот за один прием пищи.
В результате, если человек не ел мясо, яйца, молочные продукты, тофу или другую пищу со всеми незаменимыми аминокислотами, необходимо было комбинировать два или более растительных продукта, содержащих все девять, таких как рис и бобы.
Однако сегодня эта рекомендация иная. Люди, которые придерживаются вегетарианской или веганской диеты, могут получать свои незаменимые аминокислоты из различных растительных продуктов в течение дня, и им необязательно есть их все вместе за один прием пищи.
Поделиться на Pinterest Человек должен поговорить со своим врачом, прежде чем принимать добавки с незаменимыми аминокислотами. Хотя 11 аминокислот не являются незаменимыми, людям могут потребоваться некоторые из них, если они находятся в состоянии стресса или болеют. В это время организм может быть не в состоянии производить достаточное количество этих аминокислот для удовлетворения повышенных потребностей.Эти аминокислоты являются «условными», что означает, что они могут потребоваться человеку в определенных ситуациях.
Иногда люди могут захотеть принимать добавки с незаменимыми аминокислотами. Лучше сначала проконсультироваться с врачом относительно безопасности и дозировки.
Хотя дефицит незаменимых аминокислот возможен, большинство людей может получить их в достаточном количестве, соблюдая диету, включающую белок.
Продукты, указанные в следующем списке, являются наиболее распространенными источниками незаменимых аминокислот:
- Лизин содержится в мясе, яйцах, сое, черной фасоли, лебеде и семенах тыквы.
- Мясо, рыба, птица, орехи, семена и цельные зерна содержат большое количество гистидина.
- Творог и зародыши пшеницы содержат большое количество треонина.
- Метионин содержится в яйцах, зернах, орехах и семенах.
- Валин содержится в сое, сыре, арахисе, грибах, цельнозерновых и овощах.
- Изолейцин в большом количестве содержится в мясе, рыбе, птице, яйцах, сыре, чечевице, орехах и семенах.
- Источниками лейцина являются молочные продукты, соя, фасоль и бобовые.

- Фенилаланин содержится в молочных продуктах, мясе, птице, сое, рыбе, бобах и орехах.
- Триптофан содержится в большинстве продуктов с высоким содержанием белка, включая зародыши пшеницы, творог, курицу и индейку.
Это лишь несколько примеров продуктов, богатых незаменимыми аминокислотами. Все продукты, содержащие белок, будь то растительного или животного происхождения, будут содержать по крайней мере некоторые из незаменимых аминокислот.
Потребление незаменимых аминокислот имеет решающее значение для хорошего здоровья.
Ежедневное употребление разнообразных продуктов, содержащих белок, — лучший способ для людей получить достаточное количество незаменимых аминокислот.При современной диете и доступе к большому разнообразию продуктов дефицит редко встречается у людей, которые в целом имеют хорошее здоровье.
Перед приемом пищевых добавок следует всегда проконсультироваться с врачом.
Чтение: Аминокислоты | Биология (ранний выпуск)
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот , расположенных в линейной последовательности.
Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот , расположенных в линейной последовательности.
Аминокислоты
Рис. 1. Аминокислоты имеют центральный асимметричный атом углерода, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (группа R).
Аминокислоты — это мономеры, из которых состоят белки.Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. . Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
1).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 аминокислот.Десять из них считаются незаменимыми аминокислотами у людей, потому что человеческий организм не может их производить, и они получают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практика
Рис. 2. В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою группу R (вариантная группа), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Показать ответ Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например.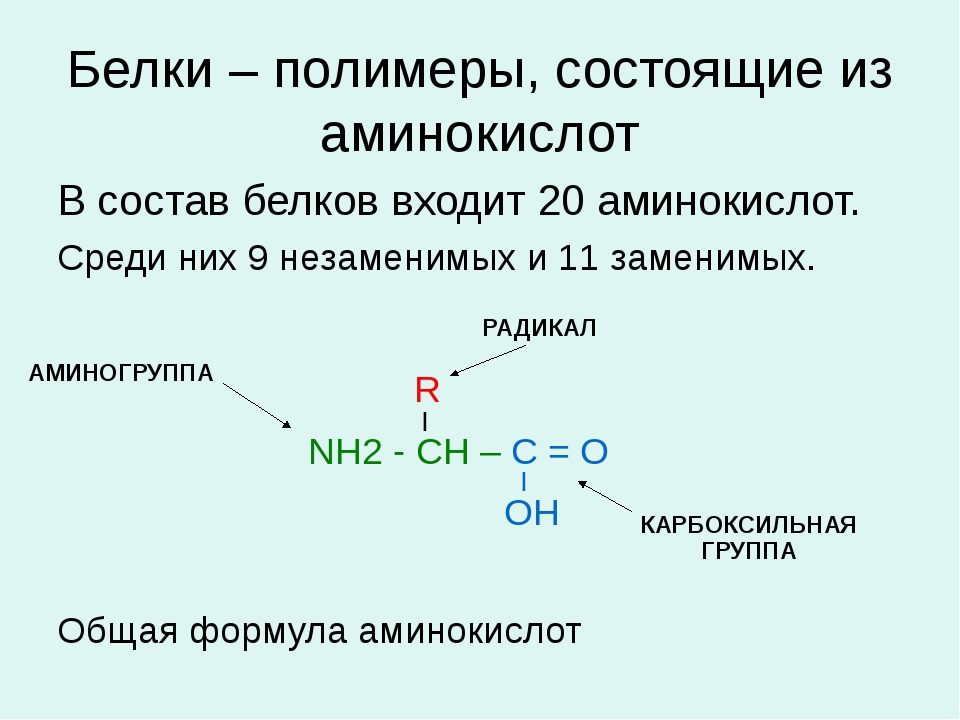 g., боковые цепи аминокислот) с большей вероятностью обнаруживаются внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
g., боковые цепи аминокислот) с большей вероятностью обнаруживаются внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, и у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Рис. 3. Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты.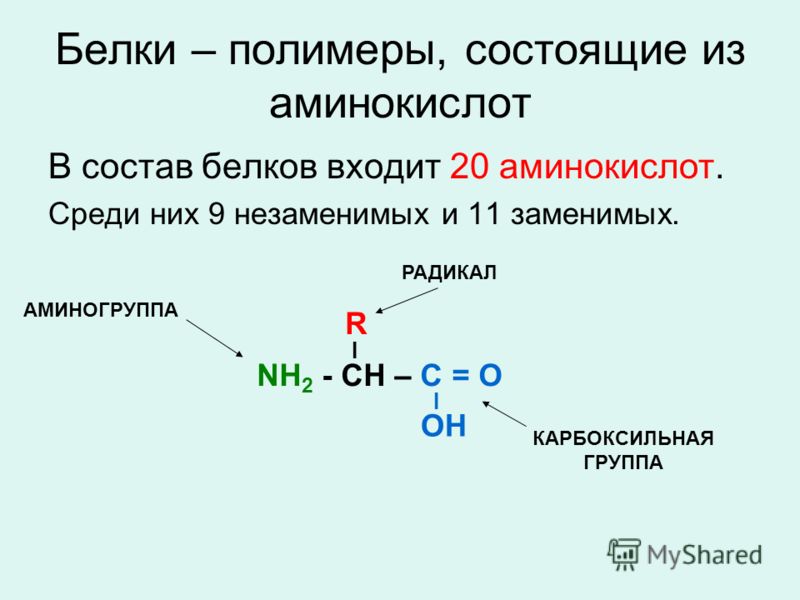 При этом выделяется молекула воды.
При этом выделяется молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь является пептидной связью (рис. 3).
Продукты, образованные такими связями, называются пептидами. Чем больше аминокислот присоединяется к этой растущей цепи, получаемая цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически является полимером аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
, и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, а центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые установили, что цитохром с человека содержит 104 аминокислоты.Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. При сравнении последовательностей человека и макаки-резуса единственное различие было обнаружено в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Все об аминокислотах в уходе за кожей
Аминокислоты играют важную роль в поддержании общего состояния здоровья и получении красивой кожи. Есть много аминокислот, но только 20 действительно важны для нашего здоровья и могут быть разделены на 2 типа: незаменимые и заменимые аминокислоты.
- Незаменимые аминокислоты — это аминокислоты, которые не производятся самим организмом.
 Вы получаете их пользу только от употребления определенных продуктов или добавок.
Вы получаете их пользу только от употребления определенных продуктов или добавок. - Незаменимые аминокислоты вырабатываются вашим организмом, и поэтому получать их из своего рациона или пищевых добавок не обязательно.
Есть 9 незаменимых аминокислот: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Они содержатся в основном в продуктах, содержащих животные белки (таких как морепродукты, говядина, птица, молочные продукты и яйца), но также и в овощах, таких как киноа и соевые продукты.
11 заменимых аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и тирозин.Некоторые из этих незаменимых аминокислот производятся только тогда, когда мы больны или испытываем стресс.
КАК АМИНОКИСЛОТЫ ПОМОГАЮТ КОЖИ
Аминокислоты незаменимы для здоровой кожи. Они являются строительными блоками пептидов и белков, и каждая аминокислота выполняет определенную функцию при уходе за кожей.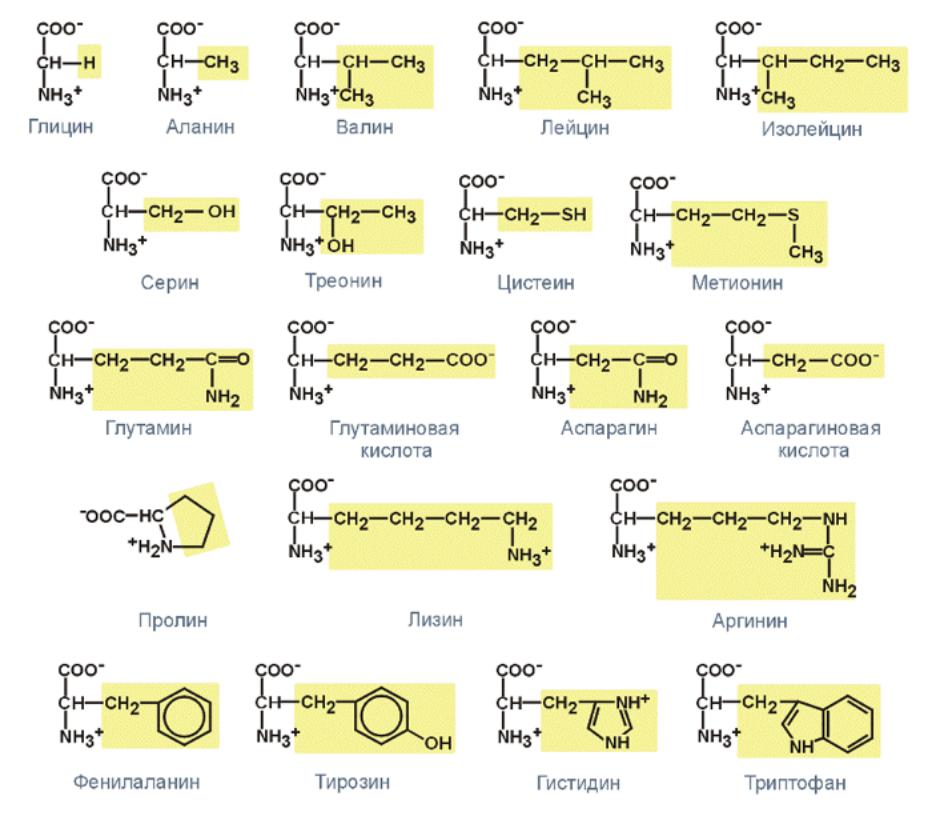 Некоторые типы встречаются естественным образом в коже и работают вместе с аквапоринами (водная транспортная система вашего тела) для переноса влаги через кожу. Некоторые аминокислоты действуют как антиоксиданты, но большинство помогают вашей коже воспроизводить собственные антиоксиданты.Исследования показали, что синтетические аминокислоты гидратируются лучше, чем аминокислоты животного или растительного происхождения. Независимо от того, производятся ли они внутрь или применяются наружно, аминокислоты помогают укрепить иммунную систему, поддерживать увлажнение, упругость и общий здоровый вид кожи. Они защищают кожу от повреждения свободными радикалами и уменьшают признаки старения. Вот почему мы включили несколько аминокислот в наш укрепляющий кожу Peptide Booster, а также в другие продукты по уходу за кожей.
Некоторые типы встречаются естественным образом в коже и работают вместе с аквапоринами (водная транспортная система вашего тела) для переноса влаги через кожу. Некоторые аминокислоты действуют как антиоксиданты, но большинство помогают вашей коже воспроизводить собственные антиоксиданты.Исследования показали, что синтетические аминокислоты гидратируются лучше, чем аминокислоты животного или растительного происхождения. Независимо от того, производятся ли они внутрь или применяются наружно, аминокислоты помогают укрепить иммунную систему, поддерживать увлажнение, упругость и общий здоровый вид кожи. Они защищают кожу от повреждения свободными радикалами и уменьшают признаки старения. Вот почему мы включили несколько аминокислот в наш укрепляющий кожу Peptide Booster, а также в другие продукты по уходу за кожей.
ЛУЧШИЕ АМИНОКИСЛОТЫ ДЛЯ ВАШЕЙ КОЖИ
Все незаменимые и заменимые аминокислоты играют роль в создании красивой кожи, но некоторые из них имеют дополнительные преимущества:
- Аргинин: помогает восстановить видимые повреждения кожи.

- Гистидин: успокаивает кожу и обладает антиоксидантными свойствами.
- Метионин: защищает кожу от вредных веществ.
- Лизин: укрепляет поверхность кожи.
- Пролин, лейцин и глицин: разглаживают мелкие и глубокие морщины.
АМИНОКИСЛОТ И ПЕПТИДЫ
Аминокислоты работают вместе с другими полезными ингредиентами, которые также входят в состав «естественных увлажняющих факторов» кожи (NMF), таких как глицериды, церамиды, гиалуроновая кислота и пептиды.Они особенно хорошо работают в сочетании с пептидами, поэтому мы включили их в наш Peptide Booster; усилитель, специально предназначенный для увлажнения кожи и уменьшения признаков старения. Аминокислоты — это универсальные ингредиенты, которые являются отличным дополнением к другим активным ингредиентам для ухода за кожей, таким как антиоксиданты, растительные экстракты и омега-жирные кислоты. При местном применении аминокислоты помогают улучшить все типы кожи и подходят для всех возрастов, особенно если вы хотите уменьшить признаки старения.

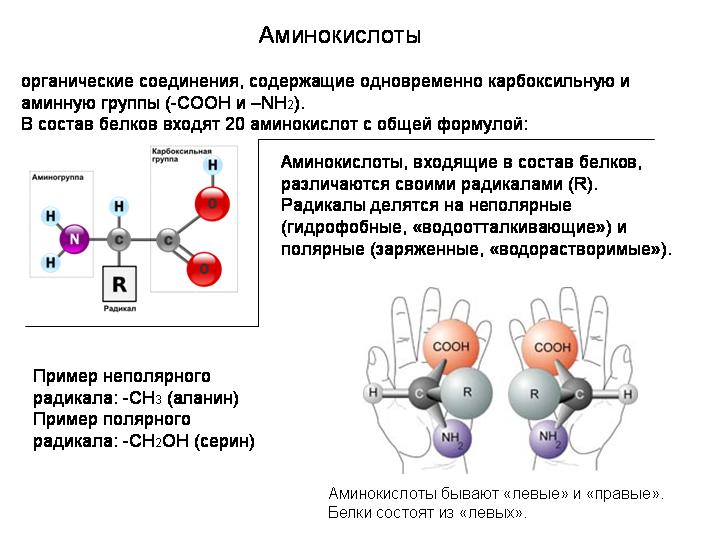
 При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.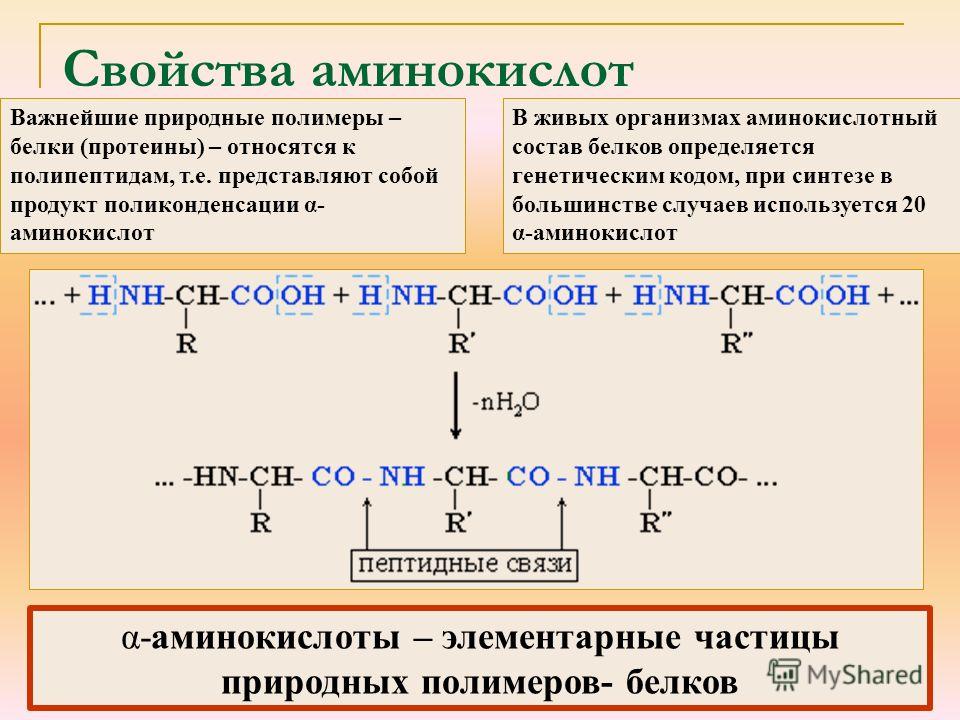 О. Dayhoff
О. Dayhoff  Поле сворачивания белка и
стабильность была критически важной областью исследований в течение многих лет,
и остается сегодня одной из величайших неразгаданных загадок. Однако это
активно исследуются, и прогресс наблюдается каждый день.
Поле сворачивания белка и
стабильность была критически важной областью исследований в течение многих лет,
и остается сегодня одной из величайших неразгаданных загадок. Однако это
активно исследуются, и прогресс наблюдается каждый день. В отличие от жира и крахмала, человеческий организм не накапливает излишки
аминокислоты для последующего использования — аминокислоты должны присутствовать в пище каждый
день.
В отличие от жира и крахмала, человеческий организм не накапливает излишки
аминокислоты для последующего использования — аминокислоты должны присутствовать в пище каждый
день. В противном случае невозможно рассуждать или рассуждать толком о
белки и ферменты или нуклеиновые кислоты.
В противном случае невозможно рассуждать или рассуждать толком о
белки и ферменты или нуклеиновые кислоты. 
 Вы получаете их пользу только от употребления определенных продуктов или добавок.
Вы получаете их пользу только от употребления определенных продуктов или добавок.