что это такое, роль в организме человека?
Бета-аланин — это заменимая аминокислота, которую организм способен синтезировать из других аминокислот. Ее не обязательно употреблять с продуктами питания.
Основная функция бета-аланина — повышение работоспособности мышц. Добавки с аминокислотой включают в свой рацион спортсмены и бодибилдеры.
Польза
Роль данного элемента значительна не только для спортсменов, но и для любого человека. Благодаря бета-аланину в организме происходят следующие изменения:
- мышцы сокращаются с большей скоростью и силой;
- появляется больше энергии;
- регулируется уровень сахара в крови;
- укрепляется иммунная система;
- снижается выраженность симптомов климакса.
Аминокислота показана спортсменам во время набора мышечной массы и работы над рельефом тела.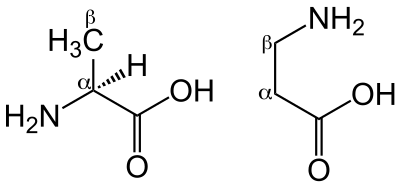
Как пополнить запас?
Бета-аланин не содержится в чистом виде в продуктах питания. Но есть виды пищи, которые стимулируют его выработку в организме. К ним относятся овощи, фрукты, морепродукты.
Профессиональные спортсмены принимают специальные добавки с содержанием бета-аланина. Также такие добавки показаны людям, которые хотят повысить выносливость организма, чтобы легче выполнять физически тяжелую работу и выдерживать нагрузки.
Как действует бета-аланин?
Спортивные добавки с аминокислотами не дадут необходимого и быстрого результата без регулярных тренировок. Но бета-аланин помогает:
- увеличить ежедневный объем тренировки;
- увеличить работоспособность при суперсетах;
- ускорить рост мускулатуры.

Внимание! Через 15 минут после приема добавки начинает ощущаться покалывание в области рук, шеи. Это безвредное состояние. Таким образом аминокислота связывается с нервными клетками. Если покалывания нет, значит она не действует. Спустя две недели приема характерные симптомы уменьшаются, но они не пропадают, пока бета-аланин продолжает действовать.
Как выбрать добавку с бета-аланином?
Необходимо обратить внимание на количество полезной аминокислоты в составе добавки. Если ее меньше двух граммов, приобретать такой продукт не стоит. Эффект будет выражен при приеме 2–5 г бета-аланина.
Внимание! Важно, чтобы после приема бета-аланина возникло покалывание. Его отсутствие может свидетельствовать о низком качестве добавки.
Симптомы дефицита
Если в организме не хватает данной аминокислоты, это сразу станет заметно по состоянию и настроению. Характерные симптомы дефицита бета-аланина:
Характерные симптомы дефицита бета-аланина:
- атрофия мышечной ткани;
- гипогликемия;
- сонливость;
- нервозность;
- потеря аппетита;
- частые простуды;
- снижение сексуальной активности.
Чтобы не возникало таких симптомов, следует регулярно употреблять нежирную говядину, рыбу, индейку, петрушку и грибы. Важно помнить, что при длительном замачивании и варке в большом количестве воды аланин выводится из продуктов.
действенные советы как повысить выносливость организма на личном опыте
Что такое бета-аланин
Это единственная аминокислота, которая не участвует в синтезе белка. Но ее функция не менее важна — бета-аланин усиливает выработку карнозина в организме. Карнозин — органическое соединение, содержащееся в большом количестве во втором типе волокон (именно они задействуются во время интенсивных силовых тренировок).
Так почему я не принимаю сразу карнозин?
Увы, он полностью разрушается при усвоении. Поэтому есть только один способ увеличить количество карнозина в организме — через прием бета-аланина.
Почему я решил принимать бета-аланин
Я захотел получать большего от тренировок, при этом, не доводя организм до предела физических возможностей. Без спортивного питания такой результат маловероятен. В то же время практические испытания Beta Alanine Powder показали увеличение выносливости, продуктивности и улучшение итоговых показателей тренировок.
Как работает Optimum Nutrition Beta Alanine Powder
Чем больше мышцы работают во время тренировки, тем больше им требуется энергии. Процесс высвобождения энергии неизбежно сопровождается накоплением ионов водорода и окислением клеточной среды.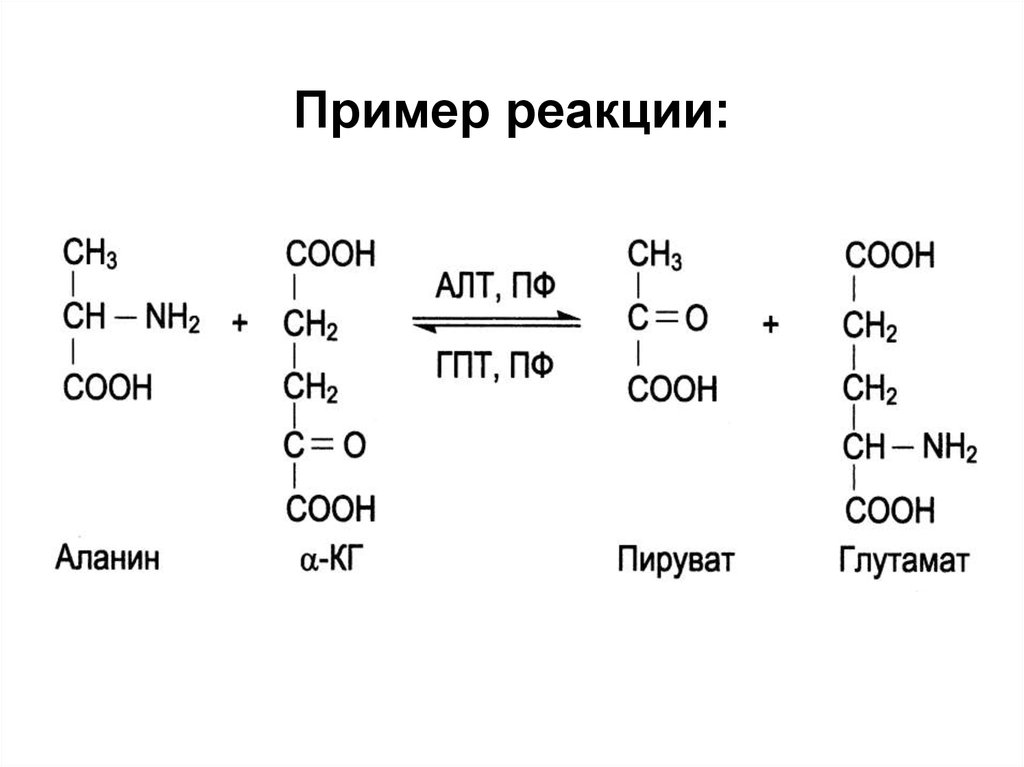 Этот сложный процесс можно выразить более привычно — во время интенсивных занятий спортом в мышцах образуется молочная кислота. В результате чего мы быстрее утомляемся, продуктивность падает, а после тренировки мышцы начинают болеть.
Этот сложный процесс можно выразить более привычно — во время интенсивных занятий спортом в мышцах образуется молочная кислота. В результате чего мы быстрее утомляемся, продуктивность падает, а после тренировки мышцы начинают болеть.
Beta Alanine Powder способствует выработке карнозина. Эта аминокислота поглощает ионы водорода, кислая клеточная среда становится нейтральной. Для меня как для спортсмена это значит, что мышцы смогут подвергаться большим нагрузкам в течение длительного времени. Можно будет выбрать более интенсивную тренировку. А значит, получить рост мышц больший, чем без употребления бета-аланина.
Личный опыт
Я принимал примерно по 2 г Beta Alanine Powder сразу после тренировки или днем между приемами пищи. Так как бета-аланин это почти креатин, то он все равно сразу действовать не будет и имеет эффект накопления. Но сразу можно почувствовать покалывание кожи. Период употребления: в течение месяца. В результате регулярного приема:
- Заметил, что выросла работоспособность во время занятий.

- Увеличилась производительность мышц. Во время аэробных и анаэробных тренировок я мог сделать больше, чем до курса Beta Alanine Powder.
- Замедлился процесс мышечного утомления. Тело стало уставать через больший промежуток времени.
- Процесс восстановления мышц наоборот, ускорился.
Из неприятных эффектов могу отметить покалывание в мышцах после приема. Это нормальное явление, вызванное взаимодействием нервов и бета-аланина. Это не несет вреда организму, так что если вы, принимая Optimum Nutrition Beta Alanine Powder, почувствуете то же самое, можете не волноваться.
Противопоказаний к употреблению нет, так как и бета-аланин, и карнозин являются частью нашего обмена веществ, поэтому разнообразить свое спортивное питание этим препаратом может каждый. Конечно, при отсутствии непереносимости его компонентов.
Пробовал бета-аланин — Дмитрий Савенков
Заказать бета-аланин с доставкой по Сочи и Адлеру
Читайте другие мои обзоры
Lipo 6X для похудения и улучшения обмена веществ
Жиросжигатель L-CARNITIN FIRE
Анализ крови на аминокислоты и ацилкарнитины (32 показателя)
Общая информация об исследовании
Аминокислоты – это сложные органические вещества, главная функция которых состоит в том, что они являются строительным материалом для синтеза белка в организме.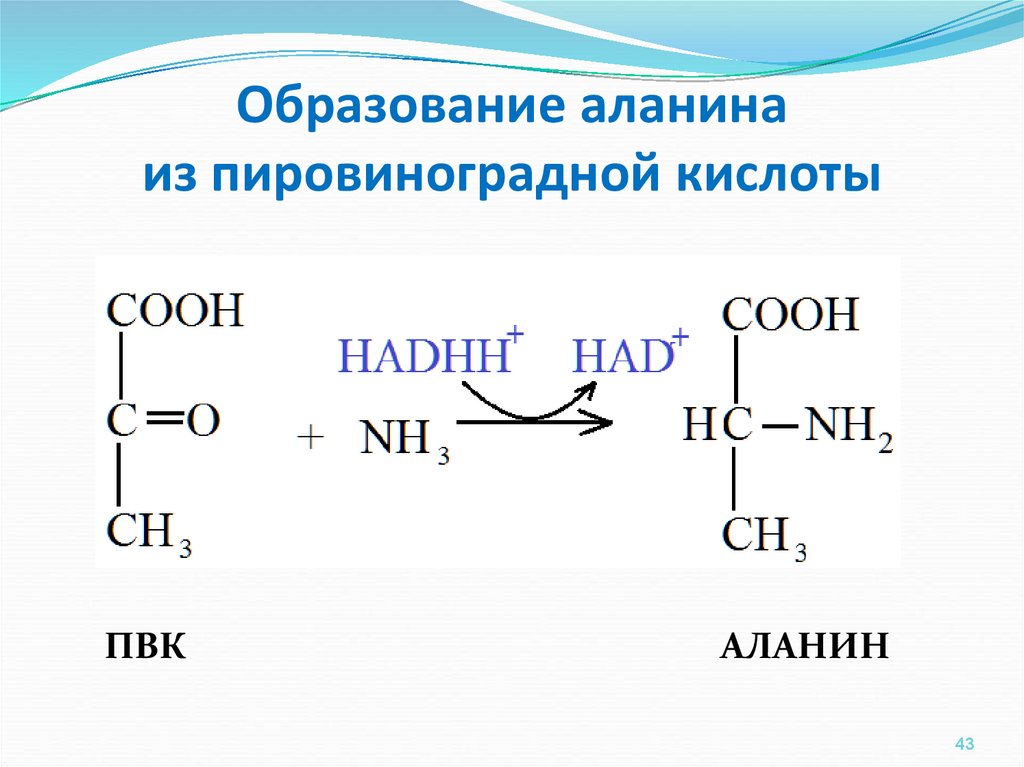
L-карнитин, или левокарнитин, представляет собой вещество, подобное витаминам группы В, синтезируется в организме и является необходимым для осуществления многих жизненно важных метаболических процессов.
Ацилкарнитины являются органическими веществами, производными карнитина и жирных кислот, являются участниками сложнейших биохимических реакций клеточного метаболизма.
Данный комплекс позволяет оценить количественное содержание наиболее значимых аминокислот и ацилкарнитинов.
Аланин – аминокислота, которая состоит из двух подвидов: альфа (является частью различных белков) и бета (присутствует в составе многих биологически активных веществ, например пантотеновой кислоты). Важнейшим свойством аланина является способность его к превращению в глюкозу в печени (один из путей синтеза глюкозы в организме).
Аргинин – аминокислота, имеющая специфическую функцию в виде участия в синтезе оксида азота NO, который обладает возможностями влияния стенку сосудов. Это позволяет контролировать процессы, в первую очередь, сердечно-сосудистой системы, иммунных и противовоспалительных реакций, дезинтоксикации и регенерации и др.
Валин является основным структурным компонентом белков мышечной и нервной тканей, играя при этом важнейшую роль для скелетной мускулатуры, центральной и вегетативной нервной системы, также принимает участие в работе печени.
Глицин – наиболее известен в составе лекарственного препарата, так как обладает тормозящим действием на нейроны, вызывая успокоительный эффект, а также оказывая нейропротективное, нейрометаболическое, антиоксидантное воздействие в нервной системе.
Лейцин и изолейцин принимают участие во всех видах обменных и энергетических процессов, поддерживают структуру мышц, глюкозу в крови, обеспечивают выносливость и восстановление после физических нагрузок.
Метионин известен как достаточно сильный антиоксидант, является составной некоторых гормонов и других биологически активных веществ. Имеет важное свойство накапливаться в измененных опухолевым процессом тканях, поэтому используется в лучевых методах исследования.
Пролин – аминокислота, необходимая для синтеза коллагена, поэтому она наиболее важна для поддержания тонуса кожи, мышечной ткани, прочности и эластичности хрящевой ткани, а также сосудистой стенки, что способствует профилактике атеросклероза.
Тирозин играет роль в работе мозга (внимание, память, настроение, реакция на стресс и т. д.), щитовидной железы и гипофиза.
Фенилаланин незаменим для работы центральной нервной системы (концентрация внимания, память, ясность мышления, снижение тревожности), также участвует в синтезе гормона мелатонина, регулирующего цикл сна и бодрствования.
Орнитин является промежуточным продуктом в синтезе мочевины, следовательно, участвует в выведении продуктов обмена, также способен превращаться в некоторые другие аминокислоты.
Цитруллин также участвует в цикле мочевины и является субстратом для синтеза аргинина.
L-карнитин поступает из пищи и синтезируется в организме с участием аминокислот метионина и лизина, ряда ферментов, витаминов и микроэлементов. Основная его функция заключается в участии в реакциях энергетического обмена. Также L-карнитин участвует в процессах укрепления костей и мышц, расщепления жировой ткани, снижения глюкозы крови, препятствует накоплению токсинов, что защищает клетки и ткани от их повреждающего воздействия.
В состав комплекса также входит определение содержания достаточно большого количества ацилкарнитинов. Ацилкарнитины представляют собой эфиры карнитина и жирных кислот и подразделяются на короткоцепочечные (С2-С5), среднецепочечные (С6-С12) и длинноцепочечные (С14-С18) в зависимости от длины углеродной цепи присоединенной кислоты. Химические названия этих соединений происходят от латинского обозначения цифр по количеству атомов углерода жирной кислоты, присоединенной к карнитину, например деканоилкарнитин (10 атомов углерода). Ацилкарнитины являются промежуточными веществами в сложных окислительно-восстановительных реакциях, протекающих в митохондриях и приводящих в итоге к синтезу АТФ – основного источника энергии для жизнеобеспечения каждой клетки и всего организма в целом.
Данное комплексное исследование направлено на диагностику различных нарушений метаболизма (обменных процессов) аминокислот или органических жирных кислот (для этого исследуется содержание ацилкарнитинов). Обменные патологии могут быть врожденными (обусловленными генетическими нарушениями) или приобретенными (связаны с нарушением синтеза в организме или усвоения из продуктов питания, разрушением данных соединений в организме или неправильной утилизацией и т. д.). Заболевания, связанные с нарушением обмена аминокислот, объединяются в общее название – аминоацидопатии. Среди врожденных аминоацидопатий наиболее значимыми и часто встречающимися являются фенилкетонурия, алкаптонурия, гомоцистинурия, цитруллинемия, тирозинемия и др. Приобретенные нарушения аминокислотного обмена, как правило, связаны с различными другими заболеваниями, к примеру с сахарным диабетом, онкологическими новообразованиями, хроническими воспалительными или инфекционными процессами ЖКТ, почек, нарушением питания. Ацилкарнитины являются участниками обмена жирных и органических кислот, следовательно, отклонение от нормы их концентрации указывает на нарушения в данных видах обмена, которые имеют свои нозологические формы или синдромы.
Обменные патологии могут быть врожденными (обусловленными генетическими нарушениями) или приобретенными (связаны с нарушением синтеза в организме или усвоения из продуктов питания, разрушением данных соединений в организме или неправильной утилизацией и т. д.). Заболевания, связанные с нарушением обмена аминокислот, объединяются в общее название – аминоацидопатии. Среди врожденных аминоацидопатий наиболее значимыми и часто встречающимися являются фенилкетонурия, алкаптонурия, гомоцистинурия, цитруллинемия, тирозинемия и др. Приобретенные нарушения аминокислотного обмена, как правило, связаны с различными другими заболеваниями, к примеру с сахарным диабетом, онкологическими новообразованиями, хроническими воспалительными или инфекционными процессами ЖКТ, почек, нарушением питания. Ацилкарнитины являются участниками обмена жирных и органических кислот, следовательно, отклонение от нормы их концентрации указывает на нарушения в данных видах обмена, которые имеют свои нозологические формы или синдромы.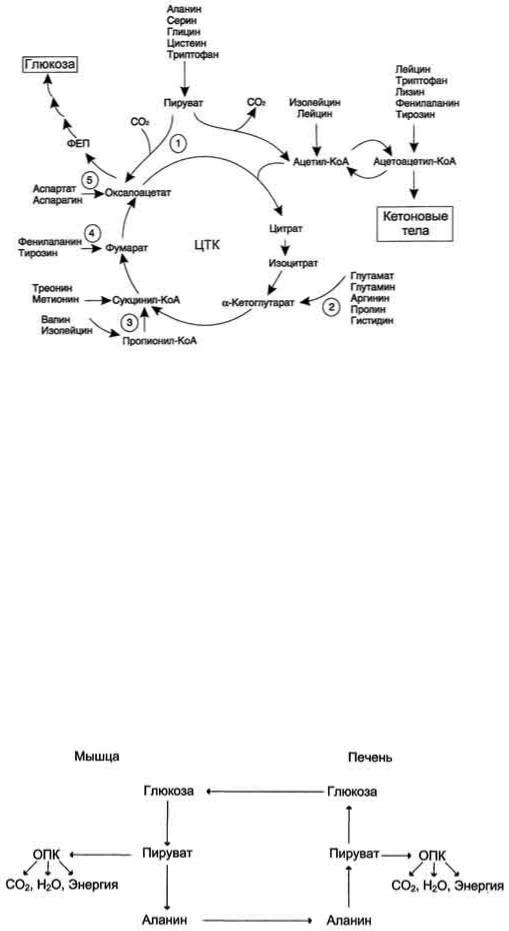
Комплексное определение концентрации аминокислот и ацилкарнитинов доступно с помощью использования метода высокоэффективной жидкостной хроматографии с тандемной масс-спектрометрией (ВЭЖХ/МС). В настоящее время данный вид исследования нашел широкое применение для проведения скрининговой диагностики, включающей большое количество показателей, сходных между собой. На первом этапе происходит качественный анализ – разделение изучаемых веществ по их физико-химическим свойствам. Затем, на втором этапе, оцениваются количественные характеристики каждой аминокислоты и ацилкарнитина, результаты которых отражаются в мкмоль/л и сравниваются с диапазоном референсных значений. ВЭЖХ/МС на сегодняшний день является одним из самых точных методов лабораторной диагностики с анализом большого количества показателей одновременно, обладает высокой чувствительностью и специфичностью и выполняется в достаточно короткие сроки, что также имеет значение при некоторых тяжелых формах обменных нарушений.
Кроме патологических процессов и заболеваний, связанных с обменом аминокислот и ацилкарнитинов, следует отметить, что данные вещества широко применяются в спортивном питании. Также в настоящее время популярны системы вегетарианского питания, исключающие поступления в организм белков животного происхождения, а значит, и некоторых незаменимых аминокислот. Комплексное исследование аминокислотного профиля может быть полезно и для данных категорий в целях оценки влияния режима питания на обменные процессы в организме.
Также в настоящее время популярны системы вегетарианского питания, исключающие поступления в организм белков животного происхождения, а значит, и некоторых незаменимых аминокислот. Комплексное исследование аминокислотного профиля может быть полезно и для данных категорий в целях оценки влияния режима питания на обменные процессы в организме.
Для чего используется исследование?
- Диагностика врожденных (наследственных) и приобретенных заболеваний, связанных с нарушением обмена аминокислот, жирных и органических кислот – при возникновении их клинических симптомов или при отягощенном семейном анамнезе по наличию аминоацидопатий и нарушений метаболизма жирных кислот.
- Дифференциальная диагностика причин патологии азотистого обмена, увеличения в крови содержания аммиака и нарушения его выведения из организма.
- Определение пищевого статуса (особенно у вегетарианцев и при спортивном режиме питания).
- Контроль эффективности терапии при подтвержденном диагнозе обменных нарушений.

- Контроль соблюдения рекомендаций по питанию.
Когда назначается исследование?
- При подозрении на нарушение метаболизма аминокислот и жирных кислот у детей, проявлениями которых могут быть нарушения работы ЖКТ (рвота, диарея), нарушение психомоторного и психоречевого развития, наличие специфического запаха и окраски пеленок (белья), нарушения кислотно-щелочного равновесия (метаболический ацидоз).
- Скрининг новорождённых, имеющих отягощенный семейный анамнез по обменным нарушениям.
- При нарушении утилизации аммиака и увеличения его концентрации в крови (гипераммониемия).
- Обследование лиц, придерживающихся принципов спортивного питания с употреблением в пищу протеинов или вегетарианства.
- Необходимость контроля соблюдения рекомендаций по питанию или применения лекарственных препаратов.
Механизм действия бета-аланина и исследовательская база
Бета-аланин является аминокислотой алифатического типа и входит в состав целого спектра биологически активных соединений (в отличие от альфа-аланина, который входит в состав белков).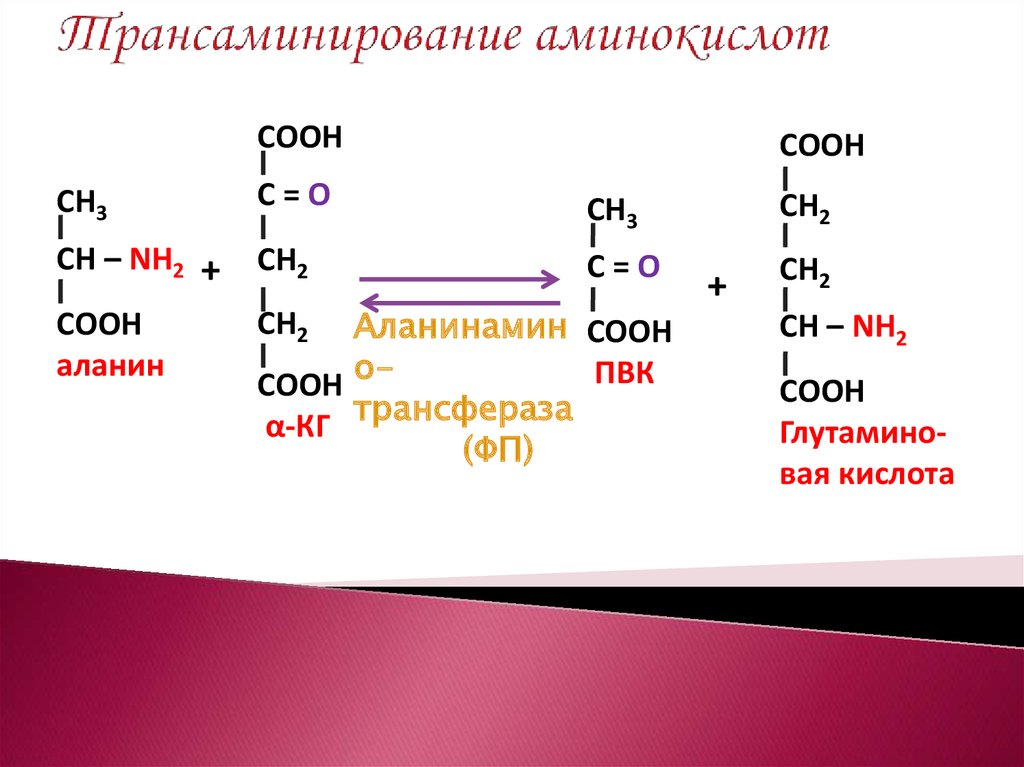 Также бета-аланин называют 3-аминопропионовой кислотой, в организме человека это вещество образуется при распаде карнозина (дипептид, выступающий главным мышечным буфером) и дигидроурацила (азотистое основание распространенного пиримидина дигидроуридина).
Также бета-аланин называют 3-аминопропионовой кислотой, в организме человека это вещество образуется при распаде карнозина (дипептид, выступающий главным мышечным буфером) и дигидроурацила (азотистое основание распространенного пиримидина дигидроуридина).
В основе биологического действия бета-аланина лежит тот факт, что данная аминокислота (совместно с гистидином) является прямым прекурсором карнозина, иными словами – карнозин синтезируется именно из бета-аланина. В свою очередь карнозин является важнейшим биогенным дипептидом, выполняющим функцию pH-буфера, то есть его присутствие позволяет мышцам работать дольше и интенсивнее. И вот, как это происходит.
В процессе анаэробной нагрузки происходит расщепление молекул глюкозы, и побочным эффектом этого процесса является образование лактата, из-за которого мышечная среда (ведь все это происходит в мышцах) становится более кислой (уровень pH снижается). Это приводит к утомлению мышц и снижению их работоспособности (что сопровождается характерным болевым синдромом в форме жжения или покалывания).
Причем здесь карнозин? А притом, что этот дипептид (в который преобразовывается бета-аланин) способен утилизировать лактат, тем самым стабилизируя уровень pH, повышая его и снижая кислотность среды. Как следствие – мышцы способны эффективно функционировать гораздо дольше. Этот эффект был открыт в 1952 году и назван «феноменом Северина» (феноменом – потому что на тот момент был не известен точный перечень функций карнозина).
Позже было доказано, что карнозин, выработку которого стимулирует прием бета-аланина, является антиоксидантом, он нейтрализует ряд агрессивных соединений, включая кислородные (свободные) радикалы. Также данное вещество имеет нейропротекторный эффект, оно выступает активным модулятором иммунной системы, улучшает функции сердца и сосудов, стабилизирует кровоток в мозговых тканях. Эти данные не вызывают сомнений, так как были неоднократно доказаны, в частности – работами М. Чеза «Двойное слепое плацебо-контролируемое исследование карнозиновой добавки» и Г. Клебанова «Влияние карнозина и его компонентов на свободные радикалы».
Клебанова «Влияние карнозина и его компонентов на свободные радикалы».
Стимуляция карнозина, на который приходится почти 20% всех буферных функций организма, является ключевым эффектом бета-аланина, определившим его популярность в качестве спортивной добавки. Исследование К. Ламонта «Кальций-сенсибилизирующее действие карнозина и других эндогенных имидазолов в поперечнополосатой мускулатуре» показало, что, помимо прочего, карнозин повышает чувствительную гибкость кальциевых канальцев в мышцах, что приводит к улучшению сократительных функций последних.
Наиболее важная веха в исследовании действия бета-аланина была подведена в 2005 году, когда Д. Стоут опубликовал свою резюмирующую работу «Международное общество спортивного питания о бета-аланине». В этой статье
Стоут собрал все имеющиеся исследования об искомой аминокислоте, в частности – в контексте применения бета-аланина в качестве спортивной добавки. Согласно работе Стоута, практические результаты актуальных исследований таковы:
Регулярный прием бета-аланина в течение 4-5 недель приводит к стабилизации pH-среды, снижается уровень закисления мышечных тканей, как результат – возрастает их работоспособность (но лишь в контексте анаэробных нагрузок).
Употребление бета-аланина спортсменами в качестве спортивной добавки в соответствии с рекомендованными алгоритмами приводит к общему повышению мышечной работоспособности, особенно – в моменты пиковой нагрузки продолжительностью 1-4 минуты.
Аминокислота бета-аланин оказывает комплексное укрепляющее воздействие на организм человека, стабилизируя, в частности, центральную нервную систему и стимулируя буферные процессы, одним из следствий этого является нормализация гормонального фона.
Вред бета-аланина не может быть доказан ввиду отсутствия предпосылок даже на гипотетическом уровне. Единственный «побочный эффект» от его приема – парестезия (покалывание в разных местах на коже), вызванная легким раздражением периферической нервной системы. Это абсолютно безвредно.
Любопытно отметить, что в 2014 году знаменитый американский биолог Д. Хоффман проводил ряд исследований с участием американских военных. После четырехнедельного курса приема аминокислоты бета-аланин у солдат наблюдалось общее повышение выносливости (порядка 10%), увеличение меткости и скорости прицеливания (в среднем на 15%). Это исследование было обозначено как одно из наиболее перспективных в плане возможного внедрения добавки в рацион регулярных частей.
Это исследование было обозначено как одно из наиболее перспективных в плане возможного внедрения добавки в рацион регулярных частей.
Таким образом, польза бета-аланина для человеческого организма у современных ученых не вызывает сомнений. Особенно это касается людей, которые испытывают повышенные анаэробные нагрузки. Важность приема данной аминокислоты в форме спортивной добавки имеет особое значение ввиду того факта, что бета-аланин практически не поступает в организм с пищей. Он входит в состав лишь немногих соединений, например – в состав пантотеновой кислоты (витамин В5), также немного бета-аланина содержится в мясе.
Среди атлетов, занимающихся силовым спортом, аминокислота бета-аланин получила широкую известность, но существует заблуждение, что это связано с анаболическим эффектом вещества. В действительности, речь идет сугубо о стимуляции карнозина, что абсолютно безвредно, и приводит к ощутимому повышению работоспособности в контексте отодвигания момента мышечного истощения (обусловленного закислением среды).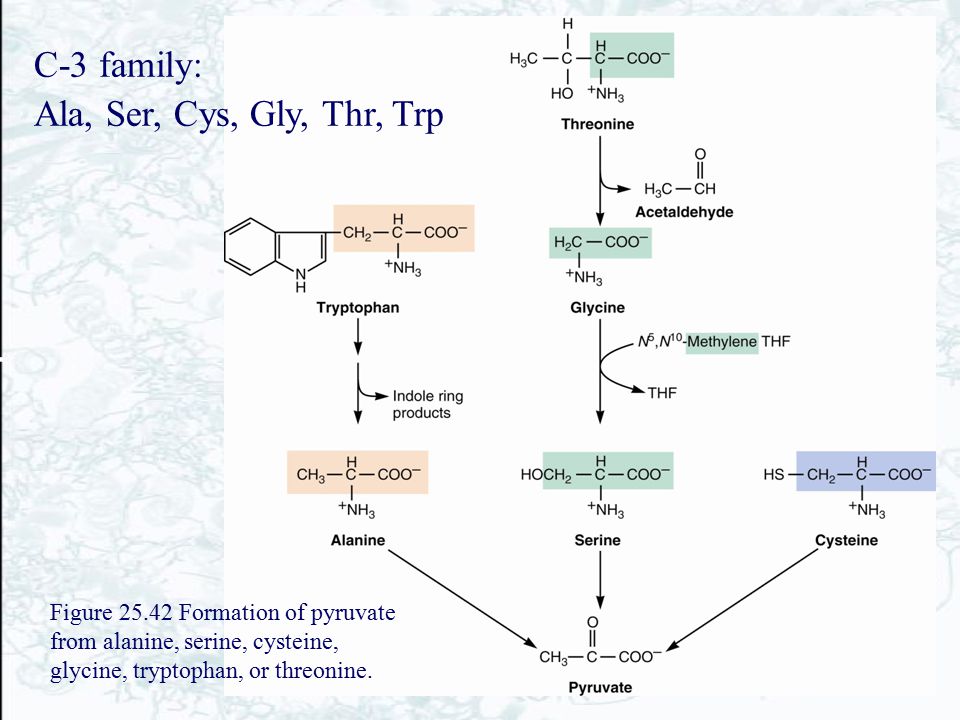 Обратите внимание, что бета-аланин, таким образом, не приводит к следующим эффектам:
Обратите внимание, что бета-аланин, таким образом, не приводит к следующим эффектам:
увеличение мышечной массы;
повышение аэробной выносливости.
Как показали исследования, прокомментированные в вышеупомянутой работе Д. Стоута, прием бета-аланина бесполезен для спортсменов, испытывающих не анаэробные, а аэробные нагрузки. Кроме того, искомая аминокислота не имеет никакого, даже косвенного отношения к синтезу мышечного белка, поэтому целью приема не может быть увеличение объемов мускульной ткани. Однако прием бета-аланин как спортивного питания позволяет эффективно решать следующие задачи:
увеличение анаэробной выносливости мышц;
повышение взрывной силы в контексте пикового напряжения;
существенное отдаление момента мышечной усталости;
улучшение биомеханической работы мускулов;
комплексное укрепление сердца, сосудов, иммунной системы;
существенное (до 15%) улучшение когнитивных функций;
комплексное повышение выносливости организма.
Польза бета-аланина обширна и имеет надлежащую доказательную базу, однако нужно понимать, что это лишь добавка, она не заменит грамотно составленную тренировочную программу и технику ее выполнения, но станет отличным «бонусом», который позволит атлету добиться лучших результатов. В этом – ключевая ценность спортивной добавки бета-аланин, она дает продолжительный, накапливающий эффект комплексного характера. Тут же стоит отметить, что в уже упомянутом эксперименте с американскими военными ученых удивил итоговый результат: спустя несколько месяцев после завершения цикла приема уровень бета-аланина (и, как следствие, карнозина) в организме повышается естественным образом и уже не падает.
Бета-аланин отлично комбинируется с большинством спортивных добавок. При этом не стоит примешивать его к предтренировочным комплексам, в составе которых он уже есть. Не будет никаких негативных последствий (кроме безвредной парестезии), однако это нецелесообразно, так как экспериментально доказано, что превышение единоразовой дозы в 6,4 грамма не приводит к увеличению эффективности.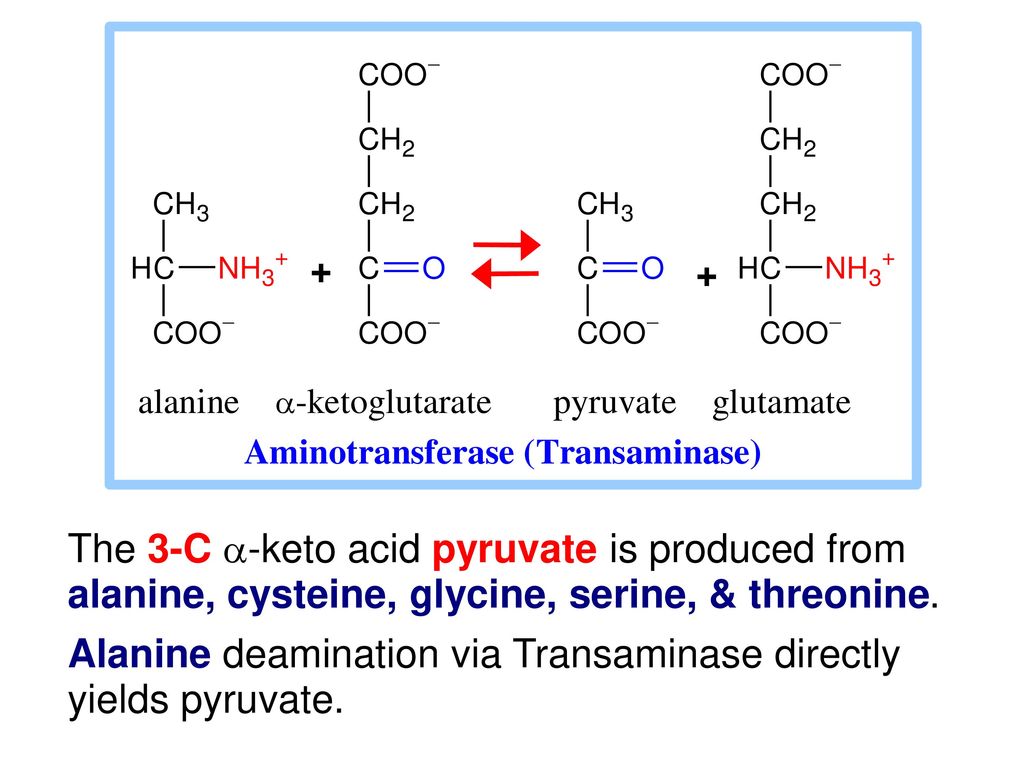 В тоже время для подавляющего большинства атлетов максимально эффективная доза гораздо ниже и находится в пределах 4-5 грамм.
В тоже время для подавляющего большинства атлетов максимально эффективная доза гораздо ниже и находится в пределах 4-5 грамм.
Исключительной силовой производительности можно добиться, комбинируя бета-аланин с креатином. В этом случае, принимая смесь непосредственно перед тренировкой (оптимально – за полчаса), атлет получает мощный стимулирующий эффект, значительно увеличивая свои силовые показатели, за счет чего можно добиться более продуктивной тренировки.
Также бета-аланин отлично комбинируется с BCAA и кофеином, умеренно усиливая их действие. Практически доказана эффективность комбинирования с сывороточным протеином и традиционными донаторами азота (к примеру, аргинин или агматин). При этом не выявлено ни одного случая не сочетаемости (некоторые атлеты даже комбинируют данную аминокислоту с пищевой содой с целью повышение выносливости).
Рекомендованные производителями дозы бета-аланина варьируются в пределах от 4 до 8 грамм. Столь существенный диапазон обусловлен тем, что многое зависит от индивидуальных особенностей метаболизма, веса атлета, уровня его подготовки и специфики занятий.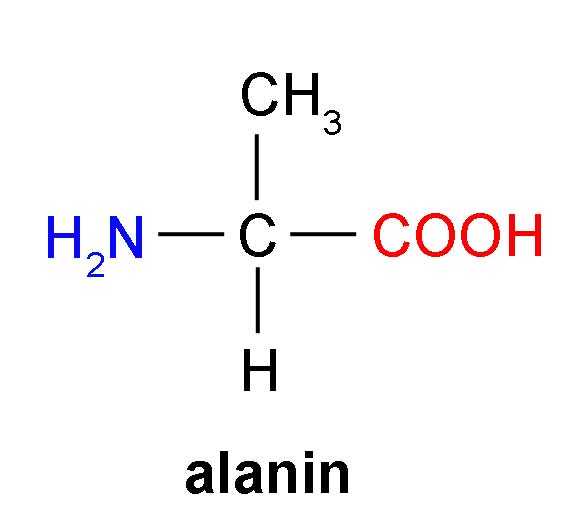 В среднем, практические наработки, справедливые для большинства спортсменов и доказанные экспериментально, говорят о минимально эффективной дозе в 3,2 грамма, тогда как максимально эффективная составляет 6,4 грамма.
В среднем, практические наработки, справедливые для большинства спортсменов и доказанные экспериментально, говорят о минимально эффективной дозе в 3,2 грамма, тогда как максимально эффективная составляет 6,4 грамма.
Разовый прием добавки (например – в комплексе с предтренировочным составом или креатином) дает разовый эффект. Но существует курсовая методика, в соответствии с ней бета-аланин необходимо употреблять регулярно – три раза в сутки через равные промежутки времени (соответственно – каждые 8 часов). Курс приема составляет 4-5 недель. Прием в рамках более короткого цикла не обоснован, так как аминокислота имеет накапливающий эффект, который сохраняется в течение 10 недель (исследование Р. Харриса «Пероральный прием бета-аланина и его влияние на синтез мышечного карнозина»).
Обратите внимание, что, несмотря на доказанную безвредность, употребление бета-аланина допустимо лишь после консультации с медицинским специалистом или квалифицированным тренером.
Информация переработана и дополнена http://csp-athletics. ru/images/doc/metod/gen/metod-gen-04-17.pdf
ru/images/doc/metod/gen/metod-gen-04-17.pdf
Автор статьи: Евгений Волоский
|
ЛЕЧЕНИЕ ИНТОКСИКАЦИЙ УДК 577.158.4;616.099,615.9 ЗАЩИТНЫЙ ЭФФЕКТ И КАТАБОЛИЗМ L-АЛАНИНА И L-ГЛУТАМАТА У КРЫС В УСЛОВИЯХ ЗАМКНУТОГО ПРОСТРАНСТВА Сарр Сандене, А.Я. Розанов, д.б.н., проф. Одесский государственный университет им. И.И. Мечникова, Украина Успехи нейрохимии определили новые подходы использования при различных видах гипоксии аминокислот, которые являются не только предшественниками нейротрансмиттеров, но и источником энергии при гипоксии головного мозга [1, 2], а также обладают многими другими функциями. В частности, метиловый эфир L-аланина расширяет кровеносные сосуды, освобождая в эндотелии NO [3], d-аминовалериановая кислота и глицил-глицин обладают противосудорожным действием [4]. В качестве антигипоксических препаратов на основе аминокислот в медицине используются калий-магниевые соли L-аспартата, g-аминобутират и его конъюгаты с никотиновой кислотой [5, 6]. Смеси аминокислот для парэнтерального введения, в частности содержащие аланин, глутамат и лейцин, используются в клинической практике при стрессовых состояниях [7], однако эффективность компонентов при гипоксии в эксперименте не оценена. Показано защитное действие аспартата и триптофана совместно с гистидином при гиперкапнической и гипобарической гипоксии [8, 9], N-ацетиласпартата и N-ацетилглутамата при гипотермии [10]. Антигипоксическое действие аспартата и глутамата очевидно, однако парентеральное их применение на практике ограничено побочным действием, в частности повреждением нейронов некоторых отделов головного мозга, особенно при передозировке [11]. Среди различных видов гипоксий различают субстратные (недостаточное поступление в митохондрии аминокислот, глюкозы, жирных кислот и кислорода), ферментные (связанные с нарушением структуры и функции ферментных систем тканевого дыхания), а также токсические [12–14]. Целью работы являлось исследование защитного действия L-аланина и L-глутамата при ГЗП и некоторых возможных его механизмов. Материалы и методы исследования Объектом исследования служили белые крысы самцы линии Вистар с массой тела 180–220 г, содержавшиеся на стандартном рационе вивария. Испытывали антигипоксическое действие L-аланина (ч.д.а. «Реахим») и L-глутамата (хроматографически чистый «Реахим»), которые вводили подкожно в дозе 2,0 ммоль/кг в виде мононатриевых солей в объеме 1,0 мл на 100 г массы тела (0,2 М растворы, предварительно нейтрализованные NaHCO3 до рН 7,2–7,4) за 2 мин до помещения животных в гермокамеру. Контрольным живот-ным вводили соответствующий объем физиологического раствора натрия хлорида. Катаболизм до 14СО2 меченых по a-карбоксилу 1-[14C]-L-аланина и 1-[14C]-L-глутамата с удельной радиоактивностью 2,16–2,18 Гбкммоль-1 (фирмы «Amersham») гомогенатами полушарий головного мозга определяли при конечной концентрации меченых аминокислот в инкубационной среде (ИС) 0,1 мМ–0,8 мМ при рН 7,2 (K,Na-фосфатный буфер 0,06 М) и температуре 37 °С. Результаты и их обсуждение Животных исследовали через 20 мин после помещения в гермокамеру, когда наблюдаются только признаки беспокойства («стрессовая фаза»), и в агональном состоянии (35–45 мин). После декапитации извлекали головной мозг, снимали мягкую мозговую оболочку и исследовали полушария головного мозга. При изучении катаболизма до 14СО2 в ИС добавляли меченые аминокислоты в концентрациях, близких к содержанию в головном мозге L-аланина, без добавления коферментов, а при исследовании активности ГДК также с добавлением пиридоксаль-5-фосфата (ПАЛФ). Результаты исследований (табл. 1) показали, что в первый «стрессовый» период действия факторов замкнутого пространства в полушариях головного мозга значительно увеличивается катаболизм до 14СО2 меченых по a-карбоксилу l-аланина и l-глутамата, а в агональном состоянии — достоверно снижается по сравнению с контролем при всех исследуемых концентрациях меченых аминокислот. Следует отметить, что при такой постановке экспериментов возможно учесть увеличение скорости катаболизма до 14СО2 в первую стрессовую фазу ГЗП (20 мин) и определить те конечные их концентрации, при которых это увеличение достоверно. Эти оптимальные концентрации меньше исходного содержания l-аланина и особенно l-глутамата в головном мозге и близки к содержанию в нем субстратов цикла трикарбоновых кислот (ЦТК). При низких концентрациях субстратов (0,1 и 0,2 мМ) скорость катаболизма до 14СО2 1-[14C]-L-аланина и 1-[14C]-L-глутамата гомогенатами полушарий головного мозга одинакова и только при больших концентрациях (0,2 и 0,4 мМ) наблюдается достоверное увеличение скорости катаболизма до 14СО2 меченого по a-карбоксилу L-глутамата по сравнению с L -аланином. Скорость катаболизма до 14 СО2 меченых аминокислот возрастает с увеличением их концентрации в инкубационной среде, что позволило рассчитать кажущуюся Vmax по координатам Лайнуивера-Бэрка для 1-[14C]-глутамата, которая составила 1250 нмоль/мин на 1 г головного мозга нормальных крыс [15]. Таким образом, эти исследования показали, что скорость метаболизма до 14СО2 меченых по a-карбоксилу L-аланина и L-глутамата возрастает с увеличением их концентрации в инкубационной среде. Из этого можно полагать, что допольнительное поступление исследуемых аминокислот из крови в головной мозг после введения в терапевтических дозах может увеличить потребление их головным мозгом в качестве источника энергетических субстратов. Можно также предполагать,что эти аминокислоты переаминируются до пирувата и a-кетоглутарата и используются в ЦТК по аминоферазному пути метаболизма [1]. Однако, L-глутамат, введенный в терапевтической дозе (2,0 ммоль/кг или 294 мг/кг), может подвергаться в головном мозге прямому декарбоксилированию под влиянием ГДК. Поэтому в следующей серии экспериментов мы определяли активность ГДК при действии факторов замкнутого пространства (табл. 2). Результаты исследований показали, что активность ГДК в полушариях головного мозга крыс достаточно стабильна к действию кофактора, концентрации субстрата in vitro и к влиянию ГЗП. В частности, «максимальная» активность ГДК в полушариях головного мозга крыс, выявляемая при избытке ПАЛФ и субстрата (212±9,7 нмольмин-1г-1), только на 22 % выше, чем активность «эндогенной» ГДК. Это свидетельствует о достаточном содержании ПАЛФ и L-глутамата в исходных гомогенатах и о малой чувствительности ГДК к избытку субстрата. При действии ГЗП «максимальная» активность ГДК увеличивается в полушариях головного мозга крыс в первый «стрессовый» период на 24 % и незначительно снижается в агональном периоде (на 16 %). Предварительная инъекция крысам L-глутамата существенно увеличивает «максимальную» активность ГДК в первый «стрессовый» период на 12 % и в агональный период на 36 %. Таким образом, можно предположить, что введение L-аланина, незначительно увеличивая активность ГДК, приводит к повышению уровня тормозного нейромедиатора — ГАМК в головном мозге при ГЗП. Усиление этой реакции инъекциями L-глутамата и L-аланина свидетельствует о защитном действии этих аминокислот. При этом ГАМК защищает нейроны не только как тормозной нейромедиатор, но и как дополнительный источник энергии при функционировании цикла Робертса в митохондриях и синаптосомах головного мозга. Эти данные и составили основной вклад в разработку вопроса о существенности увеличения средней продолжительности жизни (СПЖ) при острой ГЗП у крыс под влиянием предварительных инъекций аминокислот. Обобщенные результаты исследований представлены в табл. 3. При постановке экспериментов мы учитывали продолжительность жизни при ГЗП каждой крысы с точностью до 1 минуты. Как видно из табл. 3, при остром воздействии факторов замкнутого пространства наблюдается СПЖ у большей части крыс от 33 до 40 мин после помещения их в гермокамеру (84 % животных). У части животных (16 %) при этом СПЖ достигает 41–44 минуты. Такое бимодальное распределение обусловлено различной чувствительностью крыс к гипоксии. При предварительном введении аминокислот продолжительность жизни крыс при ГЗП увеличивается и бимодальное распределение времени агонального состояния не наблюдается. Так, при предварительном введении l-аланина в дозе 2,0 ммоля/кг время наступления клинической смерти крыс при ГЗП увеличивается, средняя продолжительность жизни колеблется в пределах 35–46 минут. Предварительное подкожное введение L-глутамата (2,0 ммоль/кг) еще больше увеличивает продолжительность жизни крыс при ГЗП; средняя подолжительность жизни при этом колеблется от 39 до 48 минут. Учитывая вышеизложенное, можно считать целесообразным применение L-аланина или L-глутамата для защиты от действия факторов замкнутого пространства. Защитное действие инъекций L-аланина и L-глутамата при ГЗП, по-видимому, обусловлено многими механизмами. В частности, большая эффективность применения L-глутамата может быть обусловлена и его непосредственными нейротрансмиттерными функциями в нейроструктурах головного мозга и, что более вероятно, действием продуктов его метаболизма, таких как ГАМК и N-ацетил-L-глутамат. Однако общим механизмом защитного действия L-аланина и L-глутамата при ГЗП является их использование в энергетических процессах митохондрий головного мозга, главным образом путем окислитель-ного декарбоксилирования образующихся из них пирувата и a-кетоглутарата. В заключение следует отметить множественность механизмов защитного действия исследованных нами аминокислот при ГЗП, в частности, возможность активации эндокринной системы как реакции на стресс. Литература | Содержание | |
Бета-аланин приносит пользу пожилым мужчинам, улучшая работу их мышц
Аминокислота бета-аланин уже хорошо себя зарекомендовала, но статья спортивных ученых из Университета Оклахомы, повысит ее репутацию еще больше. Исследователи показали, что бета-аланин повышает работоспособность мышц людей старше 55 лет. И это исследование, которое было опубликовано в журнале Международного общества спортивного питания, не финансировалось производителем добавок.
Механизм действия бета-аланина
Бета-аминокислота аланин является предшественником карнозина. Карнозин (или бета-аланил-L-гистидин) это дипептид являющийся эффективным ионно-водородным (Н + ) буфером в физиологическом диапазоне рН. В мускульных клетках, где его содержание наиболее высоко, карнозин вносит важный вклад в поддержание внутриклеточного рН, что жизненно важно для нормальной функции мышц при интенсивной физической нагрузке (простыми словами он позволяет мышцам продолжать работать дольше, прежде чем они устанут). Дипептид найден как в мышечных волокнах типа I, так и в типе II, причем в волокнах II типа его содержание выше. Медицинские исследования, проводимые на людях и крысах, показали обратную зависимость между возрастом и содержанием мышечного карнозина. Саркопения, потеря мышечной массы с возрастом, связана со значительным снижением силы, мощности и способности противостоять усталости у пожилых мужчин и женщин. Значительное снижение скелетной мускулатуры и снижение функции мышц отчетливо проявляется после достижения пятидесяти лет. Ухудшение моторной координации в результате потери силы и / или утомления связано с увеличением частоты падений, которые многократно приводят к травмам и даже смертельным исходам среди лиц пожилого возраста.
Ухудшение моторной координации в результате потери силы и / или утомления связано с увеличением частоты падений, которые многократно приводят к травмам и даже смертельным исходам среди лиц пожилого возраста.
Исследование действия бета-аланина у пожилых людей
Добавление бета-аланина может значительно увеличить уровень карнозина в скелетных мышцах, и это увеличение коррелирует с улучшением эффективности физических упражнений. Например, Stout et al. (*,**) использовали тест PWC FT для изучения влияния добавок бета-аланина у молодых (от 18 до 30 лет) мужчин и женщин и сообщили о значительном увеличении PWC FT от 12 до 15% при использовании добавки. Соответственно, Stout et al предположили, что увеличение PWC FT было результатом вызванного бета-аланином увеличения содержания карнозина в скелетных мышцах, что увеличивало способность мышц к буферизации H + во время физической нагрузки.
Мышцы пожилых людей работают не так хорошо, как у молодых, и одной из причин этого вполне может быть снижение концентрации бета-аланина в их мышцах. Исследователи решили посмотреть, оказывают ли бета-аланиновые добавки влияние на эту группу. Они отобрали почти тридцать здоровых пожилых людей, и дали половине из них ежедневную добавку 2400 мг бета-аланина. Они принимали по 800 мг капсулы бета-аланина с каждым приемом пищи, в течение девяноста дней. Другой половине испытуемых давали плацебо. В конце трех месяцев исследователи приступили к экспериментам. Они прикрепляли электроды к мышцам ног испытуемых, а затем измеряли объем работы, которую они могли бы выполнять, не испытывая усталости. Техническое название этого измерения — «физическая работоспособность на пороге усталости». [PWC-FT] на рисунке ниже показано, что произошло с PWC-FT до и после эксперимента.
Исследователи решили посмотреть, оказывают ли бета-аланиновые добавки влияние на эту группу. Они отобрали почти тридцать здоровых пожилых людей, и дали половине из них ежедневную добавку 2400 мг бета-аланина. Они принимали по 800 мг капсулы бета-аланина с каждым приемом пищи, в течение девяноста дней. Другой половине испытуемых давали плацебо. В конце трех месяцев исследователи приступили к экспериментам. Они прикрепляли электроды к мышцам ног испытуемых, а затем измеряли объем работы, которую они могли бы выполнять, не испытывая усталости. Техническое название этого измерения — «физическая работоспособность на пороге усталости». [PWC-FT] на рисунке ниже показано, что произошло с PWC-FT до и после эксперимента.
Эффект бета-аланина похож на эффект креатина, но он работает по-другому. Вот почему спортивные ученые подозревают, что комбинация креатина и бета-аланина может быть довольно эффективной смесью.
«Результаты этого исследования показывают, что девяностодневная добавка бета-аланина может значительно увеличить внутримышечный карнозин, что приводит к увеличению PWC FT на 28,5% из-за большей буферной способности H+.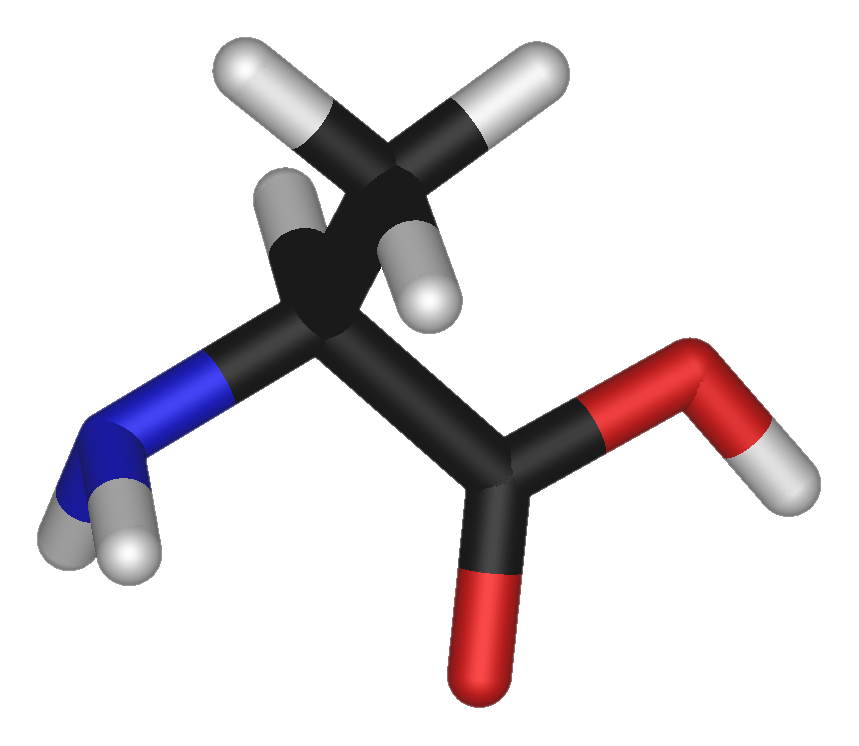 », — резюмировали ученые.
», — резюмировали ученые.
Источник:
- The effect of beta-alanine supplementation on neuromuscular fatigue in elderly (55–92 Years): a double-blind randomized study. Jeffrey R Stout, B Sue Graves, Abbie E Smith, Michael J Hartman, Joel T Cramer, Travis W Beck & Roger C Harris. Journal of the International Society of Sports Nutrition volume 5, Article number: 21 (2008)
- *Stout JR, Cramer JT, Mielke M, O’Kroy J, Torok DJ, Zoeller RF: Effects of twenty-eight days of beta-alanine and creatine monohydrate supplementation on the physical working capacity at neuromuscular fatigue threshold. Journal of strength and conditioning research/National Strength & Conditioning Association. 2006, 20 (4): 928-931.
- **Stout JR, Cramer JT, Zoeller RF, Torok D, Costa P, Hoffman JR, Harris RC, O’Kroy J: Effects of beta-alanine supplementation on the onset of neuromuscular fatigue and ventilatory threshold in women. Amino acids. 2007, 32 (3): 381-386. 10.1007/s00726-006-0474-z.

BeFirst Beta Alanine Powder
Beta Alanine Powder от Be First – это спортивная пищевая добавка для увеличения времени работы мышц под нагрузкой, т.е. выносливости. Прием бета-аланина повышает уровень карнозина в мышцах, который препятствует накоплению молочной кислоты в работающих мышцах и таким образом, отодвигает наступление усталости.
Прием Be First Beta Alanine Powder способствует:
- увеличение взрывной силы мышц,
- росту мышечной массы,
- повышению аэробной и анаэробной выносливости,
- улучшению процесса восстановления.
Аланин – одна из 20 протеиногенных аминокислот, участвующая также в глюконеогенезе. У нее есть два изомера – альфа-аланин и бета-аланин. Альфа-аланин содержит аминогруппу в середине молекулы и участвует в синтезе белков. Бета-аланин аминогруппу содержит в бета-положении, т.е. на конце молекулы и он не входит в состав структурных белков, а является частью некоторых белковых ферментов, в частности, карнозина.
В чем роль карнозина?
Карнозин в больших количествах содержится в тканях мышц и мозга, и является мощным антиоксидантом, а также способен поддерживать кислотный баланс в тканях (в частности, в мышцах), препятствуя их закислению и блокируя негативные эффекты накапливающего в работающей мышце лактата (продукта расщепления глюкозы). Таким образом, карнозин повышает работоспособность мышц, их способность работать длительное время без усталости. А карнозин состоит из бета-аланина и гистидина. При пероральном приеме карнозина его молекулы расщепляются в пищеварительном тракте, поэтому на повышение концентрации карнозина большее влияние оказывает прием бета-аланина (при отсутствии недостатка гистидина).
Что даст прием Beta Alanine Powder от Be First?
Большая часть полезных эффектов бета-аланина, приносящих спортсмену прямую выгоду, обусловлена способностью бета-аланина повышать концентрацию карнозина в мышцах, но, кроме того, бета-аланин участвует в синтезе гликогена в печени, препятствует падению уровня глюкозы в крови (особенно при низкоуглеводной диете), обладает нейропротекторными свойствами, защищает функции памяти, а также положительно влияет на сперматогенез и деятельность предстательной железы.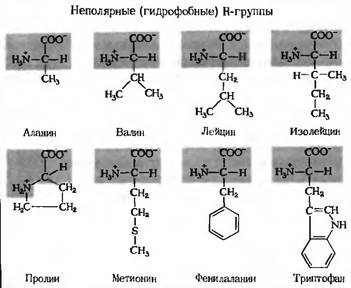 Тем не менее, прежде всего от приема бета-аланина ожидаются следующие эффекты:
Тем не менее, прежде всего от приема бета-аланина ожидаются следующие эффекты:
- повышение анаэробной выносливости, т.е. увеличение время работы до отказа,
- повышение порога усталости, и возможность выполнить больше повторений,
- повышение мощности мышечных усилий,
- уменьшение болей в мышцах после тренировки,
- ускорение восстановления после тяжелых тренировок, а также после травм,
- улучшение когнитивных способностей – концентрации, умственной работоспособности и пр.
Полезные действия бета-аланина хорошо изучены и подтверждены длинным рядом медицинских исследований. Очень часто прием бета-аланина сопровождался приростом мышечной массы и замедлением роста жировой ткани.
Кому нужно принимать бета-аланин?
По исследованиям спортивных медиков прием бета-аланина повышает концентрацию карнозина (в иных случаях на 80 %) как у опытных, так и начинающих спортсменов. Поскольку буферная роль карнозина наиболее важна именно в анаэробных нагрузках, то бета-аланин весьма полезен представителям силовых видов спорта и менее эффективен для легкоатлетов.
Поскольку буферная роль карнозина наиболее важна именно в анаэробных нагрузках, то бета-аланин весьма полезен представителям силовых видов спорта и менее эффективен для легкоатлетов.
Важно также, что спортсмены, придерживающиеся специфических диет, ограничивающих поступление полноценных белков в организм, например, вегетарианцы, имеют изначально более низкий уровень карнозина, что может нивелировать дополнительный прием Beta Alanine Powder от Be First. А также бета-аланин хорошо подходит спортсменам старше среднего возраста, у которых выработка собственного бета-аланина (и как следствие карнозина) замедляется в силу естественных причин. При этом на мужчин и на женщин бета-аланин действует одинаково.
Какие побочные эффекты может вызвать прием бета-аланина?
Неоднократно отмечалось, что прием бета-аланина в количестве более 800 мг вызывал у некоторых испытуемых ощущения покалывания или жжения в области лица и конечностей в течение некоторого времени после приема.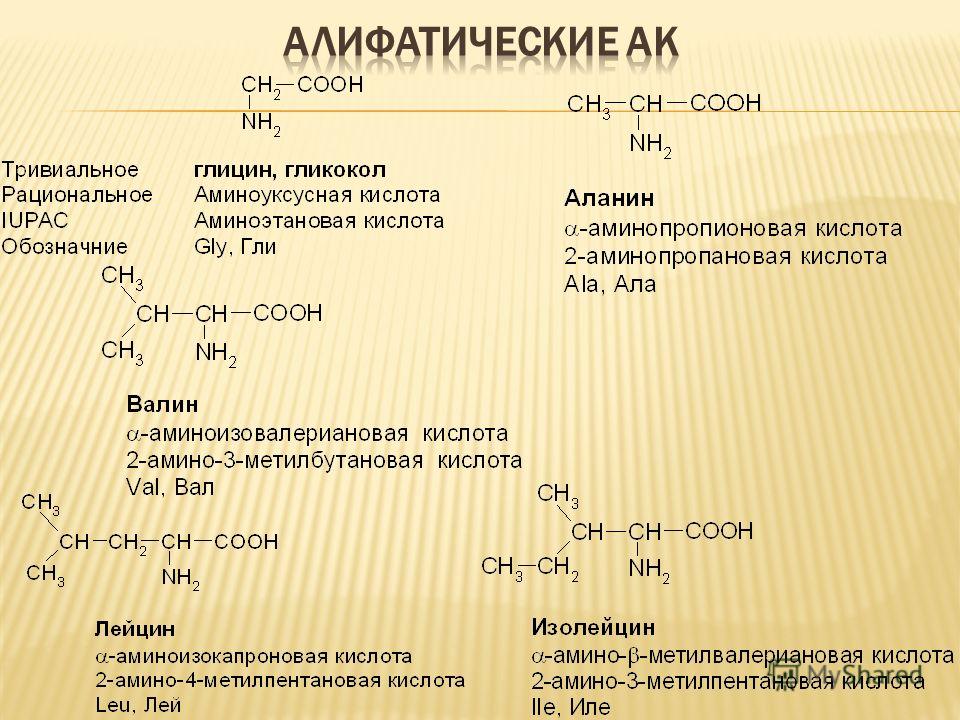 Это ощущение возникает в результате повышения чувствительности периферических нервных окончаний в моменты достижения пиковой концентрации бета-аланина в крови. Оно совершенно безопасно и говорит лишь о том, что для организма такое резкое повышение концентрации бета-аланина непривычно. Если такие ощущения доставляют беспокойство, обычно рекомендуется снизить дозировку, разделить дозу добавки на несколько приемов или принимать добавку совместно с пищей.
Это ощущение возникает в результате повышения чувствительности периферических нервных окончаний в моменты достижения пиковой концентрации бета-аланина в крови. Оно совершенно безопасно и говорит лишь о том, что для организма такое резкое повышение концентрации бета-аланина непривычно. Если такие ощущения доставляют беспокойство, обычно рекомендуется снизить дозировку, разделить дозу добавки на несколько приемов или принимать добавку совместно с пищей.
Как принимать бета-аланин?
Бета-аланин показывает хорошие результаты при приеме на протяжении от 2-4 недель до 10 недель в количестве 4-5 г в сутки, и в кратковременных тренировочных нагрузках. При долговременных нагрузках (дольше 25 минут) данные о действии бета-аланина становятся противоречивыми. Поэтому чаще всего рекомендуют принимать бета-аланин через равные промежутки времени (6-8 часов) либо непосредственно перед тренировкой. С целью лучшего восстановления можно принимать бета-аланин также и после тренировки.
Сочетание с другими добавками
Бета-аланин хорошо сочетается с другими спортивными добавками – с креатином, с BCAA, донаторами азота (аргинин, цитруллин) а также протеином и кофеином. Со многими из них бета-аланин образует синергический эффект. А вот с таурином бета-аланин конкурирует, поэтому теоретически высказывалось опасение, что длительный прием бета-аланина может вызвать дефицит таурина. Возможно, поэтому их иногда сочетают в одной добавке.
Продукт Be First Beta Alanine Powder разработан при участии специалистов мирового уровня в области спортивного питания и произведен в соответствии с мировыми стандартами качества на предприятии, обладающем международными сертификатами ISO и HACCP. Благодаря профессионально составленной рецептуре и использованию высококачественного сырья, Be First Beta Alanine Powder обладает максимальной эффективностью и наилучшей степенью усвоения организмом.
Рекомендации к применению
Смешайте одну порцию с 200-250 мл воды или любого другого напитка.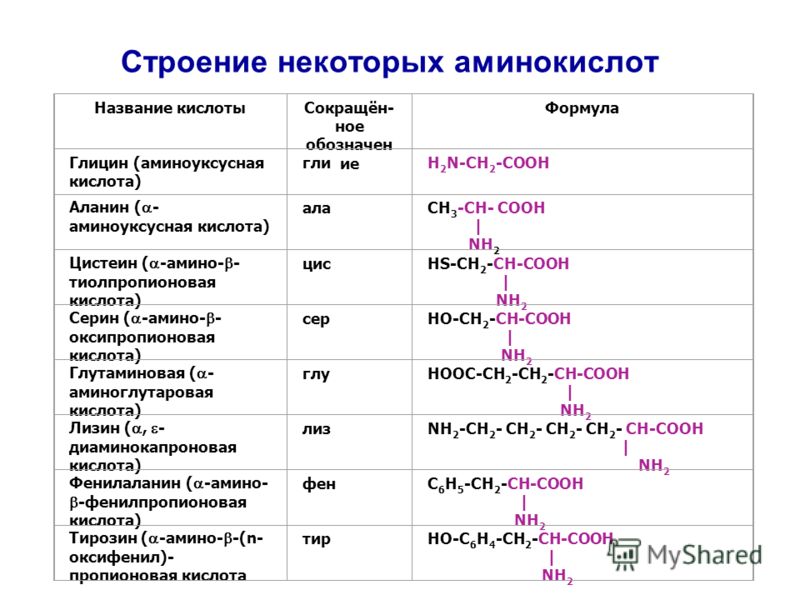 В дни тренировок рекомендуется принимать одну порцию за 30 минут до тренировки и одну порцию сразу после тренировки. В остальные дни рекомендуется принимать продукт по 1 порции 1-2 раза в день между приемами пищи.
В дни тренировок рекомендуется принимать одну порцию за 30 минут до тренировки и одну порцию сразу после тренировки. В остальные дни рекомендуется принимать продукт по 1 порции 1-2 раза в день между приемами пищи.
Внимание: Продукт не является лекарственным средством и не предназначен для лиц моложе 18 лет, беременных и кормящих женщин. Перед приемом проконсультируйтесь с врачом. Не превышайте указанную дозировку. Меры предосторожности: хранить в недоступном для детей месте. Продукт не является заменителем пищи. Не следует превышать рекомендуемую дозировку. Производитель не несёт ответственности за любой вред, причинённый в результате ненадлежащего использования или хранения продукта.
Бета-аланин: применение и риски
Бета-аланин — это незаменимая аминокислота, которая естественным образом вырабатывается в организме.
Бета-аланин помогает в производстве карнозина. Это соединение играет важную роль в выносливости мышц при выполнении упражнений высокой интенсивности.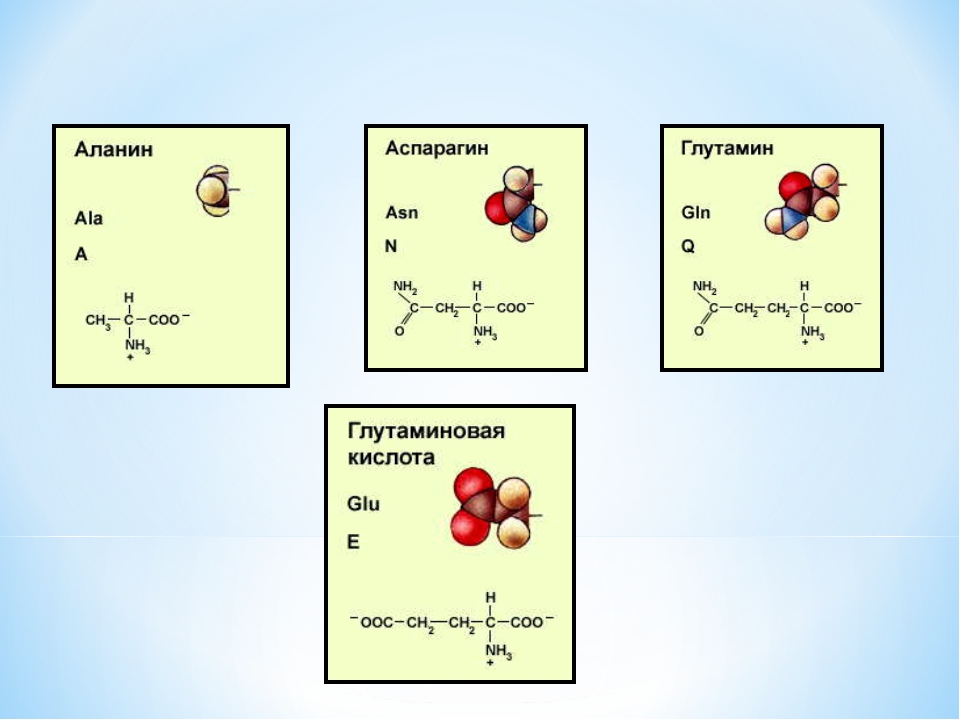
Почему люди принимают добавки бета-аланина?
Бета-аланин продается как средство повышения спортивных результатов и выносливости. Некоторые научные данные подтверждают такое использование, но исследования были небольшими, а результаты неубедительными.
Вот как это работает. Мышцы содержат карнозин. Более высокий уровень карнозина может позволить мышцам работать дольше, прежде чем они утомятся. Карнозин делает это, помогая регулировать накопление кислоты в мышцах, что является основной причиной мышечной усталости.
Бета-аланин — один из основных ингредиентов карнозина. Считается, что добавки с бета-аланином увеличивают выработку карнозина и, в свою очередь, улучшают спортивные результаты.
Однако обзор исследований добавки с бета-аланином показывает, что она не увеличивает мышечную силу или аэробную выносливость.Вместо этого, кажется, что это немного увеличивает количество времени, в течение которого спортсмен может выполнять упражнения высокой интенсивности, такие как поднятие тяжестей и спринт, прежде чем он истощится.
Продолжение
Это не обязательно означает, что спортсмены добьются лучших результатов. В одном исследовании спринтеры, принимавшие бета-аланин, не улучшили свои результаты в беге на 400 метров.
Не совсем ясно, какие преимущества можно получить от приема добавок бета-аланина. Некоторые исследования показывают, что для повышения уровня карнозина в мышцах могут потребоваться недели при использовании добавок.
Стандартные дозы не установлены. Кроме того, качество и активные ингредиенты в добавках могут сильно различаться от производителя к производителю. Это затрудняет установление стандартной дозы.
Можно ли получить бета-аланин из пищи?
Пищевые источники бета-аланина и карнозина включают:
- Мясо
- Рыба
- Птица (особенно белое мясо, подобное тому, которое содержится в куриных грудках)
Каковы риски приема добавок бета-аланина?
Некоторые люди сообщают о покалывании кожи после приема больших доз бета-аланина.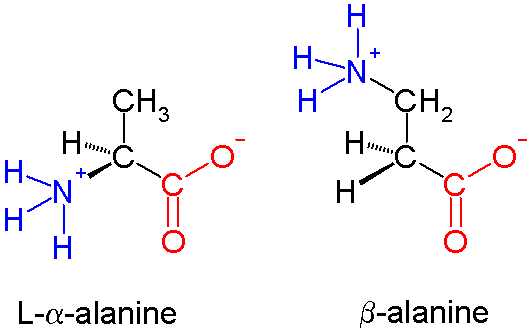
Бета-аланин может взаимодействовать с некоторыми сердечными препаратами и препаратами от эректильной дисфункции. И его безопасность не установлена для детей, людей с определенными заболеваниями или состояниями, а также для беременных или кормящих женщин.
Продолжение
Проконсультируйтесь с врачом, прежде чем принимать бета-аланин.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) регулирует пищевые добавки; однако он обращается с ними как с едой, а не с лекарствами. В отличие от производителей лекарств, производителям добавок не нужно доказывать, что их продукты безопасны или эффективны, прежде чем продавать их на рынке.
Бета-аланин — руководство для новичков
Бета-аланин — популярная добавка среди спортсменов и любителей фитнеса.
Это потому, что было доказано, что он повышает производительность и улучшает общее состояние здоровья.
В этой статье объясняется все, что вам нужно знать о бета-аланине.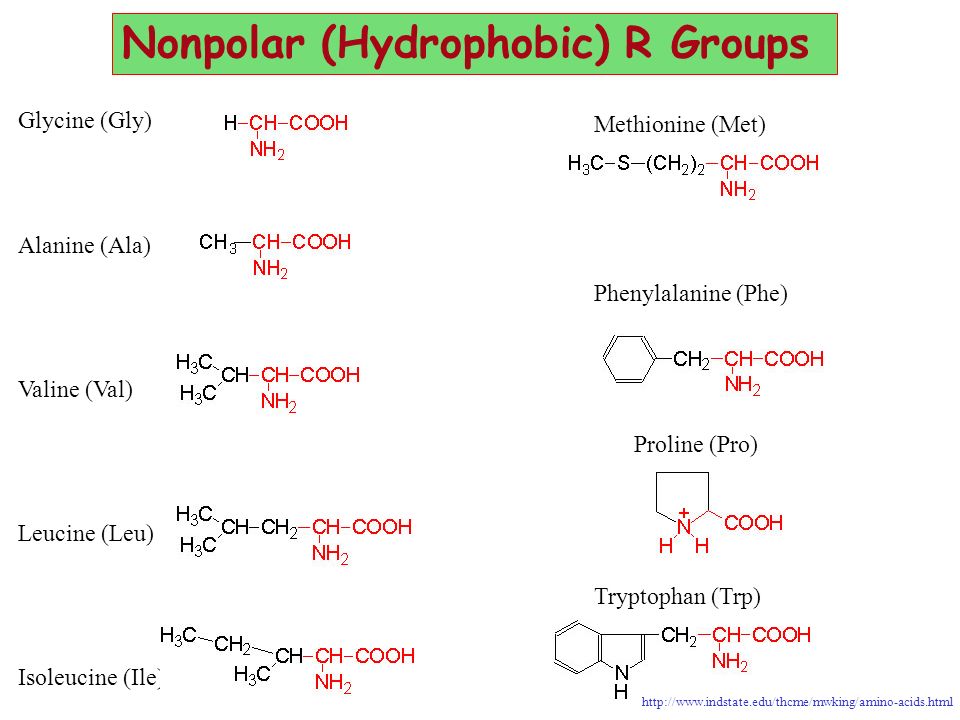
Бета-аланин — незаменимая аминокислота.
В отличие от большинства аминокислот, он не используется вашим организмом для синтеза белков.
Вместо этого вместе с гистидином он производит карнозин.Затем карнозин накапливается в ваших скелетных мышцах (1).
Карнозин снижает накопление молочной кислоты в мышцах во время упражнений, что приводит к улучшению спортивных результатов (2, 3).
РезюмеБета-аланин является незаменимой аминокислотой. Ваше тело использует его для выработки карнозина, который помогает улучшить результаты упражнений.
В ваших мышцах уровни гистидина обычно высокие, а уровни бета-аланина низкие, что ограничивает выработку карнозина (1, 4).
Было показано, что добавление бета-аланина повышает уровень карнозина в мышцах на 80% (4, 5, 6, 7, 8).
Вот как карнозин действует во время упражнений:
- Глюкоза расщепляется: Гликолиз — это расщепление глюкозы, которая является основным источником топлива во время упражнений высокой интенсивности.

- Вырабатывается лактат: Во время упражнений ваши мышцы расщепляют глюкозу на молочную кислоту. Он превращается в лактат, который производит ионы водорода (H +).
- Мышцы становятся более кислыми: Ионы водорода снижают уровень pH в мышцах, делая их более кислыми.
- Усталость наступает: Кислотность мышц блокирует распад глюкозы и снижает способность мышц сокращаться. Это вызывает утомляемость (8, 9, 10).
- Карнозиновый буфер: Карнозин служит буфером против кислоты, снижая кислотность в мышцах во время упражнений высокой интенсивности (8, 11).
Поскольку добавки бета-аланина повышают уровень карнозина, они помогают вашим мышцам снизить уровень кислоты во время упражнений.Это снижает общую усталость.
РезюмеДобавки с бета-аланином увеличивают содержание карнозина, который снижает кислотность мышц во время упражнений высокой интенсивности.
Бета-аланин улучшает спортивные результаты за счет снижения утомляемости, повышения выносливости и повышения производительности при высокоинтенсивных упражнениях.
Увеличивает время до истощения
Исследования показывают, что бета-аланин помогает увеличить время до истощения (TTE).
Другими словами, это помогает вам тренироваться в течение более длительных периодов времени.Исследование, проведенное с участием велосипедистов, показало, что четыре недели приема добавок увеличивают общий объем выполненной работы на 13%, а через 10 недель — еще на 3,2% (3, 5, 8, 12).
Точно так же у 20 мужчин, прошедших сравнимый велосипедный тест, время до истощения увеличилось на 13–14% после четырех недель приема добавок бета-аланина (13).
Преимущества более коротких упражнений
В целом мышечный ацидоз ограничивает продолжительность упражнений высокой интенсивности.
По этой причине бета-аланин особенно помогает во время высокоинтенсивных и краткосрочных упражнений продолжительностью от одной до нескольких минут.
Одно исследование показало, что шесть недель приема бета-аланина увеличили TTE на 19% во время высокоинтенсивных интервальных тренировок (HIIT) (14).
В другом исследовании 18 гребцов, принимавших добавки в течение семи недель, были на 4,3 секунды быстрее, чем группа плацебо, в беге на 2000 метров продолжительностью более 6 минут (15).
Другие преимущества
Для пожилых людей бета-аланин может помочь повысить мышечную выносливость (16).
При тренировке с отягощениями он может увеличить тренировочный объем и снизить утомляемость.Однако нет убедительных доказательств того, что бета-аланин улучшает силу (17, 18, 19, 20).
РезюмеБета-аланин наиболее эффективен при упражнениях продолжительностью от одной до нескольких минут. Это может помочь снизить усталость, увеличивая при этом физическую выносливость и мышечную выносливость.
Некоторые данные свидетельствуют о том, что бета-аланин может улучшить композицию тела.
Одно исследование показало, что прием добавок в течение трех недель увеличивает мышечную массу (21).
Возможно, бета-аланин улучшает состав тела, увеличивая тренировочный объем и способствуя росту мышц.
Однако некоторые исследования не показывают значительных различий в составе тела и массе тела после лечения (20, 22).
РезюмеБета-аланин может помочь увеличить объем упражнений. Это может привести к увеличению безжировой массы тела, хотя доказательства неоднозначны.
Бета-аланин повышает уровень карнозина, что может иметь ряд преимуществ для здоровья.
Интересно, что исследования на животных и в пробирках показывают, что карнозин обладает антиоксидантными, антивозрастными и иммуностимулирующими свойствами.Однако необходимы исследования на людях.
Антиоксидантные свойства карнозина включают нейтрализацию свободных радикалов и снижение окислительного стресса (23, 24, 25).
Более того, исследования в пробирках показывают, что карнозин увеличивает выработку оксида азота. Это может помочь бороться с процессом старения и улучшить здоровье сердца (26).
Это может помочь бороться с процессом старения и улучшить здоровье сердца (26).
Наконец, карнозин может улучшить качество и функцию мышц у пожилых людей (16, 27).
РезюмеКарнозин обладает антиоксидантными и иммуностимулирующими свойствами.Он также улучшает функцию мышц у пожилых людей.
Основные пищевые источники бета-аланина — это мясо, птица и рыба.
Он входит в состав более крупных соединений, в основном карнозина и ансерина, но при их переваривании высвобождается.
Вегетарианцы и веганы содержат примерно на 50% меньше карнозина в мышцах по сравнению с всеядными животными (28).
Хотя большинство людей могут получить достаточное количество бета-аланина из своего рациона, добавки повышают его уровень еще больше.
РезюмеБета-аланин можно получить из продуктов, богатых карнозином, таких как мясо, птица и рыба.
Стандартная дозировка бета-аланина составляет 2–5 граммов в день (29).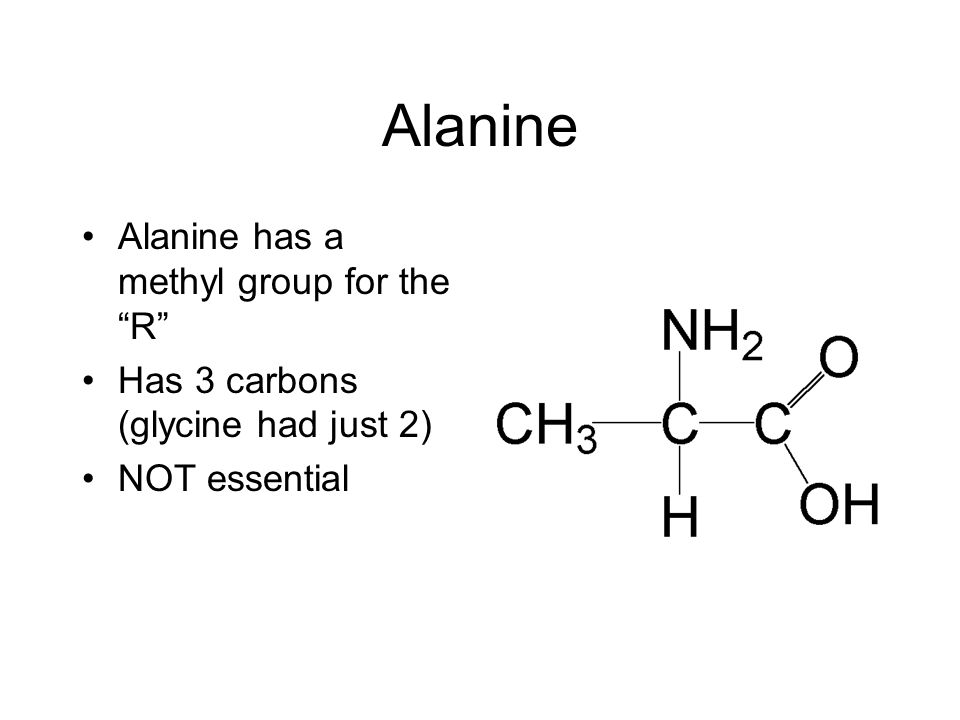
Употребление бета-аланина во время еды может еще больше повысить уровень карнозина (30).
Добавки бета-аланина, кажется, лучше восполняют уровень карнозина в мышцах, чем сам прием карнозина (31).
РезюмеОбычно рекомендуется употреблять 2–5 граммов бета-аланина в день.Принимать его во время еды может быть даже более эффективным.
Прием чрезмерного количества бета-аланина может вызвать парестезию — необычное ощущение, обычно описываемое как «покалывание в коже». Обычно это проявляется на лице, шее и тыльной стороне рук.
Интенсивность покалывания увеличивается с увеличением дозы. Этого можно избежать, принимая небольшие дозы — около 800 мг за раз (3).
Нет никаких доказательств того, что парестезия каким-либо образом вредна (32).
Еще один возможный побочный эффект — снижение уровня таурина.Это связано с тем, что бета-аланин может конкурировать с таурином за поглощение в мышцах.
РезюмеПобочные эффекты включают покалывание и снижение таурина.
Данные ограничены, но бета-аланин кажется безопасным для здоровых людей.
Бета-аланин часто сочетается с другими добавками, включая бикарбонат натрия и креатин.
Бикарбонат натрия
Бикарбонат натрия, или пищевая сода, улучшает физическую работоспособность за счет снижения содержания кислоты в крови и мышцах (3).
Во многих исследованиях изучалась комбинация бета-аланина и бикарбоната натрия.
Результаты свидетельствуют о некоторых преимуществах сочетания этих двух добавок, особенно во время упражнений, при которых ацидоз мышц снижает работоспособность (33, 34).
Креатин
Креатин помогает выполнять высокоинтенсивные упражнения за счет увеличения доступности АТФ.
Было показано, что при совместном использовании креатин и бета-аланин улучшают физическую работоспособность, силу и мышечную массу (35, 36, 37).
РезюмеБета-аланин может быть еще более эффективным в сочетании с такими добавками, как бикарбонат натрия или креатин.
Бета-аланин повышает работоспособность за счет увеличения переносимости физических упражнений и снижения мышечной усталости.
Он также обладает антиоксидантными, иммуностимулирующими и антивозрастными свойствами.
Вы можете получить бета-аланин из продуктов, содержащих карнозин, или из пищевых добавок. Рекомендуемая доза составляет 2–5 граммов в день.
Хотя чрезмерное количество может вызвать покалывание в коже, бета-аланин считается безопасной и эффективной добавкой для повышения работоспособности.
Аминокислоты — преимущества, структура и функции
Определение
Аминокислоты являются строительными блоками полипептидов и белков и играют важную роль в метаболических путях, экспрессии генов и регуляции трансдукции клеточных сигналов. Одна молекула органической аминокислоты содержит две функциональные группы — амин и карбоксил — и уникальную боковую цепь. Людям требуется двадцать различных аминокислот; одиннадцать синтезируются в организме и девять поступают из пищевых источников.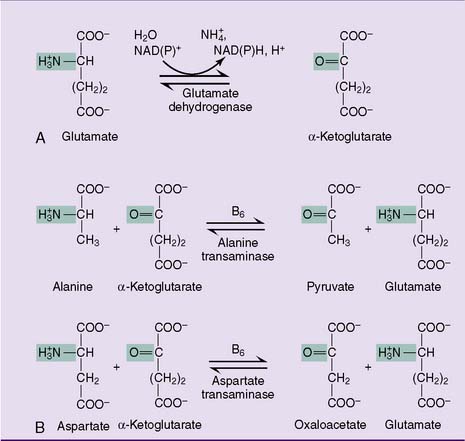
Преимущества аминокислот
Преимущества аминокислот легко назвать, потому что без аминокислот мы не можем существовать. Все анатомические и физиологические особенности живого организма стали возможными благодаря существованию аминокислот. Синтез незаменимых в питательном отношении аминокислот в организме человека — аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутаминовой кислоты, глутамина, глицина, пролина, серина и тирозина — происходит за счет построения de novo их углеродных скелетов.Тем не менее, недавние исследования показывают, что мы все еще можем извлечь выгоду из употребления незаменимых аминокислот для поддержания оптимального здоровья и благополучия. Только когда количество незаменимых аминокислот и глюкозы является достаточным и доступным, скорость синтеза заменимых аминокислот может увеличиваться. . Поэтому важно употреблять в рационе оба типа аминокислот, чтобы извлечь пользу из их многочисленных положительных, если не абсолютно необходимых, эффектов.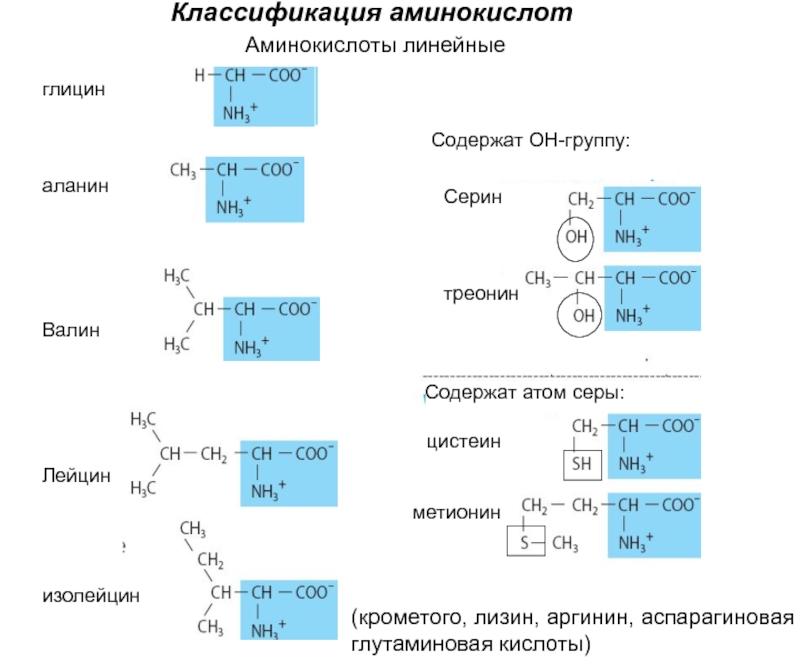
Преимущества незаменимых аминокислот
Девять незаменимых аминокислот — это гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.Эти аминокислоты не могут вырабатываться в организме, но они имеют решающее значение для огромного количества физиологических функций.
Гистидин является предшественником различных гормонов и метаболитов, важных для функции почек, желудочной секреции, иммунной системы и нейротрансмиссии. Он помогает производить эритроциты и гемоглобин. Кроме того, гистидин катализирует действие большого количества ферментов и помогает в противовоспалительных и антиоксидантных процессах. Дефицит гистидина приводит к анемии, дисфункции почек, окислительному стрессу и воспалительным заболеваниям.
Изолейцин — одна из трех аминокислот с разветвленной цепью (BCAA). Это помогает увеличить скорость синтеза белка и способствует формированию мышечной ткани. Кроме того, известно, что изолейцин улучшает потребление глюкозы, развитие кишечника и иммунную функцию, хотя во многих исследованиях изучались BCAA в целом, а не отдельная аминокислота.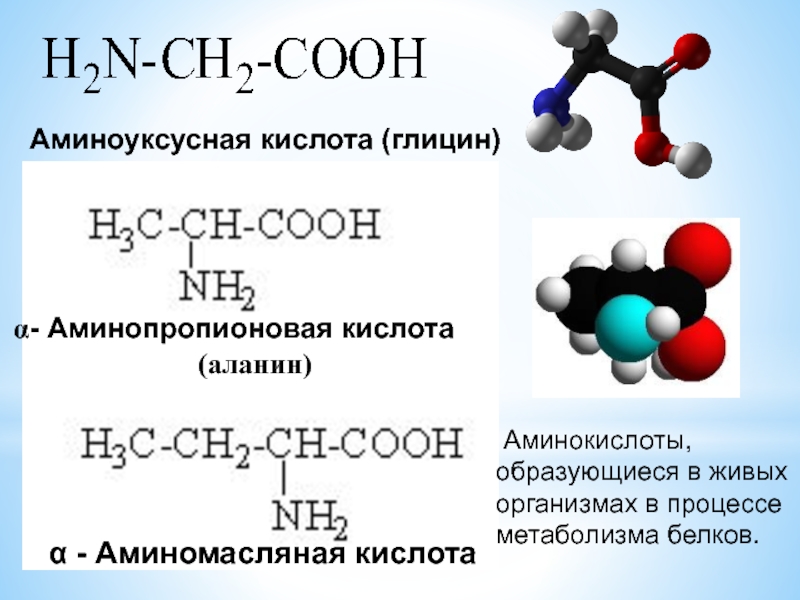 Это означает, что лейцин и валин — также незаменимые аминокислоты — могут иметь эти преимущества.
Это означает, что лейцин и валин — также незаменимые аминокислоты — могут иметь эти преимущества.
Лизин играет важную роль в делении и росте клеток, поскольку он является основным строительным блоком факторов роста.Ускоренное заживление ран с использованием растворенных веществ на основе лизина приводит к меньшему образованию рубцовой ткани, в то время как участки, получающие мало кислорода и питательных веществ, которым непосредственно вводят факторы роста, получают выгоду от ангиогенеза или развития новых кровеносных сосудов вокруг места инъекции. Кроме того, лизин способствует метаболизму жиров. Дефицит лизина может привести к анемии, нарушению метаболизма жирных кислот, медленному заживлению ран, снижению мышечной массы и образованию дефектных соединительных тканей; однако высокие уровни могут вызвать неврологические нарушения.
Метионин содержит элемент серу, который необходим для здоровья хрящей и печени, а также улучшает структуру волос и прочность ногтей. Редкие метаболические нарушения могут помешать организму использовать метионин, что в долгосрочной перспективе может привести к серьезному повреждению печени из-за окислительного повреждения.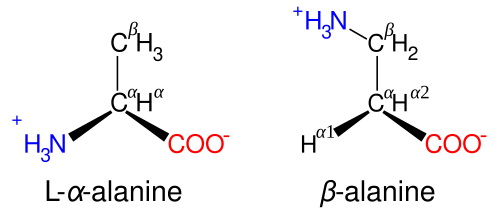
Фенилаланин является предшественником тирозингидроксилазы, фермента, который ускоряет синтез катехоламинов и тем самым влияет на настроение. Фенилаланин также необходим для передачи сигналов о доступности глюкозы и секреции глюкагона и инсулина.Он играет еще одну роль в окислении жиров. Недостаток фенилаланина вызывает спутанность сознания, недостаток энергии, потерю памяти и депрессию. Дозы свыше 5000 мг в день токсичны. и может вызвать повреждение нервов.
Доступность треонина увеличивает поглощение других аминокислот, таких как фенилаланин, но также способствует балансу нейромедиаторов в головном мозге, производству мышечной ткани и функции иммунной системы. Было обнаружено, что у младенцев, которых кормили матери, принимавшие треониновые добавки, был более высокий уровень глицина в мозге с последующим риском дисфункции нейротрансмиттеров.Как и в случае со многими аминокислотами, правильные уровни добавок еще не являются фиксированной единицей , и необходимо провести еще много исследований.
Триптофан является молекулой-предшественником ниацина (витамин B 3 ), мелатонина и серотонина и, следовательно, необходим для сна и настроения. Как и все аминокислоты, кодон триптофана является строительным блоком для полипептидных цепей и белков. Недостаток триптофана часто проявляется как бессонница и депрессивное настроение.
Триптофан влияет на качество снаПреимущества незаменимых аминокислот
Преимущества незаменимых аминокислот, вырабатываемых организмом (de novo), столь же широки, как и у незаменимых аминокислот.Хотя эти аминокислоты производятся с нуля, пищевые источники могут повысить доступность и, таким образом, обеспечить более надежный и устойчивый эффект .
Молекулы аланина и глутамина синтезируются в скелетных мышцах с использованием источников пирувата и высвобождаются для увеличения запасов энергии. Оба они важны для здоровья нервной системы, а аланин необходим для синтеза триптофана. Более высокие уровни аланина защищают сердечно-сосудистую систему, а низкие уровни глутамина увеличивают смертность у критических пациентов и способствуют значительной потере мышечной массы.Также известно, что глутамин является важным источником энергии для опухолевых клеток , уступая только глюкозе.
Аргинин относится к категории условно незаменимых аминокислот для новорожденных и незаменимых аминокислот для остальной части человеческого населения. Аргинин является одним из наиболее распространенных ингредиентов полипептидов и белков и помогает обеспечить здоровую иммунную систему за счет увеличения производства Т-клеток. Он помогает высвобождать инсулин и гормоны роста человека, нейтрализовать аммиак в печени, улучшать качество кожи и соединительной ткани и заживление.Он также содержится в семенной жидкости.
Аспарагин играет важную роль в синтезе гликопротеинов и здоровье печени. Низкий уровень снижает чувство усталости и означает, что эту аминокислоту часто называют возбуждающей. Однако его вклад в передачу сигналов центральной нервной системы и ее развитие так же важен, как и его способность повышать уровень энергии.
Аспарагиновая кислота работает в циклах лимонной кислоты и мочевины и является предшественником других аминокислот. Более того, это также возбуждающий нейромедиатор ствола и спинного мозга, который увеличивает шанс успешной деполяризации постсинаптической мембраны.Его ингибирующим партнером является аминокислота глицин. Обе эти незаменимые аминокислоты должны быть сбалансированы, чтобы приносить пользу центральной нервной системе. . Глицин — простейшая аминокислота, и его успокаивающее действие улучшает сон и снижает поведение, требующее вознаграждения. Он может быть синтезирован путем разложения коллагена и является основным ингредиентом коллагена.
Цистеин, вторая и последняя серосодержащая аминокислота, которая добавляет тиольную группу (-SH) к карбоксильной и аминогруппам.Цистеин синтезируется из метионина, другой серосодержащей, но незаменимой аминокислоты, путем трансметилирования с образованием гомоцистеина, а затем путем трансульфурации с образованием цистеина. Цистеин используется для синтеза белка, синтеза кофермента А, а также для производства глутатиона (антиоксидант) и сероводорода. Это предшественник пирувата и таурина.
Глутаминовая кислота наиболее известна своей ролью предшественника гамма-аминомасляной кислоты (ГАМК), где проявляется ингибирующее действие, хотя сама глутаминовая кислота действует как возбуждающий нейротрансмиттер во всей центральной нервной системе.Это чрезвычайно распространенная пищевая аминокислота, которая также может снижать уровень артериального давления. Глутамат иногда добавляют как двенадцатую заменимую аминокислоту, но он является производным глутаминовой кислоты.
Пролин может быть синтезирован из глутамина или получен в результате распада коллагена и является источником энергии, когда организм находится в состоянии стресса. Производство пролина может успешно происходить только в присутствии фермента пролилгидроксилазы и про-факторов кислорода, железа и витамина С. Пролин также имеет решающее значение для синтеза коллагена.Фактически, коллаген требует присутствия восемнадцати различных аминокислот в различных количествах.
Серин необходим для переноса метильных групп в организме и, следовательно, необходим для производства таких веществ, как креатин, адреналин, ДНК и РНК. Это также было связано с ростом клеток рака груди. В другой форме — D-серин — он играет нейромодулирующую роль. Кроме того, без серина было бы невозможно образовать глицин, цистеин, таурин и фосфолипиды.
Тирозин широко рекламировался как когнитивная добавка, поскольку он является предшественником катехоламинов дофамина и норадреналина, а также тироксина и меланина. Однако его влияние на население в целом не было доказано, и результаты, как правило, наблюдаются у одних, а у других — нет. Следовательно, действие тирозина должно быть в зависимости от наличия или отсутствия других химических веществ . Как и каждая аминокислота, тирозин также является важным строительным блоком в синтезе полипептидов и белка.
Аминокислотная структура
Аминокислотная структура — одна из самых простых структур для распознавания, поскольку каждая органическая молекула имеет щелочную (или основную) функциональную аминогруппу (―Nh3), кислотную функциональную карбоксильную группу (COOH) и органическую боковая цепь (R-цепь), уникальная для каждой аминокислоты. Фактически, название этой группы — это инкапсуляция основных ингредиентов — альфа-амино [α-амино] и карбоновой кислоты.
Все аминокислоты содержат один центральный атом углерода .Амино- и карбоксильные функциональные группы присоединены к этому центральному атому углерода, часто называемому -углеродом. Это оставляет две из четырех углеродных связей свободными. Один будет присоединяться к одному из многочисленных атомов водорода, находящихся поблизости, другой — к органической боковой цепи или R-группе. Группы R обладают различными формами, размерами, зарядами и реакциями, которые позволяют группировать аминокислоты в соответствии с химическими свойствами, создаваемыми их боковыми цепями. Эти боковые цепи можно четко изучить на изображении ниже.
Таблица аминокислотАлифатические аминокислоты
Алифатические аминокислоты неполярны и гидрофобны. По мере увеличения количества атомов углерода в боковой цепи гидрофобность увеличивается. Алифатические аминокислоты представляют собой аланин, глицин, изолейцин, лейцин, пролин и валин; хотя в глицине так мало атомов углерода, он не является ни гидрофильным, ни гидрофобным. Метионин иногда называют почетным членом алифатической группы. Его боковая цепь содержит атом серы вместо атомов углерода и водорода, но, как и алифатическая группа, не реагирует сильно в присутствии других молекул, поскольку алифатические аминокислоты не имеют положительного или отрицательного заряда, но имеют одинаковое распределение заряда по всей молекуле.
Ароматические аминокислоты
Ароматические аминокислоты включают фенилаланин, тирозин и триптофан, и у них практически нет заряда. Эти молекулы различаются между гидрофобными (фенилаланин и триптофан) и негидрофобными (тирозин).
Структура фенилаланинаСлово ароматический относится к присоединению высокостабильного ароматического кольца , которое не реагирует легко с другими соединениями или элементами . Ароматические соединения, также известные как арильные соединения, изобилуют в организме человека.Каждый нуклеотид в нашей ДНК и РНК состоит из ароматических молекул.
Гистидин иногда неправильно указывается в ароматической группе. Его аминогруппы могут быть ароматическими, но они обладают слабым положительным зарядом и гидрофильными характеристиками.
Основные аминокислоты
Хотя их название указывает на то, что все аминокислоты обладают кислотными свойствами, некоторые из них имеют основные (щелочные) боковые цепи, содержащие азот. Эти основные цепи R связываются с доступными протонами (молекулами водорода) и, таким образом, приобретают положительный заряд.Все аминокислоты этой группы гидрофильные.
Три основных аминокислоты — это аргинин, лизин и гистидин. Аргинин имеет самый сильный положительный заряд из всех аминокислот из-за трех групп азота, которые необходимы для его способности синтезировать белки и катализировать функцию ферментов. Лизин также имеет сильный положительный заряд, в то время как гистидин имеет очень слабый положительный заряд из-за отсутствия азота в аминогруппе.
Кислотные аминокислоты
Кислотные аминокислоты состоят из аспарагиновой кислоты и глутаминовой кислоты.Естественно, их легко идентифицировать благодаря слову «кислота» в названии соединения, хотя иногда эти две аминокислоты называют аспартатом и глутаматом, что может сбивать с толку. Вместо азотных групп кислотные аминокислоты имеют группы карбоновых кислот в качестве боковых цепей. Как кислоты, они способны терять протоны в реакциях с другими соединениями или элементами и, таким образом, становиться отрицательно заряженными. Кислотные аминокислоты являются гидрофильными
Гидроксильные аминокислоты
Другая небольшая группа, состоящая только из двух аминокислот, — это гидроксильные аминокислоты, представленные серином и треонином.Эти незаряженные полярные и гидрофильные молекулы имеют гидроксильную группу в виде R-цепи.
Серосодержащие аминокислоты
Только цистеин и метионин содержат атомы серы и, следовательно, являются единственными членами этой группы. Цистеин может связываться с цистеином посредством дисульфидного мостика с образованием окисленного димера, называемого цистеином, который в больших количествах содержится в соединительной ткани, волосах и ногтях пальцев рук и ног.
В серосодержащих аминокислотах боковая цепь состоит из тиоловой группы (-SH). Когда вы замечаете букву S в химической структуре аминокислоты, можете быть уверены, что это либо цистеин, либо метионин . Цистеин является меньшей из двух молекул и по существу представляет собой молекулу аланина с дополнительной тиоловой группой. Метионин содержит простой тиоловый эфир с двумя боковыми группами по обе стороны от атома серы, что делает его чрезвычайно гидрофобным.
Структура метионинаАмидные аминокислоты
Боковая цепь амидных аминокислот имеет амидную группу (-CONH 2 ), и не следует путать с боковой аминогруппой аминокислот лизина, аргинина и гистидина.
Амид, образованный из глутаминовой кислоты, называется глутамином, а амид, образованный из аспарагиновой кислоты, называется аспарагином. Поэтому легко понять, почему амидные аминокислоты могут выполнять свою работу только в присутствии достаточного количества глутаминовой кислоты и аспарагиновой кислоты.
Аспарагин — очень гидрофильный незаряженный амид аспарагиновой кислоты, который не вступает в реакцию с другими молекулами. Глютамин также не имеет заряда, является гидрофильным и представляет собой амид глутаминовой кислоты.
Белок и аминокислоты
Белок и аминокислоты по сути являются зависимыми отношениями. Аминокислоты — это мономеры, молекулы, которые связываются с другими молекулами с образованием полимеров. В случае аминокислот они связываются с образованием олигопептидов не более чем из двадцати аминокислот или более длинных полипептидных цепей, которые затем могут складываться с образованием белков. Аминокислотные последовательности основаны на оригинальном участке генетического кода, взятом из ДНК.
Синтез белка происходит внутри клетки, где участки генетического кода копируются внутри ядра клетки и транспортируются через информационную РНК в цитоплазму клетки.Информационная РНК (мРНК) копируется после того, как она закреплена между большой и малой частями рибосомы. Это возможно благодаря действию транспортной РНК.
Трансферная РНК (тРНК) присоединена к аминокислоте. Нить мРНК содержит от десятков до сотен кодонов, каждый из которых содержит группу из трех нуклеотидов, составляющих код одной аминокислоты. Когда передающая РНК распознает кодон, она откладывает присоединенную к ней аминокислоту внутри рибосомы, где она связывается с предыдущей аминокислотой, образуя цепь.
Последовательности аминокислотных кодоновВ приведенной выше таблице каждая из незаменимых аминокислот кодируется рядом кодонов. Например, код, который сообщает тРНК принести серин, имеет шесть различных форм — UCU, UCC, UCA, UCG, AGU и AGC.
Различные тРНК по очереди доставляют свои аминокислоты в соответствии с каждым кодоном, присутствующим в цепи матричной РНК. Результатом является растущая олигопептидная или полипептидная цепь, построенная в соответствии с определенной аминокислотной последовательностью, которая соответствует инструкциям кода, скопированного из ядерной ДНК .После завершения цепь высвобождается из рибосомы и превращается в функциональный пептид или белок, в зависимости от его длины и формы.
Белковые структуры могут быть первичными, вторичными, третичными или четвертичными в зависимости от уровня происходящего сворачивания. Первичная структура просто состоит из пептидных связей, образующихся между двумя частями рибосомы. Вторичная структура относится к водородным связям, которые образуют участки спиралей, которые конденсируют исходную структуру цепи. Третичная структура добавляет солевые мостики, дополнительные водородные связи и дисульфидные связи для создания еще более конденсированной упаковки.Наконец, четвертичная структура включает две или более полипептидных цепей, которые будут работать как единое звено или мультимер. Эти четыре структуры просто представлены на изображении ниже.
4 структуры белкаАминокислоты Функция
Аминокислоты действуют множеством способов. Последние годы показали, что аминокислоты являются не только строительными блоками и клеточными сигнальными молекулами, но также регуляторами каскада экспрессии генов и фосфорилирования белков. Мы также знаем, что они являются предшественниками гормонов и азотистых веществ и имеют беспрецедентное биологическое значение.Кроме того, некоторые аминокислоты регулируют ключевые метаболические пути, необходимые для поддержания, роста, воспроизводства и иммунитета. Даже в этом случае повышенный уровень аминокислот и результаты их синтеза в форме аммиака и гомоцистеина могут вызывать неврологические расстройства, окислительный стресс и сердечно-сосудистые заболевания.
Мы все еще находимся в зачаточном состоянии исследований аминокислот, и их полный набор функций все еще в значительной степени неизвестен, как и способность аминокислот работать как группа или в рамках целостной системы.Оптимальный аминокислотный баланс в рационе имеет решающее значение, но в целом он недостаточно изучен, и поэтому невозможно опубликовать твердые рекомендации. Пищевые добавки, содержащие функциональные аминокислоты аргинин, цистеин, глутамин, лейцин, пролин и триптофан, показали свою полезность при ряде заболеваний, связанных со здоровьем, на всех этапах жизни, от плода до гериатрии, дисфункции кишечника, ожирения, диабета, сердечно-сосудистых заболеваний. , нарушения обмена веществ и бесплодие. Более того, аминокислоты потребляются любителями спорта и спортсменами для увеличения мышечной массы и уменьшения накопления жира; однако сообщалось о когнитивных побочных эффектах и повреждении почек в связи с добавлением аминокислот.
Примеры аминокислот
Примеры аминокислот можно найти в этой статье. Возможно, будет интереснее взглянуть на одну из самых популярных аминокислотных добавок на рынке и обсудить ее положительные и отрицательные эффекты.
Одна из самых популярных аминокислотных добавок — это смесь аминокислот с разветвленной цепью (BCAA), а именно лейцин, изолейцин и валин. Говорят, что BCAA стимулируют синтез мышечного белка более чем на 30%. Это просто невозможно .Первая причина этого в том, что для высвобождения незаменимых аминокислот необходима определенная степень разрушения мышц; скорость производства новой мышечной ткани зависит от скорости деградации старых мышечных клеток. Во-вторых, более высокие диетические источники ограниченной группы аминокислот не будут работать на высоком уровне, когда уровни других аминокислот остаются нормальными или низкими. Поскольку исследования еще предстоит пройти долгий путь, любые советы по питанию, касающиеся потребления аминокислот, следует принимать за чистую монету .Аминокислоты с разветвленной цепью действительно связаны с синтезом мышечной ткани, но каждая аминокислота, как незаменимая, так и несущественная, каким-то образом связана с одной и той же функцией. Хотя мышечный белок находится в состоянии постоянного обмена, значения и соотношения доступных аминокислот не всегда могут быть оптимальными. Более того, все аминокислоты конкурируют за одни и те же молекулы-носители. BCAA используют ту же систему-носитель, которая транспортирует ароматические аминокислоты фенилаланин, тирозин и триптофан. Таким образом, производительность добавки также ограничивается доступностью транспорта; насыщение добавками может помешать другим важным аминокислотам, присутствующим в нормальном количестве, достичь своей цели.Высокий уровень BCAA конкурирует с молекулами-носителями за ароматические аминокислоты, которые важны для синтеза нейромедиаторов. Результат может повлиять на настроение.
BCAA — популярная добавка для наращивания мышцСчитается, что BCAA играют важную роль во внутриклеточных сигнальных путях, участвующих в синтезе белка. Это было доказано множеством способов, но основное внимание уделяется небольшому окну. Что известно, так это то, что добавки BCAA облегчают симптомы, связанные с циррозом печени и хронической почечной недостаточностью.Другие утверждения еще не получили удовлетворительного подтверждения.
Следует также учитывать тот факт, что диабетики и страдающие ожирением имеют естественно высокие уровни BCAA и низкие уровни аланина. Спортсменам может быть интересно услышать о повышенном уровне аммиака в крови после приема BCAA во время тренировки, что позволяет предположить, что добавки могут в конечном итоге оказать негативное влияние на работу мышц. Другой тревожный эффект был обнаружен у онкологических больных, у которых BCAA способствуют росту рака и используются опухолями в качестве источника энергии.
Викторина
Молекула аланина
Изображение выше: CPK (модель с заполнением пространства) молекулы аланина
Аланин (сокращенно Ala или A; кодируется кодонами GCU, GCC, GCA и GCG) представляет собой α-аминокислоту, которая используется в биосинтезе белков. Он содержит α-аминогруппу (которая находится в протонированной форме -Nh4 + в биологических условиях), группу α-карбоновой кислоты (которая находится в депротонированной форме -COO- в биологических условиях) и метильную группу боковой цепи, классифицирующую это как неполярная (при физиологическом pH) алифатическая аминокислота.Для человека он несущественен, то есть организм может его синтезировать.
Для Трехмерная структура молекулы аланина с использованием Jsmol Click здесь
Символ: Ala A
Молекулярный вес: 89,09
Изоэлектрическая точка (pH) 6,0
Молекулярная формула: C 3 H 7 NO 2
Аланин — одна из 20 наиболее распространенных природных аминокислот. кислоты.Он гидрофобен, с боковой цепью метильной группы, и является вторым по величине из 20 после глицина.
α-атом углерода молекулы аланина связан с метильной группой (-Ch4), что делает его одной из простейших α-аминокислот, а также приводит к классификации аланина как алифатической аминокислоты. Метильная группа аланина нереактивна и поэтому почти никогда не участвует напрямую в функции белка.
Аланин представляет собой молекулу аминокислоты, которая не может быть фосфорилирована, что делает ее весьма полезной в эксперименте по потере функции в отношении фосфорилирования.
Аланин — незаменимая аминокислота,
участвует в метаболизме триптофана и
витамин пиридоксин. Это один из самых распространенных
использовали аминокислоты в построении белка, усредняя
около 9 процентов от среднего белкового состава.
Аланин содержится в жидкости предстательной железы и может играть
важная роль в здоровье простаты. Источники
аланин — это мясо, птица, яйца, молочные продукты,
и рыба.
Роль L-аланина в окислительно-восстановительном самодостаточном аминировании спиртов | Фабрики микробных клеток
Конструирование цельноклеточного биокатализатора W3110 / pTrc99A-
ald — adh — ta Cv и его сравнение с W3110 / pTrc99A- ald — adh — ta Vf in vitro и in vivoЦельноклеточный биокатализатор W3110 / pTrc99A- ald — adh — ta Vf , как ранее было показано, делает возможным окислительно-восстановительное самодостаточное аминирование различных спиртов [6] и включает термочувствительную трансаминазу из Vibrio fluvialis .Из-за термостабильной алкогольдегидрогеназы B. stearothermophilus считалось, что повышенная температура реакции для окислительно-восстановительного самодостаточного аминирования улучшает скорость получения. Следовательно, ген трансаминазы V. fluvialis был заменен геном трансаминазы C. violaceum в IPTG-индуцибельном векторе pTrc99A- ald — adh — ta Vf . Вектор использовали для трансформации E.coli W3110 с получением цельноклеточного биокатализатора W3110 / pTrc99A- ald — adh — ta CV . Анализы ферментной активности недавно сконструированного цельноклеточного биокатализатора показали, что все три гена функционально экспрессируются. Неочищенные экстракты показали активность ферментов 9,8 ± 1,1 и 0,55 ± 0,03 Ед / мг для аланиндегидрогеназы и алкогольдегидрогеназы, соответственно, что было аналогично активности в W3110 / pTrc99a- ald — adh — ta Vf [6].Однако с (S) — (-) α-метилбензиламином в качестве субстрата удельная активность трансаминазы Ta Cv составляет 0,62 ± 0,01 в W3110 / pTrc99a- ald — adh — ta Cv были в два раза выше, чем у Ta Vf в W3110 / pTrc99a- ald — adh — ta Vf .
Каталитическая эффективность обеих трансаминаз оценивалась с L-аланином в качестве донорного субстрата и гексаналем в качестве акцепторного субстрата.Следовательно, неочищенные экстракты W3110 / pTrc99a- ta Vf и W3110 / pTrc99a- ta Cv анализировали в 50 мМ калий-фосфатном буфере, pH 7,4, с постоянной концентрацией гексаналя и различными концентрациями L-аланина при 37 ° C. L-аланин-зависимое трансаминирование гексаналя в гексиламин может быть обнаружено как для трансаминаз, так и для K m — и V max -значения для Ta Vf составляли 20 мМ L-аланина и 0,3 Ед / мг, соответственно, и 35 мМ L-аланина и 2 Ед / мг соответственно для Ta Cv (таблица 1).Каталитическая эффективность, отраженная значением V max / K m , была в 3 раза выше для Ta Cv , чем для Ta Vf (0,06 по сравнению с 0,02 U мг -1 мМ -1 ) .
Таблица 1 In vitro оценка каталитической эффективности трансаминаз Ta Vf и Ta CV с L-аланином и гексаном в качестве субстратовДля сравнения цельноклеточных биокатализаторов W3110 / pTrc99A- ald — adh — ta Cv и W3110 / pTrc99A- ald — adh — ta Vf для окислительно-восстановительного самодостаточного аминирования спиртов было испытано превращение диола в 1,10-декандиол.Добавление 1,10-декандиола, 100 мМ L-аланина и 100 мМ NH 4 Cl привело к образованию 100% продукта с использованием недавно полученного катализатора W3110 / pTrc99a- ald — adh — ta Cv (Таблица 2), а также с использованием ранее разработанного W3110 / pTrc99a- ald — adh — ta Vf [6]. Когда концентрация L-аланина была снижена до 50 мМ или 20 мМ, производство 1,10-диаминодекана с использованием W3110 / pTrc99a- ald — adh — ta Cv и W3110 / pTrc99a- ald — adh — ta Vf был снижен до 84% и 86% соответственно и 73% и 50% соответственно (Таблица 2).Анализ ВЭЖХ показал, что оба штамма потребляли от 16 до 30 мМ L-аланина (таблица 2). В совокупности новый биокатализатор W3110 / pTrc99a- ald — adh — ta Cv показал более высокую активность и каталитическую эффективность по отношению к трансаминазе и более высокую селективность при 37 ° C и низких концентрациях L-аланина.
Таблица 2 Сравнение окислительно-восстановительного самодостаточного аминирования 1,10-декандиола с помощью W3110 / pTrc99a- ald-adh-ta Vf и W3110 / pTrc99a- ald-adh-ta CV с различными концентрациями L-аланинаВлияние температуры реакции на аминирование 1,10-декандиола до 1,10-диаминодекана с помощью W3110 / pTrc99a-
ald — adh — ta Vf и W3110 / pTrc99a- ald — adh — ta CvТрехферментный каскад содержит термостабильную алкогольдегидрогеназу из термофильного B.stearothermophilus , но мало что известно об активности аланиндегидрогеназы из B. subtilis и двух трансаминаз V. fluvialis и C. violaceum при более высоких температурах. Активность всех ферментов анализировали при различных температурах в сырых экстрактах W3110 / pTrc99a- adh , W3110 / pTrc99A- ald , W3110 / pTrc99a- ta . Vf , а также W3110 / pTrc99a- ta CV .Для аланиндегидрогеназы B. subtilis и алкогольдегидрогеназы B. stearothermophilus активность ферментов увеличивалась в диапазоне температур от 30 ° C до 60 ° C и 20 U / мг и 1,8 U / мг, соответственно, с максимальными значениями. примерно при 60 ° C (Рисунок 2). Активность трансаминазы V. fluvialis (Ta Vf ) в неочищенном экстракте W3110 / pTrc99a- ta Vf упал с 0,5 Ед / мг до 0,03 Ед / мг, когда температура реакции увеличилась с 37 ° C до 42 ° C.Активность трансаминазы C. violaceum (Ta Cv ) также была ниже при 42 ° C (0,13 Ед / мг), чем при 37 ° C (0,66 Ед / мг), но ее активность при 42 ° C составляла четыре в несколько раз выше, чем у Ta Vf при 42 ° C (Рисунок 2).
Рисунок 2Ферментативная активность аланиндегидрогеназы, алкогольдегидрогеназы (А) и трансаминаз Vibrio fluvialis и Chromobacterium violaceum (B) измерено в неочищенном экстракте W3110 / pTrc99a- ald , W3110 / pTrc99a- adh , W3110 / pTrc99a- ta Vf и W3110 / pTrc99a- ta CV соответственно при разных температурах реакции.
Для анализа влияния температуры реакции на каскад аминирования, биотрансформации целых клеток с W3110 / pTrc99a- ald — adh — ta Vf и W3110 / pTrc99a- ald — adh — ta Cv выполняли при 37 ° C, 40 ° C и 42 ° C, что является подходящей температурой для хозяина E. coli . 1,10-декандиол был выбран в качестве субстрата, поскольку он был одним из лучших субстратов этого каскада [5,7], и, кроме того, использование этого диалкоголя позволяет контролировать 1-амино-10-деканол, промежуточный продукт образования диамина. .Выработку диамина обоими штаммами сравнивали в буферной системе покоя с использованием 1,10-декандиола в качестве субстрата, 100 мМ L-аланина и 100 мМ NH 4 Cl. In vivo аминирование 1,10-декандиола, выполненное двумя цельноклеточными биокатализаторами, достигло 100 молярной селективности через 24 часа при 37 ° C и производительности около 0,06 г / г * ч (0,35 ммоль / г * ч) были рассчитаны (рисунок 3). Кроме того, повышение температуры реакции с 37 ° C до 40 ° C и 42 ° C повысило производительность до 0.15 г / г * ч (0,87 ммоль / г * ч) и 0,2 г / г * ч (1,16 ммоль / г * ч), соответственно, когда недавно построенный W3110 / pTrc99a- ald — adh — ta Cv . Напротив, с W3110 / pTrc99a- ald — adh — ta Преобразование субстрата Vf в 1,10-диаминодекан (74% и 56% соответственно) и производительность (0,04 г / г * ч и 0,03 г / г * ч, соответственно) были ниже при 40 ° C и 42 ° C. соответственно по сравнению с 37 ° C (рис. 3).Таким образом, при выбранных условиях W3110 / pTrc99a- ald — adh — ta Cv превосходил W3110 / pTrc99a- ald — adh — ta Vf при повышенной температуре.
Рисунок 3Сравнение скорости производства и образования продукта для окислительно-восстановительного самодостаточного аминирования 1,10-декандиола при 37 ° С , 40 ° С и 42 ° С с использованием цельноклеточных биокатализаторов W3110 / pTrc99a- ald – adh – ta Vf и W3110 / pTrc99a- ald – adh – ta CV . Клетки отбирали для биотрансформации целых клеток после 15 часов экспрессии гена в LB + 20 мМ Mops при 37 ° C. В системе покоя, состоящей из 50 мМ Hepes pH7, 10 мМ 1,10-декандиола, 100 мМ L-аланина и 100 мМ NH 4 Cl, оптическая плотность при 600 нм была доведена до 10.
Роль L-аланина в окислительно-восстановительном самодостаточном аминировании спиртов во всем клеточном процессе
L-аланин был компонентом ранее описанного окислительно-восстановительного самодостаточного аминирования спиртов каскадными ферментами или как биотрансформация всей клетки [5 , 6], а также в экспериментах, описанных выше, чтобы служить донором аминогруппы при L-аланин-зависимом трансаминировании.Однако концептуально самодостаточное окислительно-восстановительное аминирование спиртов не требует добавления L-аланина, но может происходить только из аммония (рис. 1А). Таким образом, чтобы выяснить, необходимо ли внешнее добавление L-аланина для управления аминированием 1,10-декандиола через этот каскад, различные концентрации L-аланина были проанализированы с использованием биокатализатора W3110 / pTrc99a- ald — adh — ta Cv при 42 ° C с постоянной концентрацией 100 мМ NH 4 Cl.При пониженных концентрациях L-аланина 50 мМ и 20 мМ полное превращение 1,10-декандиола в 1,10-диаминодекан наблюдалось через 6 часов. При 10 мМ и 5 мМ селективность L-аланина была почти полной (94% и 93% соответственно), тогда как без добавления L-аланина наблюдалась лишь 5,6% конверсия 1,10-декандиола в 1,10-диаминодекан (Таблица 3 ). Таким образом, L-аланин должен присутствовать для эффективного аминирования спиртов с использованием биокатализатора W3110 / pTrc99a- ald — adh — ta CV .
Таблица 3 Биотрансформация целых клеток с W3110 / pTrc99a- ald – adh – ta CV при 42 ° C с 100 мМ NH 4 Cl и различные концентрации L-аланина ДобавленныйL-аланин был использован полностью (при 5 и 10 мМ) или частично (при 20 и 50 мМ) во время подхода биотрансформации всей клетки.При определенных условиях ацетат накапливается как побочный продукт. Когда L-аланин присутствовал в тех же или более низких концентрациях, что и субстрат 1,10-декандиол, накопления ацетата не наблюдалось, однако при более высоком избытке L-аланина можно было наблюдать увеличение концентрации ацетата (Таблица 3). L-аланин (20 мМ) полностью катаболизируется в отсутствие субстрата 1,10-декандиола. Пируват только частично заменял L-аланин, поскольку при 20 мМ пирувата было обнаружено образование только 70% продукта. Взятые вместе, эти результаты указывают на потребление L-аланина и образование ацетата центральным углеродным метаболизмом хозяина.
Чтобы проверить, важно ли потребление L-аланина для окислительно-восстановительного самодостаточного аминирования спиртов с помощью этого цельноклеточного биокатализатора или в качестве необязательной побочной реакции, катаболизм пирувата хозяина был заблокирован в различных положениях. E. coli YYC202 не может катаболизировать пируват (рис. 1), поскольку в нем отсутствует комплекс пируватдегидрогеназы (делеция aceEF ), фосфоенилпируватсинтетаза (мутация pps ), пируватформиатлиаза (1 pflB) pflB ( poxB ) [7].Гетерологичная сверхэкспрессия ald , adh и ta Cv в E. coli YYC202 привел к 42% -ному превращению 1,10-декандиола в 1,10-диаминодекан по сравнению с селективностью 100 мол.%, Полученной с эталонным штаммом MG1655 / pTrc99a- ald — adh — ta Cv (рисунок 4). Поскольку в E. coli YYC202 имеется несколько метаболических блоков, были проанализированы дополнительные штаммы, чтобы определить, какие из реакций блокируются в E.coli YYC202 является наиболее важным для катаболизма пирувата. Обычно считается, что пируватдегидрогеназный комплекс (PDHC) важен в аэробных условиях, а пируватформиатлиаза (PFL) — в аноксических условиях, в то время как PoxB может быть важен во время перехода между экспоненциальной и стационарной фазами, поскольку в микроаэробных условиях как PDHC, так и PFL функционируют плохо [ 8]. PoxB также способствует аэробному росту, особенно при низкой скорости роста [9]. Известно, что ген пируватоксидазы poxB индуцируется в стационарной фазе роста, и эта индукция зависит от альтернативного сигма-фактора RpoS [10].Таким образом, PoxB может быть актуален в условиях биотрансформации целых клеток, которые характеризуются медленным ростом и ограничением кислорода. Следовательно, poxB был удален в E. coli W3110 (см. Материалы и метод), и полученный мутант был трансформирован с помощью pTrc99a- ald — adh — ta CV . Цельноклеточный биокатализатор, в котором отсутствуют только poxB, W3110Δ poxB / pTrc99a- ald — adh — ta Cv , показал примерно двукратное снижение аминирования 1-10-декандиола до 1,10-диаминодекана (фиг. 4), что указывает на то, что PoxB является наиболее важным ферментом для катаболизма пирувата при выбранных условиях биотрансформации.Более того, поскольку было обнаружено, что различия штамма E. coli влияют на биотрансформацию [11], что может иметь значение даже между близкородственными штаммами W3110 и MG1655, используемыми здесь [12], влияние отсутствия PoxB также было проанализировано в другой штаммовый фон, а именно BW25113. Действительно, E. coli BW25113 / pTrc99a- ald — adh — ta Cv преобразовал примерно в три раза больше (56%) 1,10-декандиола в 1,10-диаминодекан, чем его мутант poxB (16%; фиг. 4).Вместе взятые, добавление L-аланина и его катаболизм через пируват и пируватоксидазу PoxB важны для эффективной аминофункционализации спиртов с помощью описанных биокатализаторов цельной клетки.
Рисунок 4Роль пируватоксидазы PoxB в превращении 1,10-декандиола в 1,10-диаминодекан в окислительно-восстановительном самодостаточном аминировании целых клеток. Аминирование 1,10-декандиола проводили в буферной системе покоя с 20 мМ L-аланином, 100 мМ NH 4 Cl и 10 мМ 1,10-декандиолом при 42 ° C.В штамме YYC202 отсутствует poxB (и другие) по сравнению с его изогенным родителем MG1655, в штамме W3110Δ poxB отсутствует poxB по сравнению с его изогенным родителем W3110 и BW25113Δ poxB не хватает poxB 25113 по сравнению с его изогенным родителем poxB . Все штаммы содержали pTrc99a- ald — adh — ta CV .
Глюкозо-аланинский цикл: определение, этапы и реакции
Глюкозо-аланиновый цикл , или цикл Кэхилла, впервые предложенный Маллеттом, Экстоном и Парком и Фелигом и др.между 1969 и 1970 годами состоит из ряда этапов, через которые внепеченочные ткани, например скелетные мышцы, экспортируют пируват и аминогруппы в виде аланина в печень и получают глюкозу из печени через кровоток.
Основные этапы глюкозно-аланинового цикла приведены ниже.
- Когда во внепеченочных тканях аминокислоты используются для получения энергии, пируват, полученный в результате гликолиза, используется в качестве акцептора аминогруппы, образуя аланин , заменяющую аминокислоту.
- Аланин проникает в кровоток и достигает печени.
- В печени аминогруппа аланина передается α-кетоглутарату с образованием пирувата и глутамата соответственно.
- Аминогруппа глутамата в основном входит в цикл мочевины и частично действует как донор азота во многих биосинтетических путях.
Пируват вступает в глюконеогенез и используется для синтеза глюкозы. - Вновь образованная глюкоза диффундирует в кровоток и достигает периферических тканей, где в результате гликолиза превращается в пируват, который может принимать аминогруппы из свободных аминокислот, замыкая цикл.
Следовательно, цикл глюкоза-аланин обеспечивает связь между углеводом и метаболизмом аминокислоты , как схематически описано ниже.
Глюкоза → Пируват → Аланин → Пируват → Глюкоза
Цикл глюкоза-аланинЦикл глюкоза-аланин происходит не только между скелетными мышцами, первой тканью, в которой он был обнаружен, и печенью, но включает другие клетки и внепеченочные ткани, включая клетки иммунной системы, такие как лимфоидные органы.
СОДЕРЖАНИЕ
Этапы глюкозо-аланинового цикла
Анализ этапов глюкозо-аланинового цикла проводится с учетом цикла между скелетными мышцами и печенью .
Как внутриклеточные, так и внеклеточные белки непрерывно гидролизуются до составляющих аминокислот и повторно синтезируются, и скорость, с которой эти процессы происходят, точно сбалансирована, тем самым предотвращая потерю массы без жира.
Однако в катаболических условиях, таких как интенсивные и продолжительные упражнения или голодание, скорость распада мышечного белка превышает синтез.Это приводит к высвобождению аминокислот, некоторые из которых используются для получения энергии, а другие — для глюконеогенеза. А окисление углеродных скелетов аминокислот, в частности аминокислот с разветвленной цепью или BCAA (лейцин, изолейцин и валин), может быть значительным источником энергии для мышц. Например, после примерно 90 минут напряженных упражнений окисление аминокислот в мышцах обеспечивает 10-15% энергии, необходимой для сокращения.
Использование углеродных скелетов аминокислот для получения энергии включает удаление аминогруппы , а затем выведение аминного азота в нетоксичной форме.
Удаление α-аминогруппы происходит путем переаминирования , что можно резюмировать следующим образом:
α-Кетокислота + Аминокислота ⇄ Новая аминокислота + Новая α-кетокислота
Такие реакции, катализируемые ферментами, называемыми аминотрансферазами или трансаминазами (EC 2.6.1), легко обратимы.
Аминокислоты с разветвленной цепью, например, переносят аминогруппу на α-кетоглутарат или 2-оксоглутаровую кислоту с образованием глутамата и α-кетокислоты, полученной из исходной аминокислоты, в реакции, катализируемой аминотрансферазой с разветвленной цепью или BCAT ( EC 2.6 .1.42).
Цикл Кэхилла в скелетных мышцах
В скелетных мышцах новообразованный глутамат может реагировать с аммиаком с образованием глутамина для многих тканей и органов, таких как мозг, основного транспортного средства для межорганного транспорта азота. Реакция катализируется цитозольным ферментом глутамин синтетазой (EC 6.3.1.2) и потребляет АТФ.
Глутамат + NH 4 + + АТФ → Глутамин + АДФ + P i
В этом случае глутамат выходит из цикла Кэхилла.
В качестве альтернативы, и в отличие от того, что происходит в большинстве других тканей, вновь образованный глутамат может передавать аминогруппу пирувату, полученному в результате гликолиза, с образованием аланина и α-кетоглутарата. Это трансаминирование катализируется аланинаминотрансферазой или ALT (EC 2.6.1.2), ферментом, обнаруженным в большинстве тканей животных и растений.
Глутамат + пируват ⇄ аланин + α-кетоглутарат
Аланин, продуцируемый непосредственно в результате распада белка, а мышечные белки богаты аланином, может покидать клетку и переноситься кровотоком в печень; таким образом аминогруппа достигает печени.А скорость, с которой аланин, образованный при трансаминировании пирувата, переносится в кровоток, пропорциональна внутриклеточному производству пирувата.
Примечание. Аланин и глутамин являются основными источниками азота и углерода в межорганном метаболизме аминокислот.
Цикл Кэхилла в печени
Попадая в печень, печеночная аланинаминотрансфераза катализирует трансаминирование, в котором аланин, основная глюконеогенная аминокислота, действует как донор аминогруппы , а α-кетоглутарат — как акцептор α-кетокислоты.Продуктами реакции являются пируват, то есть углеродный скелет аланина, и глутамат.
Аланин + α-кетоглутарат ⇄ глутамат + пируват
Глутамат в реакции, катализируемой глутаматдегидрогеназой (EC 1.4.1.2), ферментом, присутствующим в матриксе митохондрий, образует ион аммония, который входит в цикл мочевины, и α-кетоглутарат, который может входить в цикл Кребса. Эта реакция представляет собой анаплеротическую реакцию , которая связывает метаболизм аминокислот с циклом Кребса.
Глутамат + H 2 O + NAD + ⇄ α-кетоглутарат + NH 4 + + NADH + H +
Однако глутамат может также реагировать с оксалоацетатом с образованием аспартата и α-кетоглутарата в реакции, катализируемой аспартатаминотрансферазой (EC 2.6.1.1). Аспартат участвует в образовании мочевины, а также в синтезе пуринов и пиримидинов.
Глутамат + оксалоацетат ⇄ аспартат + α-кетоглутарат
Также продуцируемый пируват может иметь разные метаболические судьбы: он может окисляться для производства АТФ, а затем выходить из глюкозно-аланинового цикла или вступать в путь глюконеогенеза и, таким образом, продолжать цикл.
Произведенная глюкоза высвобождается из печени в кровоток и доставляется в различные ткани, которые в ней нуждаются, например в скелетные мышцы, в которых она используется для синтеза пирувата. В свою очередь, новообразованный пируват может реагировать с глутаматом, замыкая цикл.
Трансаминазы
Как упоминалось ранее, удаление аминогруппы из аминокислот происходит посредством переаминирования (см. Выше общую реакцию). Эти реакции катализируются ферментами, называемыми аминотрансферазами или трансаминазами.
Это цитозольные ферменты, присутствующие во всех клетках, особенно в печени, почках, кишечнике и мышцах; им требуется пиридоксальфосфат или PLP, активная форма витамина B 6 или пиридоксин, в качестве кофермента, который прочно связан с активным центром.
В реакциях трансаминирования аминогруппа свободных аминокислот, за исключением треонина и лизина, направляется к небольшому количеству α-кетокислот, особенно к пирувату, оксалоацетату и α-кетоглутарату.
Клетки содержат разные типы аминотрансфераз: многие из них специфичны для α-кетоглутарата в качестве акцептора α-кетокислоты, но отличаются специфичностью для аминокислоты, от которой они названы.Примерами являются вышеупомянутая аланинаминотрансфераза, также называемая аланинтрансаминазой и глутаминовой пировиноградной трансферазой или GPT, и аспартатаминотрансфераза или AST, также называемая глутамино-щавелевоуксусной трансаминазой или GOT.
Следует подчеркнуть, что в этих реакциях отсутствует чистое дезаминирование, нет потери аминогрупп, поскольку акцептор α-кетокислоты аминирован, а аминокислота дезаминирована.
Функции глюкозо-аланинового цикла
Этот цикл выполняет различные функции.
- Транспортирует азота в нетоксичной форме из периферических тканей в печень.
- Он транспортирует пируват, глюконеогенный субстрат , в печень.
- Удаляет пируват из периферических тканей. Это приводит к более высокому производству АТФ из глюкозы в этих тканях. Фактически, НАДН, образующийся во время гликолиза, может попадать в митохондрии и окисляться посредством окислительного фосфорилирования.
- Он позволяет поддерживать относительно высокую концентрацию аланина в гепатоцитах, достаточную для ингибирования деградации белка.
- Он может играть роль в защите организма от инфекционных заболеваний.
Наконец, важно подчеркнуть, что нет чистого синтеза глюкозы в глюкозно-аланиновом цикле.
Энергозатраты глюкозо-аланинового цикла
Подобно циклу Кори, глюкозно-аланиновый цикл также требует затрат энергии, равных 3-5 АТФ .
Часть цикла, протекающая в периферических тканях, включает производство 5-7 АТФ на молекулу глюкозы:
- 2 АТФ производятся гликолизом;
- 3-5 АТФ происходят от NADH / FADH 2 (см. Ниже).
Вместо этого в печени глюконеогенез и цикл мочевины стоят 10 АТФ:
- На одну молекулу синтезированной глюкозы в процессе глюконеогенеза расходуется 6 АТФ;
- 4 АТФ расходуются в цикле мочевины на молекулу синтезированной мочевины.
Глюкозо-аланиновый цикл, как и цикл Кори, переносит часть метаболической нагрузки с внепеченочных тканей на печень. Однако затраты на энергию, оплачиваемые печенью, оправдываются преимуществами, которые цикл приносит всему телу, поскольку он позволяет в определенных условиях эффективно расщеплять белки во внепеченочных тканях (особенно в скелетных мышцах), что, в свою очередь, позволяет получение глюконеогенных субстратов , а также использование аминокислот для получения энергии во внепеченочных тканях.
Сходства и различия между циклом Кэхилла и циклом Кори
Между этими двумя циклами есть некоторые аналогии, которые перечислены ниже.
- Цикл Кэхилла частично перекрывает цикл Кори, когда пируват превращается в глюкозу, а моносахарид транспортируется во внепеченочные ткани, где он снова превращается в пируват через гликолитический путь.
- Начало пути глюконеогенеза для двух циклов одинаково: и аланин, и лактат превращаются в пируват.
- Как и цикл Кори, глюкозо-аланиновый цикл возникает между разными типами клеток , в отличие от метаболических путей, таких как гликолиз, цикл Кребса или глюконеогенез, которые происходят в отдельных клетках Цикл
Ниже приведены некоторые различия между двумя циклами.
- Основное различие касается трехуглеродного интермедиата , который из периферических тканей достигает печени: лактат в цикле Кори и аланин в цикле глюкоза-аланин.
- Другое отличие касается судьбы НАДН, продуцируемого гликолизом в периферических тканях.
В цикле Кори кофермент действует как восстанавливающий агент для восстановления пирувата до лактата в реакции, катализируемой лактатдегидрогеназой (EC 1.1.1.27).
В глюкозно-аланиновом цикле этого восстановления не происходит, и электроны НАДН могут переноситься в митохондрии через малат-аспартатный и глицерин-3-фосфатный челноки, генерируя НАДН, первый челнок, и FADh3, второй челнок.А выход АТФ из НАДН и ФАДН 2 составляет 2,5 и 1,5 соответственно. - Наконец, из предыдущего пункта ясно, что, в отличие от цикла Кори, цикл Кэхилла требует наличия кислорода и митохондрий в периферических тканях.
Список литературы
Берг Дж. М., Тимочко Ю. Л., Страйер Л. Биохимия. 5-е издание. У. Х. Фриман и компания, 2002 г.
Фелиг П., Позефск Т., Марлис Э., Кэхилл Г.Ф. Аланин: ключевая роль в глюконеогенезе.Наука 1970; 167 (3920): 1003-4. DOI: 10.1126 / science.167.3920.1003
Гроппер С.С., Смит Дж. Л., Грофф Дж. Л. Продвинутое питание и метаболизм человека. Cengage Learning, 2009 г. [Электронные книги Google]
Лекер С.Х., Голдберг А.Л. и Митч В.Э. Расщепление белков убиквитин-протеасомным путем в нормальных и болезненных состояниях. J Am Soc Nephrol 2006; 17 (7): 1807-19. DOI: 10.1681 / ASN.2006010083
Маллетт Л. Э., Экстон Дж. Х. и Парк С. Р. Контроль глюконеогенеза из аминокислот в перфузированной печени крысы.J. Biol Chem., 1969; 244 (20): 5713-23.
Нельсон Д.Л., Кокс М.М. Ленингер. Основы биохимии. 6-е издание. W.H. Фримен и компания, 2012
Раджу С.М., Мадала Б. Иллюстрированная медицинская биохимия. Издательство Jaypee Brothers, 2005 [Электронные книги Google]
Ву Г. Аминокислоты: биохимия и питание. CRC Press, 2013 [Электронные книги Google]
Преимущества аланина, побочные эффекты, взаимодействия и информация о дозировке
Проверено фактами
×Этот Dr.Содержание Axe проходит медицинский осмотр или проверку фактов, чтобы гарантировать достоверную информацию.
При строгих редакционных правилах выбора источников мы связываемся только с академическими исследовательскими учреждениями, сайтами авторитетных СМИ и, при наличии исследований, с рецензируемыми медицинскими исследованиями. Обратите внимание, что числа в скобках (1, 2 и т. Д.) Являются интерактивными ссылками на эти исследования.
Информация в наших статьях НЕ предназначена для замены личных контактов с квалифицированным специалистом в области здравоохранения и не предназначена в качестве медицинской консультации.
×Эта статья основана на научных доказательствах, написанных экспертами, и фактах, проверенных нашей обученной редакцией. Обратите внимание, что числа в скобках (1, 2 и т. Д.) Представляют собой интерактивные ссылки на медицинские рецензируемые исследования.
В нашу команду входят лицензированные диетологи и диетологи, сертифицированные специалисты по санитарному просвещению, а также сертифицированные специалисты по силовой и физической подготовке, личные тренеры и специалисты по корректирующим упражнениям. Наша команда стремится быть не только тщательной, но и объективной и беспристрастной.
Информация в наших статьях НЕ предназначена для замены личных контактов с квалифицированным специалистом в области здравоохранения и не предназначена в качестве медицинской консультации.
Джиллиан Леви, CHHC
8 июня 2019 г.
Аланин, также называемый L-аланином или альфа-аланином (α-аланин), входит в число 11 «заменимых» аминокислот, которые способен синтезировать ваш организм. самостоятельно.
Чем полезен L-аланин?
Он помогает во многих метаболических процессах и обеспечивает энергией ваши мышцы, мозг и центральную нервную систему.Эта аминокислота может помочь при лечении таких состояний, как усталость, низкий уровень сахара в крови (гипогликемия), заболевания печени, высокий уровень холестерина, увеличение простаты (доброкачественная гипертрофия простаты) и многие другие.
Что такое аланин?
Аланин — это незаменимая аминокислота, которую организм может производить из других аминокислот без необходимости получать ее из пищевых источников. Обычно он содержится в больших количествах в кровотоке большинства людей и является одной из самых концентрированных аминокислот в белковой пище.
Среди всех аминокислот это одна из наиболее широко используемых для построения белков. Он считается глюкогенной аминокислотой и синтезируется из пирувата и аминокислот с разветвленной цепью (BCAA), включая валин, лейцин и изолейцин.
Что делает аланин для вашего тела? Что такое функция аланина? Вот некоторые из наиболее важных функций:
- Играет роль в преобразовании сахара (глюкозы) в энергию — он участвует в глюкозно-аланиновом цикле, который происходит между тканями и печенью
- Обработка витаминов группы B
- Разрушение триптофан и витамин B6
- Помощь в кислотном обмене
- Повышение иммунитета
- Облегчение метаболизма триптофана
- Образование карнозина, ансерина и пантотеновой кислоты (витамин B5)
- Обеспечение мозга и центральной нервной системы энергией
- Помощь в развитии и восстановление мышечной ткани
- Помощь печени в детоксикации крови
- Защита клеток от окислительного повреждения
- Помощь в поддержании нормального уровня холестерина
L-аланин vs.Бета-аланин
L-аланин несколько отличается от бета-аланина (β-аланина). Бета-аланин — это модифицированная версия аминокислоты и субстрата карнозина, который, как было показано, помогает предотвратить утомление во время упражнений высокой интенсивности.
Исследования показывают, что карнозин действует как буфер, предотвращающий закисление мышечных клеток, тем самым снижая мышечную усталость во время упражнений. Вот почему β-аланин быстро становится популярным помощником в спортивных достижениях. Типичная суточная доза бета-аланина составляет от четырех до шести граммов в день, которую принимают в разделенных дозах два-три раза в день в течение примерно двух недель.Следует помнить, что это может вызвать покалывание кожи или зуд губ, что, как правило, безвредно и временно.
Связанные с: Цитруллин: аминокислота, которая улучшает кровообращение и производительность (+ информация о продуктах и дозировке)
Польза для здоровья
1. Может помочь организму использовать глюкозу (сахар)
Аланин иногда используется для контролировать уровень сахара в крови у людей с диабетом, так как он помогает организму использовать глюкозу и предотвращает низкий уровень сахара в крови (также называемый гипогликемией).Печень поглощает его и превращает в пируват. Этот процесс важен для регулирования использования глюкозы и сахара в крови.
2. Помогает поддерживать здоровый уровень холестерина
Существуют доказательства того, что эта аминокислота может иметь естественный эффект снижения холестерина, особенно при использовании в сочетании с другими аминокислотами, такими как аргинин и глицин. Эти три обычно входят в состав таблеток с аминокислотными соединениями. В некоторых исследованиях было показано, что ежедневные уровни потребления аланина от 200 до 600 миллиграммов в день эффективны для контроля холестерина.
3. Обеспечивает энергией во время голодания
Как глюкогенная аминокислота, аланин может превращаться в печени за счет каталитического действия глутамат-пируваттрансаминазы (GPT) (также известной как трансаминаза аланина). Аланин играет роль в преобразовании глюкозы в печени, поэтому он может поглощаться мышцами и использоваться для получения энергии, в том числе в периоды голодания / ограничения калорий, когда мышечные белки могут расщепляться. Это означает, что потребление достаточного количества этой аминокислоты может помочь остановить истощение мышц.
4. Может помочь улучшить физическую работоспособность и нарастить мышцы
Эта незаменимая аминокислота служит важным источником энергии для мышц и центральной нервной системы. Печень может преобразовывать L-аланин в глюкозу по мере необходимости в качестве топлива для мышц, в том числе во время упражнений.
Поскольку он используется для построения белков и наращивания мышечной массы, он может поддерживать физическую работоспособность и восстановление. Спортсмены, которые тренируются с высокой интенсивностью, иногда добавляют эту аминокислоту, чтобы обеспечить свои мышцы топливом и поддерживать биосинтез белка.Это также может быть полезно для предотвращения усталости и поддержки более высокой выносливости / выносливости. Еще одно преимущество, связанное с поддержанием активности, заключается в том, что это помогает поддерживать физическую форму среди людей, подверженных сердечно-сосудистым заболеваниям.
5. Поддерживает здоровье простаты
Одна часть тела, которая имеет высокие концентрации этой конкретной аминокислоты, — это жидкость простаты. Аланин может помочь защитить предстательную железу от увеличения и уменьшить боль, связанную с проблемами простаты, такими как боль при мочеиспускании, боль из-за отека и симптомы, вызванные раком простаты.Некоторые исследования также показали, что он обеспечивает защиту от апоптоза, вызванного провоспалительными цитокинами, и увеличивает выработку антиоксидантов в клетках.
Симптомы и причины дефицита
Дефицит аланина, поскольку он несущественен, встречается крайне редко, поскольку организм большинства людей синтезирует достаточно. Однако люди, которые очень активны, больны и / или находятся в состоянии стресса; кто придерживается низкобелковой диеты; или те, кто недоедают, могут получить пользу от добавления этой аминокислоты для предотвращения симптомов дефицита.Взрослые с заболеванием печени или диабетом также могут быть восприимчивы к низкому уровню, и в этом случае могут быть полезны добавки этой аминокислоты.
Некоторые признаки и симптомы низкого уровня аланина могут включать:
- Усталость
- Плохая выносливость и сила
- Слабость и мышечная атрофия (сокращение)
- Головокружение и обморок из-за колебаний уровня сахара в крови
- Настроение
- Изменения аппетита
Продукты питания и добавки
Даже несмотря на то, что ваше тело может вырабатывать необходимый ему аланин, все же полезно получать дополнительные незаменимые аминокислоты из пищевых источников.
Какие продукты содержат аланин?
Он содержится в самых разных белковых продуктах. К основным продуктам, содержащим эти незаменимые аминокислоты, относятся:
- Птица, например курица и индейка
- Говядина и мясо травяного откорма
- Протеиновые порошки
- Рыба и морепродукты
- Яйца
- Соевые продукты (например, темпе, органические эдамаме). и т. д.)
- Дрожжи
- Бобовые и фасоль
- Цельные зерна, такие как зародыши пшеницы, киноа, рис, гречка, овес и т. д.
Добавки аланина
В форме добавок он обычно продается в виде порошкообразной аминокислоты в свободной форме. Использование аланина в виде добавок включает лечение таких состояний, как боль в предстательной железе, усталость, низкий уровень сахара в крови и высокий уровень холестерина. В некоторых случаях врачи используют внутривенный аланин для лечения определенных заболеваний.
Аминокислоты, подобные этой, доступны в виде отдельных аминокислот или в виде комбинаций. Некоторые поливитамины и пищевые добавки содержат все 20 незаменимых и заменимых аминокислот.Протеиновые порошковые добавки, такие как сывороточный протеин, протеин коллагена, протеин конопли, протеин гороха или протеин коричневого риса, содержат почти все незаменимые аминокислоты, которые необходимы вашему организму.
Как принимать и дозировка
В форме порошка рекомендуемое количество аланина составляет от 1,1 до 2,3 грамма (примерно от 1/4 до 1/2 чайной ложки) в день между приемами пищи или в соответствии с рекомендациями вашего лечащего врача.
Дозы от 20 до 40 граммов в день безопасно используются для контроля уровня сахара в крови у людей с диабетом, например, путем предотвращения очень низкого уровня сахара в крови из-за слишком большого количества инсулина.Если вы лечите другие заболевания, такие как высокий уровень холестерина, лучше посоветоваться с врачом, чтобы определить лучшую дозу.
Рецепты
Ниже приведены полезные рецепты, содержащие хорошее количество белка и, следовательно, аланина и других аминокислот:
Риски и побочные эффекты
Добавки L-аланина могут повышать уровень сахара в крови, что может быть проблематичным для людей с диабетом, если уровень сахара в их крови уже нормальный или слишком высокий.Людям с диабетом следует проконсультироваться со своим врачом, чтобы контролировать уровень сахара в крови, прежде чем принимать добавки аланина.
Всегда внимательно читайте инструкции по дозировке перед началом приема любых новых добавок, включая аминокислоты. Прием аминокислот в высоких дозах может вызвать проблемы с пищеварением, кожный зуд и покалывание, а также затруднить процесс обработки почек и печени.
Последние мысли
- Аланин — это незаменимая аминокислота, а это означает, что ваше тело способно вырабатывать необходимый вам аланин из других аминокислот.Хотя для получения необходимого количества пищи не обязательно есть определенные продукты, более высокое потребление может дать некоторые преимущества.
- Функции аланина включают преобразование сахара (глюкозы) в энергию, строительство и восстановление мышечной ткани, помощь печени в детоксикации крови, защиту клеток от окислительного повреждения, помощь в поддержании нормального уровня холестерина, формирование белков и ферментов и многое другое.
- Преимущества употребления большего количества аланина могут включать помощь организму в использовании глюкозы, помощь в снижении холестерина, поддержание мышечной массы, повышение физической работоспособности, снабжение организма энергией во время голодания и поддержание здоровья простаты.
- Сбалансированная, здоровая диета, включающая достаточно белковой пищи, такой как мясо, рыба, птица, яйца, бобовые, зародыши пшеницы, цельные зерна и дрожжи, обеспечат вас аланином.




 Все виды гипоксии имеют сложный генез, в эксперименте используют гипобарию или моделируют гипоксию газовыми смесями, чаще всего содержащими избыток N2 и СО2 при недостатке О2, однако во всех случаях причиной смерти является гипоксия чувствительных к недостатку кислорода клеток головного мозга [13]. Заслуживает внимания модель гиперкапнической «гипоксии замкнутого пространства» (ГЗП), как наиболее часто встречающейся в практике (землетрясения, завалы в шахтах и др.). ГЗП используется в аэрокосмической медицине для тренировок и отбора космонавтов и при скрининге антигипоксантов. При ГЗП на организм действуют гиперкапния, накопление аммиака, формальдегида и других токсических и летучих метаболитов в гермокамере.
Все виды гипоксии имеют сложный генез, в эксперименте используют гипобарию или моделируют гипоксию газовыми смесями, чаще всего содержащими избыток N2 и СО2 при недостатке О2, однако во всех случаях причиной смерти является гипоксия чувствительных к недостатку кислорода клеток головного мозга [13]. Заслуживает внимания модель гиперкапнической «гипоксии замкнутого пространства» (ГЗП), как наиболее часто встречающейся в практике (землетрясения, завалы в шахтах и др.). ГЗП используется в аэрокосмической медицине для тренировок и отбора космонавтов и при скрининге антигипоксантов. При ГЗП на организм действуют гиперкапния, накопление аммиака, формальдегида и других токсических и летучих метаболитов в гермокамере.
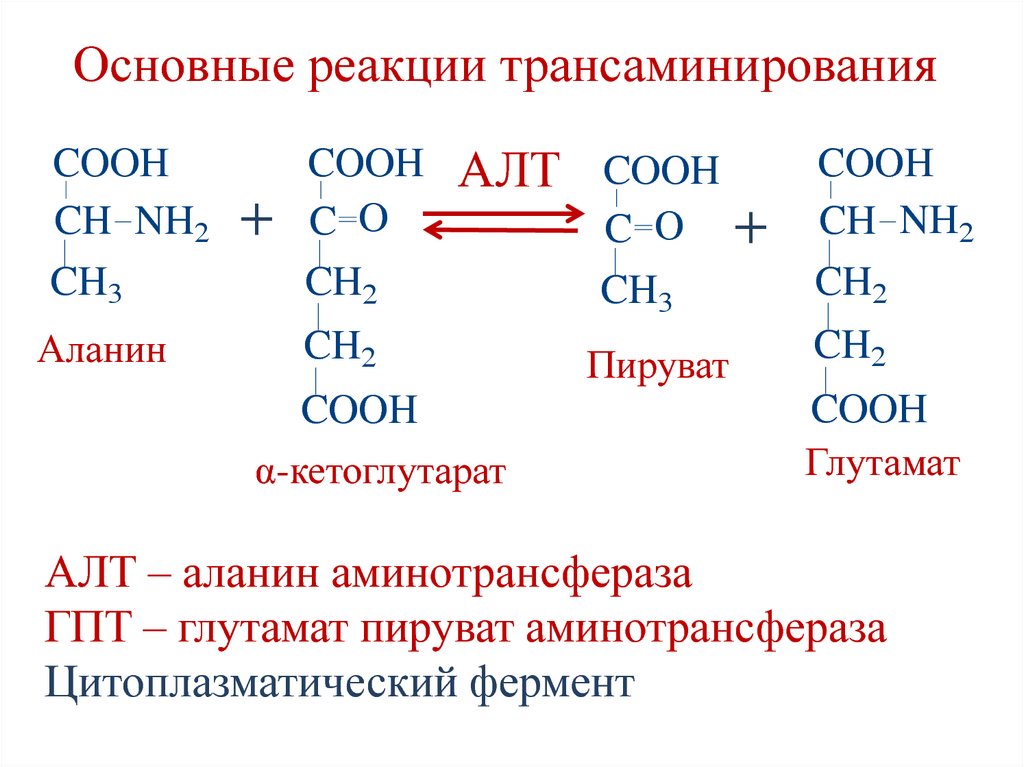 Крыс исследовали в утренние часы и за 1 ч до опыта не кормили. Животных помещали в герметические индивидуальные камеры объемом 1066 см3 и регисрировали продолжительность жизни животных до времени наступления последнего агонального вдоха с точностью 15–20 секунд. Повышение температуры в гермокамерах было незначительным — до 28 °С.
Крыс исследовали в утренние часы и за 1 ч до опыта не кормили. Животных помещали в герметические индивидуальные камеры объемом 1066 см3 и регисрировали продолжительность жизни животных до времени наступления последнего агонального вдоха с точностью 15–20 секунд. Повышение температуры в гермокамерах было незначительным — до 28 °С.
 Выделяющийся 14СО2 улавливали специальным фильтром-поглотителем в инкуба-ционных сосудиках при перемешивании [15]. Скорость катаболизма меченых аминокислот рассчитывали в нмолях выделяемого 14СО2 на г-1 тканимин-1. Определение максимальной и эндогенной глутаматдекарбоксилазной (ГДК) активности в головном мозге определяли хроматографическим методом [16] и выражали образовавшейся ГАМК в 1 мин на 1 г ткани в мкмолях. Результаты исследований обрабатывали статистически [17, 18].
Выделяющийся 14СО2 улавливали специальным фильтром-поглотителем в инкуба-ционных сосудиках при перемешивании [15]. Скорость катаболизма меченых аминокислот рассчитывали в нмолях выделяемого 14СО2 на г-1 тканимин-1. Определение максимальной и эндогенной глутаматдекарбоксилазной (ГДК) активности в головном мозге определяли хроматографическим методом [16] и выражали образовавшейся ГАМК в 1 мин на 1 г ткани в мкмолях. Результаты исследований обрабатывали статистически [17, 18].



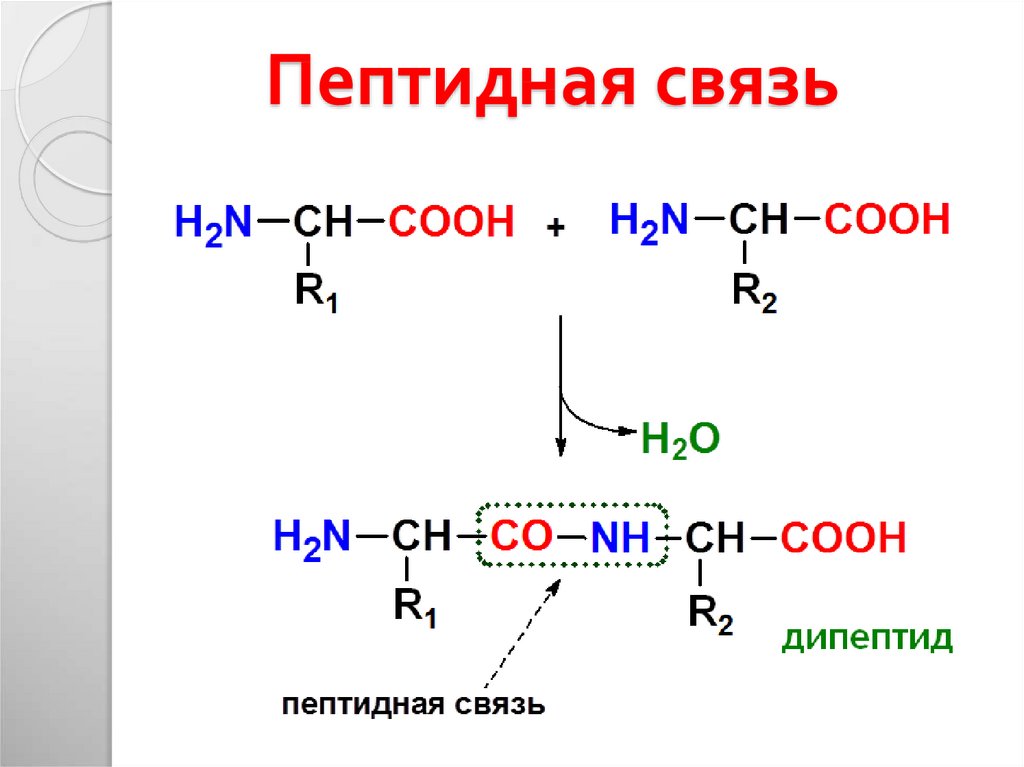 Инъекция L-аланина также повышает «максимальную» активность ГДК в полушариях головного мозга крыс в агональный период при ГЗП.
Инъекция L-аланина также повышает «максимальную» активность ГДК в полушариях головного мозга крыс в агональный период при ГЗП.
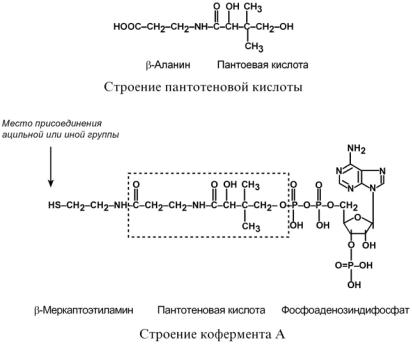 Практически это достигалось наблюдениями не только времени наступления бокового положения и судорог, а также времени «последнего агонального вдоха», через 15–30 с после которого животное извлекали из гермокамеры.
Практически это достигалось наблюдениями не только времени наступления бокового положения и судорог, а также времени «последнего агонального вдоха», через 15–30 с после которого животное извлекали из гермокамеры.
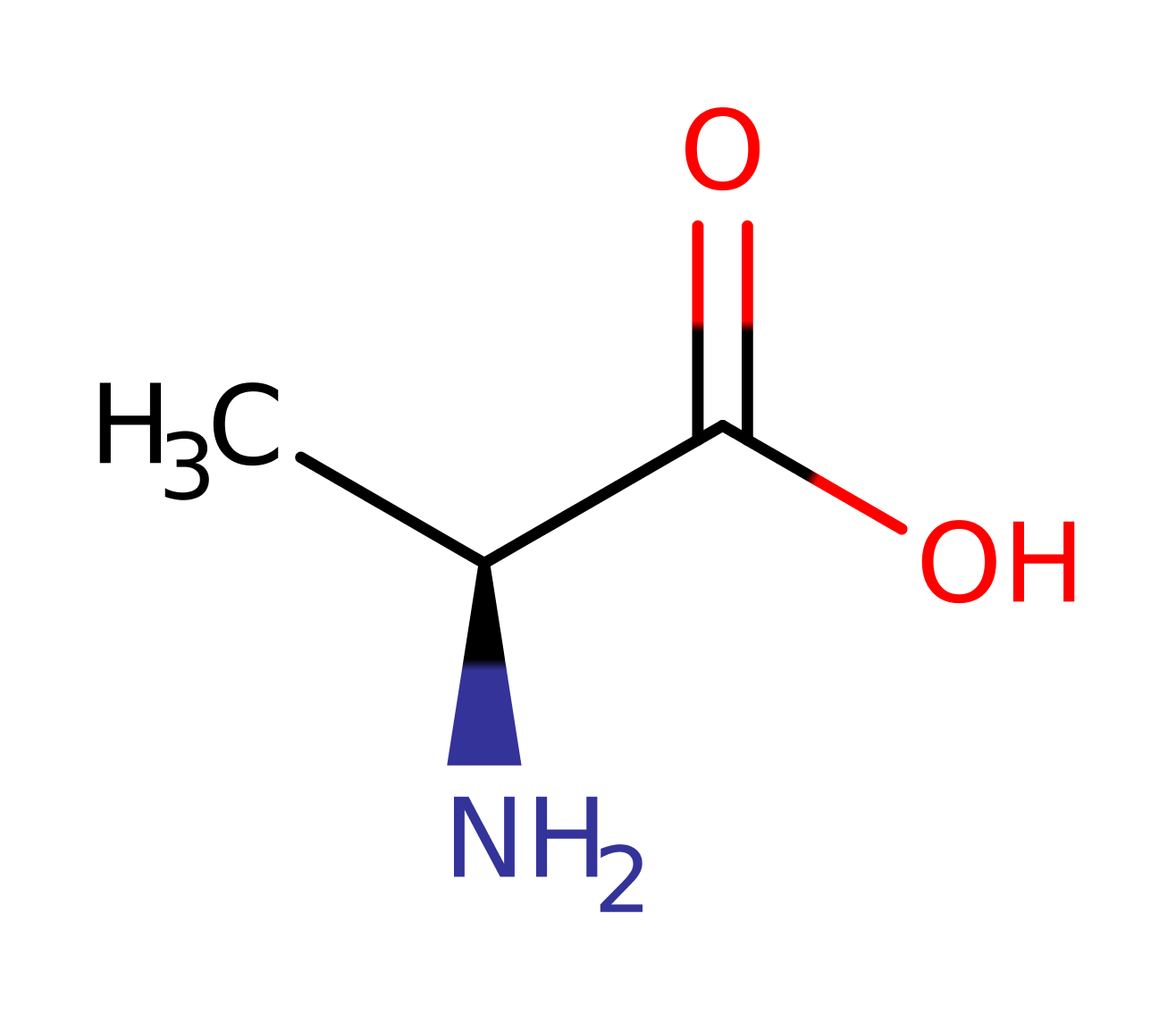
 Кроме того, существуют и общие механизмы, объясняющие наблюдаемое нами снижение окислительного катаболизма L-аланина и L-глутамата в агональной стадии гипоксии замкнутого пространства, в частности, накопление в клетках мозга в этот период НАДН2 и, возможно, ацилов КоА.
Кроме того, существуют и общие механизмы, объясняющие наблюдаемое нами снижение окислительного катаболизма L-аланина и L-глутамата в агональной стадии гипоксии замкнутого пространства, в частности, накопление в клетках мозга в этот период НАДН2 и, возможно, ацилов КоА.
 био-хим. журн. —1984. —56, N 6. —С. 637–641.
био-хим. журн. —1984. —56, N 6. —С. 637–641. Г., Пашаева Д.Э., Эмирбекова А.А., Эмирбеков Э.З. N-ацетилированные дикарбоновые аминокислоты в мозге при гипотермии // Пробл. криобиол. —1996. —N 4. —С. 38–41.
Г., Пашаева Д.Э., Эмирбекова А.А., Эмирбеков Э.З. N-ацетилированные дикарбоновые аминокислоты в мозге при гипотермии // Пробл. криобиол. —1996. —N 4. —С. 38–41. університету. —1999. —Т. 4. —вип. 3. —С. 5–9.
університету. —1999. —Т. 4. —вип. 3. —С. 5–9.
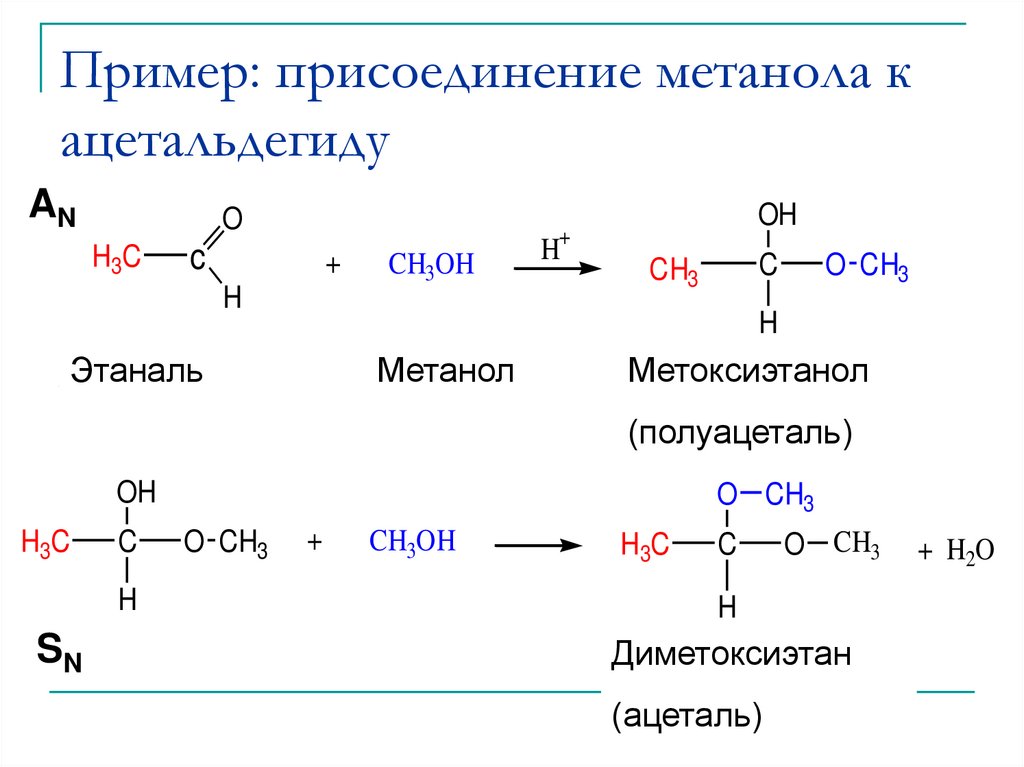
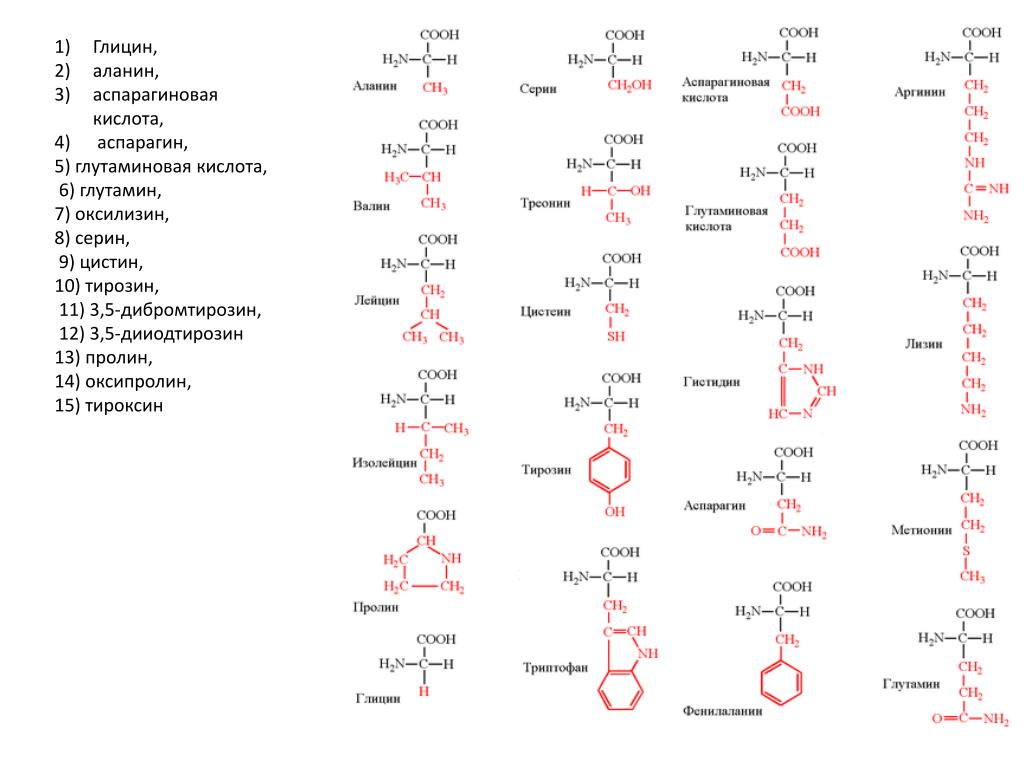
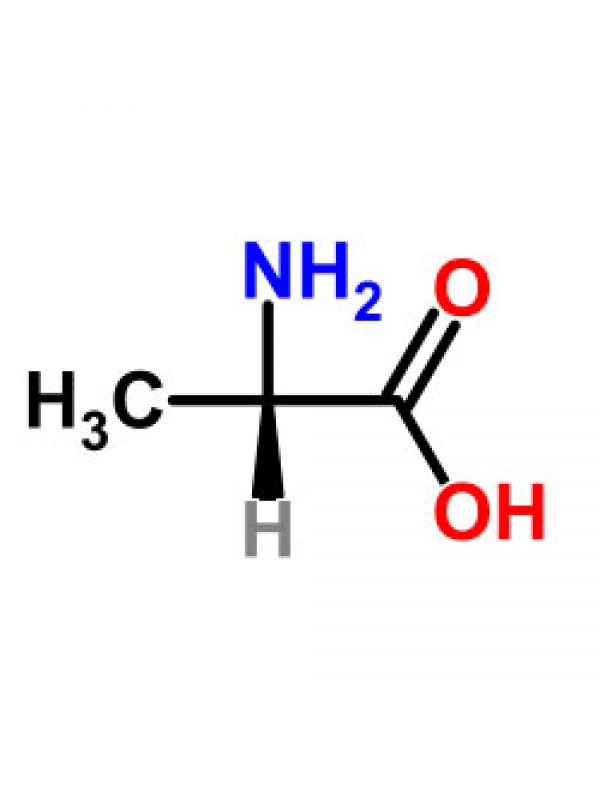 Данные ограничены, но бета-аланин кажется безопасным для здоровых людей.
Данные ограничены, но бета-аланин кажется безопасным для здоровых людей.