Сколько аминокислот содержит белок: виды и польза.
Знания среднестатистического человека об аминокислотах достаточно ограничены. Многие знают лишь о том, что эти органические вещества содержатся в белках и без них невозможна нормальная деятельность организма.
Что это такое?
Аминокислоты (аминокарбоновые кислоты) – это стройматериал для белка, являющегося участником всех физиологических процессов, происходящих в организме. Из него состоят кости, мышцы, внутренние органы, ногти, волосы и другие составляющие человеческого тела.
Внимание! Белки имеют различный состав, поэтому не все из них одинаково полезны.
Сколько аминокислот входит в состав белка?
Белки представляют собой цепочку из аминокарбоновых кислот. Ученым потребовалось много десятилетний для поиска правильного ответа на вопрос о количестве аминокислот, входящих в состав белка.
Внимание! Установлено, что для нормальной жизнедеятельности организму человека необходимо двадцать протеиногенных аминокислот, которые принято называть мажорными.
Аминокислоты бывают заменимыми и незаменимыми. Первые синтезируются в самом организме, а вторые попадают туда извне вместе с пищей. Однако есть и относящиеся и к тому, и к другому разряду.
Заменимые аминокислоты
Эти аминокислоты продуцируются путем эндогенного синтеза из других веществ, поступающих вместе с пищей, в самом организме. Всего таких веществ двенадцать. Важнейшими из них являются:
- аланин;
- аргинин;
- аспарагин;
- аспарагиновая кислота.
Незаменимые аминокарбоновые кислоты
Аминокислоты этого типа оказываются в организме, попадая туда вместе с едой. В значительных количествах они присутствуют в белках животного происхождения и бывают восьми видов.
В значительных количествах они присутствуют в белках животного происхождения и бывают восьми видов.
Лейцин
Восстанавливает мышцы, кожу и кости. Он участвует в продуцировании гормона роста, стабилизирует уровень сахара в крови и помогает сжигать жиры.
Внимание! Обеспечение организма лейцином важно тем, кто желает нарастить мышцы.
Изолейцин
Стимулирует выработку энергии. Его значительное количество присутствует в мясе, рыбе, орехах, яйцах, горохе и сое.
Эти продукты должны присутствовать в рационе спортсменов. После многочасовых интенсивных тренировок изолейцин помогает скорейшему восстановлению мышц, снимает крепатуру, участвует в образовании гемоглобина, а также регулирует количество сахара.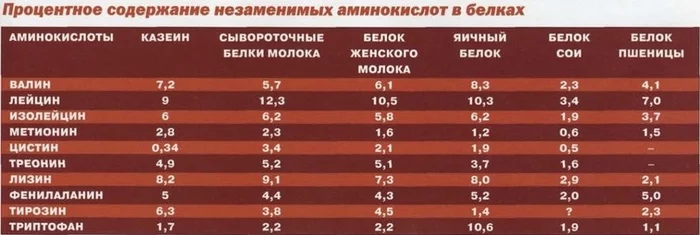
Лизин
Важен для иммунитета. Он участвует в синтезе защитных антител и выработке гормонов роста. Благодаря лизину обновляется костная ткань, и синтезируется коллаген.
Внимание! Лизин присутствует в яйцах, картофеле, мясе (за исключением белого мяса), рыбе и кисломолочных продуктах.
Фенилаланин
Содержится в орехах, грибах, курином мясе, молокопродуктах, бананах, абрикосах и топинамбуре.
Люди, у которых наблюдается недостаток фенилаланина в организме, подвержены депрессиям, им трудно концентрировать свое внимание, и у них наблюдаются проблемы с памятью.
Метионин
Помогает сжигать жир, повышает выносливость и работоспособность человека. Он присутствует в мясе, рыбе, кисломолочных продуктах, семенах подсолнечника, некоторых других продуктах.
Он присутствует в мясе, рыбе, кисломолочных продуктах, семенах подсолнечника, некоторых других продуктах.
Треонин
Оказывает влияние на сердце, сосуды, а также на нервную систему и иммунитет человека. Его много в молочных продуктах, овощах, мясе, грибах, злаках.
Внимание! При недостатке треонина наблюдаются проблемы с зубами и костями.
Триптофан
Обеспечивает синтез гормона счастья серотонина, а также регулирует давление. Его применяют для устранения негативных последствий употребления алкоголя и наркосодержащих веществ.
Валин
Регулирует мышечный метаболизм, используется для восстановления организма, активизации умственной деятельности, а также смягчает последствия употребления алкоголя и наркотиков. Он присутствует в мясе, сое, грибах, молокопродуктах и арахисе.
Теперь вам известно, сколько аминокарбоновых кислот присутствует в белках, и как они влияют на здоровье человека. Старайтесь следить за своим рационом и будьте здоровы!
Старайтесь следить за своим рационом и будьте здоровы!
Сколько аминокислот входит в состав белков, как они называются?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сколько аминокислот входит в состав белков, как они называются?
Белок является главным строительным материалом для организма. Его структура сложная и многоступенчатая. Какие аминокислоты входят в его состав?
Белок очень важен для организма, так как является строительным материалом. Его основой являются аминокислоты. Эти вещества отвечают за разные функции и нужны для поддержания нормального состояния организма.
Основные свойства аминокислот
Аминокислоты обладают следующими свойствами:
- Быстро и хорошо растворяются в жидкой среде.
- По форме напоминают кристаллы.
- При воздействии высоких температур могут расплавиться.
- Имеют некоторые признаки кислот и оснований одновременно.
- Получаются в процессе белкового гидролиза.
Для чего аминокислоты нужны организму?
Биологическая роль аминокислот заключается в следующем:
- обеспечивают правильную работу иммунной системы;
- синтезируют глюкозу и участвуют в углеводном обмене;
- выступают в роли строительного материала для мышц и сухожилий;
- помогают спортсменам при наборе мышечной массы;
- поддерживают здоровье соединительных тканей;
- помогают поврежденным тканям быстрее восстановиться;
- участвуют в выработке энергии;
- выводят из организма вредные вещества и токсины;
- участвуют в образовании гормонов;
- поддерживают печень в порядке;
- помогают поддерживать нормальную работу головного мозга;
- обеспечивают бодрость духа и хорошее настроение;
- повышают работоспособность человека и его творческий потенциал;
- помогают нервным клеткам защититься от вредного воздействия алкогольных напитков;
- улучшают психическое здоровье человека;
- участвуют в жировом обмене;
- поддерживают работу органов желудочно-кишечного тракта;
- регулируют работу щитовидной железы;
- поддерживают в норме массу тела;
- замедляют естественные процессы старения.

Сколько аминокислот входит в состав белков?
- Лейцин, нужный для набора мышечной массы и контроля массы тела.
- Изолейцин, стимулирующий выделение энергии.
- Лизин, отвечающий за укрепление иммунитета и повышение защитных сил организма.
- Фенилаланин, обеспечивающий правильную работу центральной нервной системы.
- Метионин, ответственный за эффективное и быстрое сжигание подкожного жира.
- Треонин, оказывающий положительное влияние на центральную нервную систему.
- Триптофан, формирующий полезные для жизнедеятельности гормоны.
- Валин, ускоряющий процессы обмена веществ.
Также белок образуют несколько заменимых аминокислот. К ним относятся:
- Аланин, необходимый для процессов углеводного обмена и выведения из организма токсических веществ.

- Аспарагиновая кислота, обеспечивающая человеку энергичность и прилив бодрости.
- Аспарагин, обеспечивающий работу центральной нервной системы и головного мозга.
- Гистидин, вырабатывающий кровяные тельца красного цвета.
- Серин, отвечающий за правильную и эффективную работу головного мозга и за протекание когнитивных процессов.
- Цистеин, подающий в организм кератин.
- Аргинин, оздоравливающий кожу, кости, мышечную ткань и сухожилия.
- Глютаминовая кислота, без которой невозможна нормальная работа головного и спинного мозга.
- Глютамин, предотвращающий атрофию мышечных волокон.
- Глицин, ускоряющий процессы свертываемости крови.
- Пролин, стимулирующий выработку коллагена.
- Тирозин, поддерживающий в норме аппетит и артериальное давление.
Внимание! В состав белков входят разные аминокислоты, заменимые и незаменимые.Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сколько всего аминокислот существует?
Выберите разделВ помощь кондитеруКак применятьПолезно знатьРецептуры и технологииРецептыРецепты кондитера
Этот блог не предназначен для предоставления диагностики, лечения или медицинской консультации. Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
Контент, представленный в этом блоге, предназначен только для информационных целей. Пожалуйста, проконсультируйтесь с врачом или другим медицинским работником относительно любых медицинских или связанных со здоровьем диагнозов или вариантов лечения. Информация в этом блоге не должна рассматриваться в качестве замены консультации с медицинским работником. Утверждения, сделанные о конкретных продуктах в этом блоге, не одобрены для диагностики, лечения, лечения или профилактики заболеваний.
Как вы думаете – сколько всего аминокислот существует? Давайте разберемся в этом вопросе. Аминокислоты — это в первую очередь «фундамент» для образования в нашем организме протеинов, гормонов, антител, белков в тканях, различных ферментов. Все белки – это соединенные в определенной последовательности цепочки из аминокислот. Если отсутствует одна аминокислота, то строительство молекулы белка становится попросту невозможным.
Каково назначение этих элементов? Аминокислоты в первую очередь обеспечивают функционирование практически всех систем в организме, угнетая или наоборот стимулируя все процессы жизнедеятельности:
- обогащают энергией, необходимой для мышечной ткани;
- обеспечивают правильную работу и функционирование нервной системы, являясь нейромедиаторами;
- активно участвуют в водно-солевом обмене.

На сегодняшний день обнаружено 26 аминокислот. Простыми компонентами в образовании белка, считаются 20 аминокислот. Все живые организмы образуют множество различных соединений белка. Все аминокислоты можно разделить на две группы:
1. Аминокислоты незаменимые – они поступают в наш организм исключительно с белковой пищей. Это следующие кислоты:
- гистидин;
- метионин;
- треонин;
- изолейцин;
- лейцин;
- фенилаланин;
- триптофан;
- валин.
2. Аминокислоты заменимые – они поступают в человеческий организм с белковой пищей или строятся из других аминокислот. В их число входят:
- аланин;
- глицин;
- аргинин;
- аспарагин;
- кислота аспарагиновая;
- цистеин;
- кислота глютаминовая;
- глютамин;
- пролин;
- серин;
- таурин;
- тирозин.

А где же эти аминокислоты синтезируются? Основная масса аминокислот в организме человека образуется в печени. Но к сожалению, стрессы, инфекции, старение и многие другие факторы, нарушают эти процессы, что ведет к быстрому истощению организма и потере физической активности.
Чтобы и вы получили такой ошеломительный эффект, покупайте кондитерские ингредиенты по промокоду BLOG со скидкой в 10%, который распространяется на все заказы до 15 кг! И до встреч в новых статьях!
«Сколько известно аминокислот?» – Яндекс.Кью
Мой ответ. Учёным известно порядка 500 аминокислот. Около 240 из них в природе бывают в свободном виде, а остальные — в промежуточном — как продукты обмена веществ.
На сегодняшний день в организме человека обнаружено 26 аминокислот.
В образовании белка, считается, принимают участие 22 аминокислоты (21 — селеноцистеин, 22 — пирролизин (стандартные протеиногенные аминокислоты).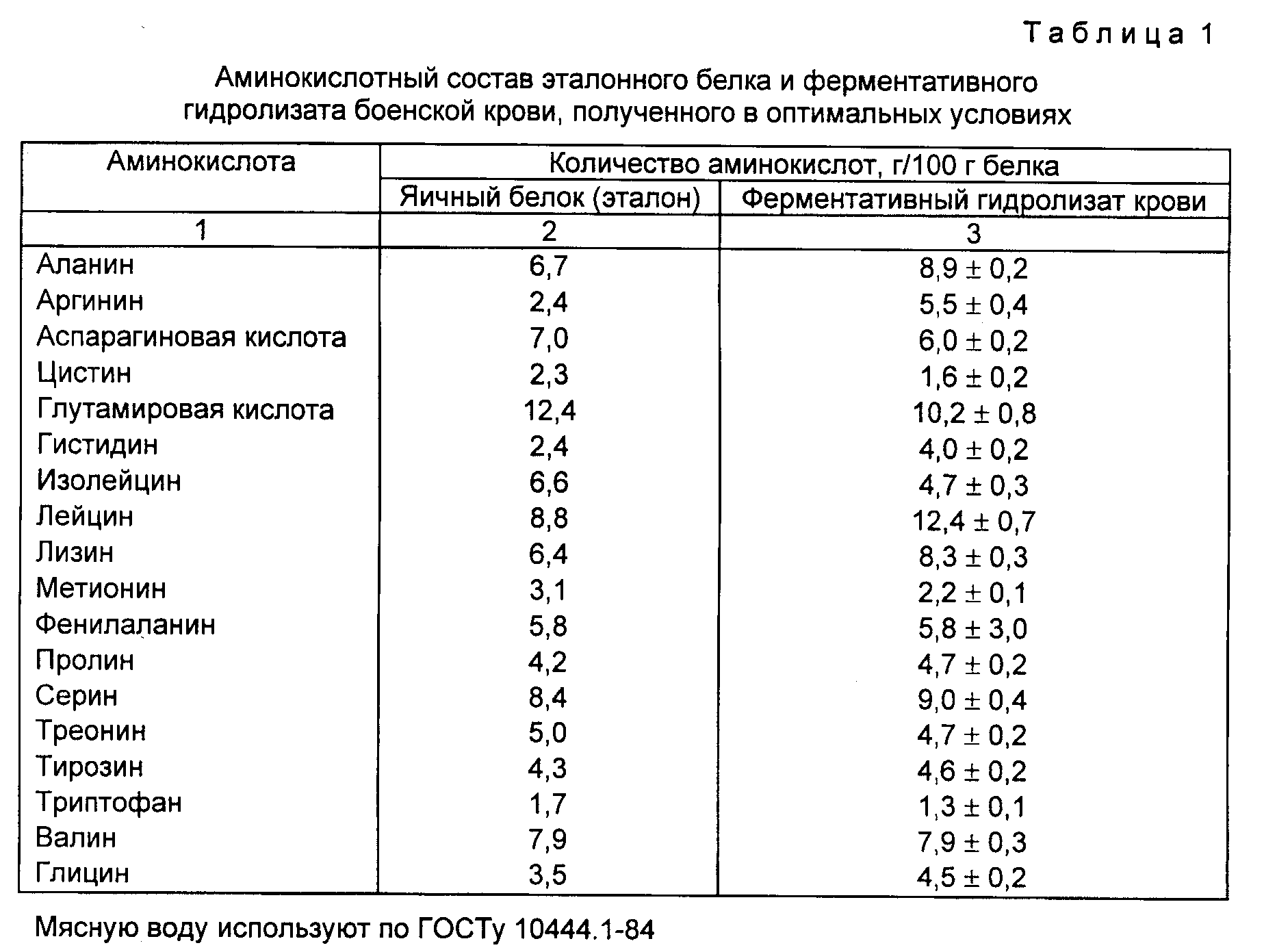 https://ru.wikipedia.org/wiki/
https://ru.wikipedia.org/wiki/
Все аминокислоты можно разделить на две группы: незаменимые (поступают в организм извне) и заменимые (синтезируются в организме). Но есть ещё и третья, и четвёртая группа — частично заменимые и условно незаменимые. Но это разделение весьма условно. Вообще, чтобы производить такие «подсчёты», необходимо учитывать, о какаких именно организмах идёт речь.
Для взрослого здорового человека незаменимые аминокислоты: валин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин, селеноцистеин, пирролизин. Это 10 незаменимых аминокислот. Также часто к незаменимым относят гистидин. Это 11 аминокислота. Для детей также незаменимым является аргинин. Итого насчитывается 12 аминокислот незаменимых для человека.
Новорождённые дети и больные люди не могут вырабатывать некоторые аминокислоты. Эти аминокислоты считаются условно незаменимыми. К ним относятся: тирозин, цистеин. Они могут синтезироваться в организме, но при наличии других аминокислот.
Они могут синтезироваться в организме, но при наличии других аминокислот.
Частично заменимые — их организм синтезирует, но мало. Это аргинин и гистидин. Как видим, аргинин и гистидин по другим классификациям относят к незаменимым, а ещё по другим — условно заменимым. А иногда и условно незаменимые, и частично заменимые объединяют в одну группу.
К заменимым аминокислотам принято относить: аланин, аспарагин, аспарагиновая кислота (аспартат), глицин, цистеин, глютамин, глютаминовая кислота (глютамат), пролин, серин, таурин*, тирозин. Насчитывается 11 заменимых аминокислот.
*Таурин выполняет некоторые функции аминокислот, но по строению к ним не относится.
Таким образом, мнение, что существуют 20 аминокислот, из которых 8 незаменимые, является неверным.
Белки | Tervisliku toitumise informatsioon
Белки составляют примерно 15–20% массы тела человека, что при весе в 70 кг дает около 12 кг. Основные задачи белков – обеспечение роста, построения и развития организма. Белковый состав имеют почти все энзимы и часть гормонов. Белки активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы, а также участвуют в транспортировке многих соединений.
Белковый состав имеют почти все энзимы и часть гормонов. Белки активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы, а также участвуют в транспортировке многих соединений.
Белки состоят из аминокислот, подразделяемых на незаменимые, которые нужно получать с пищей, и заменимые, которые организм способен синтезировать самостоятельно. Незаменимыми для человека аминокислотами являются изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и гистидин. Заменимыми для человека аминокислотами являются аланин, аспарагин, аспарагиновая кислота, цистеин, глютамин, глютаминовая кислота, глицин, пролин, серин и тирозин. Разные продукты содержат разные сочетания и количества аминокислот.
Белки животного происхождения (белки яиц, молока, рыбы и мяса) содержат больше незаменимых аминокислот по сравнению с белками растительного происхождения. К сожалению, источники многих незаменимых животных белков слишком насыщены жиром. Довольно хороший аминокислотный состав имеют также белки, содержащиеся в сое, рисе, орехах и семенах.
В части белков (например, белках зерновых растений) недостает некоторых незаменимых аминокислот. Их дефицит можно компенсировать небольшим количеством белков животного происхождения, например, приготовить манную кашу на молоке, добавить в макароны сыр и т.д.
Белки выполняют в организме множество функций:
- они необходимы для роста и строительства клеток организма,
- почти все энзимы и часть гормонов имеют белковый состав,
- активно участвуют в производстве антител и обеспечивают крепость и активность иммунной системы,
- участвуют в транспортировке многих соединений,
- дают пищевую энергию: 1 г = 4 ккал.
Рекомендуется покрывать белками 10–20 % суточной потребности в энергии. Человеку с потребностью в энергии 2000 ккал в сутки следует употреблять: от 0,1 x 2000 ккал / 4 ккал = 50 г до 0,20 x 2000 ккал/ 4 ккал = 100 г белков.
Лучшими источниками белков животного происхождения являются яйца, молочные продукты (например, творог, сыр, зернистый творог), рыба, птица, мясо. Лучшими источниками белков растительного происхождения являются бобовые, орехи, семена и зерновые продукты. Серьезный недостаток белка приводит к отекам и мышечной слабости, изменениям волос и кожи. Белковый дефицит часто возникает вместе с дефицитом энергии, обусловленным недостатком белков и других питательных веществ в результате общего дефицита питательных веществ.
Лучшими источниками белков растительного происхождения являются бобовые, орехи, семена и зерновые продукты. Серьезный недостаток белка приводит к отекам и мышечной слабости, изменениям волос и кожи. Белковый дефицит часто возникает вместе с дефицитом энергии, обусловленным недостатком белков и других питательных веществ в результате общего дефицита питательных веществ.
Длительное питание продуктами с чрезмерным содержанием белка вредно, поскольку нагружает почки и печень, может вызвать подагру и повышает риск возникновения аллергии. Энергия, получаемая с белками, в долгосрочной перспективе не должна превышать 20 % суточной пищевой энергии.
Сколько аминокислот входят в конопляный протеин?
Знаете ли Вы – сколько всего существует аминокислот? А сколько их содержится в спортивном питании или конопляном протеине? Давайте разбираться вместе в этом вопросе.
Что такое аминокислоты?
Это в первую очередь «фундамент» для образования в нашем организме протеинов, гормонов, антител, белков в тканях, различных ферментов. Все белки – это соединённые в определённой последовательности цепочки из аминокислот. Если отсутствует одна аминокислота, то строительство молекулы белка становится попросту невозможным.
Все белки – это соединённые в определённой последовательности цепочки из аминокислот. Если отсутствует одна аминокислота, то строительство молекулы белка становится попросту невозможным.
Каково назначение этих элементов?
Аминокислоты в первую очередь обеспечивают функционирование практически всех систем в организме, угнетая или наоборот стимулируя все процессы жизнедеятельности:
— обогащают энергией, необходимой для мышечной ткани;
— обеспечивают правильную работу и функционирование нервной системы, являясь нейромедиаторами;
— активно участвуют в водно-солевом обмене.
Сколько всего их существует?
Известны около 500 встречающихся в природе аминокислот. Хотя только 20 используются в генетическом коде. В процессе биосинтеза белка в полипептидную цепь включаются 20 α-аминокислот, кодируемых генетическим кодом. Помимо этих аминокислот, называемых протеиногенными, или стандартными, в некоторых белках присутствуют специфические нестандартные аминокислоты, возникающие из стандартных в процессе посттрансляционных модификаций. В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые: селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
В последнее время к протеиногенным аминокислотам иногда причисляют трансляционно включаемые: селеноцистеин и пирролизин. Это так называемые 21-я и 22-я аминокислоты.
Все аминокислоты можно разделить на две группы:
1. Незаменимые – они поступают в наш организм исключительно с белковой пищей. Это следующие кислоты: гистидин, метионин, треонин, изолейцин, лейцин, фенилаланин, триптофан, валин.
2. Заменимые – они поступают в человеческий организм с белковой пищей или строятся из других аминокислот. В их число входят: аланин, глицин, аргинин, аспарагин, кислота аспарагиновая, цистеин, кислота глютаминовая, глютамин, пролин, серин, таурин, тирозин.
Где синтезируются аминокислоты?
Основная масса аминокислот в организме человека образуется в печени. Но к сожалению, стрессы, инфекции, старение и многие другие факторы, нарушают эти процессы, что ведёт к быстрому истощению организма и потере физической активности.
Именно поэтому нам необходимо употреблять в пищу продукты питания или добавки, которые содержат достаточное количество белка.
Сколько аминокислот содержится в конопляном протеине?
В конопляном белке «HempIn» присутствуют все аминокислоты, в том числе и незаменимые, в достаточном или более количествах и отсутствуют консерванты, подсластители и ароматизаторы.
Также данный продукт содержит исключительно полезные жирные полиненасыщенные кислоты омега-3, 6, 9. Все те, кто занимается спортом и заботится о своём здоровье, вынуждены приобретать отдельно как спортивное питание, так и эти жирные кислоты, и соблюдать правильное соотношение при их употреблении.
В HempIn данные жирные кислоты присутствуют в идеальной пропорции, благодаря природным свойствам сырья. То есть вы получаете полный набор незаменимых жирных кислот из природы, а также весь спектр аминокислот в натуральном виде всего лишь в одном продукте.
А что со спортивным питанием?
Современный рынок предлагает десятки разновидностей спортивного питания с разным содержанием аминокислот, от полного списка, до всего одной. Большинство видов спортивного питания представляют собой безобидный заменитель белковой пищи, однако многие содержат консерванты, подсластители, ароматизаторы в своём составе. Разный состав и принципы действия влияют на результат приёма добавок. Так что стоит хорошенько потрудится, чтоб подобрать себе оптимальное питание.
Большинство видов спортивного питания представляют собой безобидный заменитель белковой пищи, однако многие содержат консерванты, подсластители, ароматизаторы в своём составе. Разный состав и принципы действия влияют на результат приёма добавок. Так что стоит хорошенько потрудится, чтоб подобрать себе оптимальное питание.
Используемая литература в статье:
Research scientists: J.Agric. Food Chem. 2006, 54, 8945-8950.
«New Naturally Occurring Amino Acids». Angewandte Chemie International Edition in English 22 (11): 816-28. DOI:10.1002/anie.198308161.
Linda Johansson, Guro Gafvelin, Elias S.J. Arnér. Selenocysteine in proteins — properties and biotechnological use // Biochimica et Biophysica Acta (BBA) — General Subjects. — 2005-10. — Т. 1726, вып. 1. — С. 1-13. — ISSN 0304-4165. DOI:10.1016/j.bbagen.2005.05.010.
Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706-712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
6. — С. 706-712. — ISSN 1369-5274. — DOI:10.1016/j.mib.2005.10.009.
Alexandre Ambrogelly, Sotiria Palioura, Dieter Söll. Natural expansion of the genetic code // Nature Chemical Biology. — 2007-1. — Т. 3, вып. 1. — С. 29-35. — ISSN 1552-4450. — DOI:10.1038/nchembio847
Аспекты аминокислотного профиля белка | ТП Биотех2030
Автор: Архипов М. Ю., кандидат технических наук по специальности Биотехнология, ведущий специалист компании ООО «ФидИндастриз»
Идеальный аминокислотный профиль
Часто можно встретить словосочетание «идеальный белок». Под ним понимают белок, обладающий белок аминокислотным составом, идеально сбалансированным для роста и развития живого организма. На практике идеального белка с постоянным составом аминокислот не существует, т.к. соотношение аминокислот, требуемых для разных живых организмов, отличается и даже для одного и того же организма не постоянно, т.к. зависит от многих факторов: возраста и состояния организма, фазы его развития: формирование скелета, наращивание мышечной массы и др.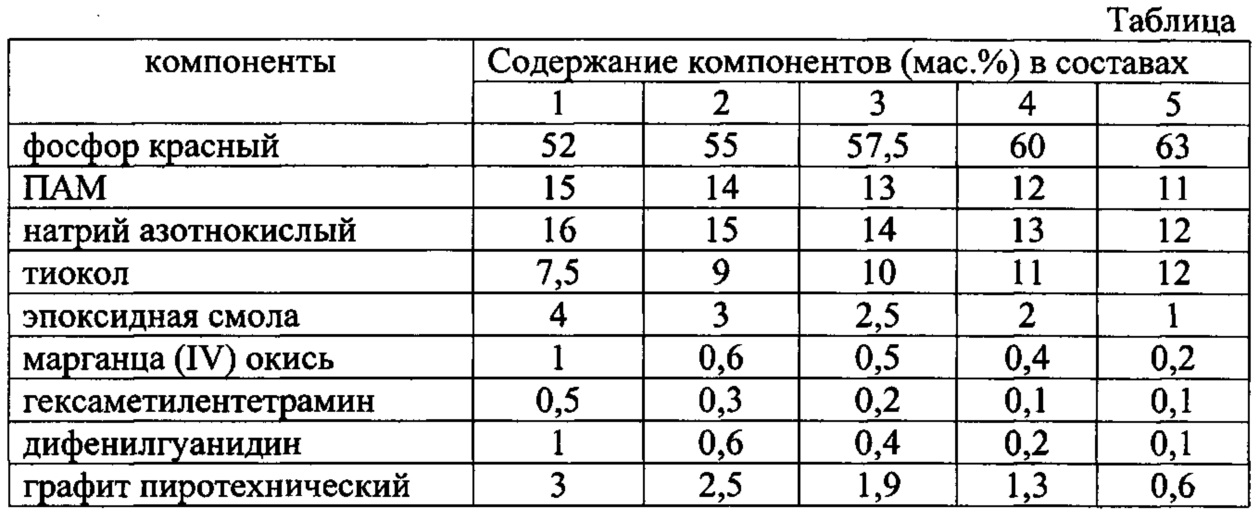 А что же такое тогда такое «идеальный белок» и зачем нужно это понятие?
А что же такое тогда такое «идеальный белок» и зачем нужно это понятие?
Не все аминокислоты одинаково усваиваются, недостаток одних ограничивает усваивание других. Для понимания данной ситуации существует закон Либиха, иллюстрирующий как влияет лимитирующая аминокислота. Согласно закону белок можно представить в виде бочки, сбитой из досок, если одна доска короче остальных, то вода будет уходить через неё. Доски – это аминокислоты, а самая короткая – это лимитрирующая, она будет понижать ценность всего продукта, а избыточные аминокислоты будут выведены из организма.
Попробуем проанализировать аминокислотные профили нескольких белков считающихся идеальными для разных животных разных возрастных групп.
Можно заметить, что при разнообразии кривых идеальных белков, прослеживается общий характер кривой, т.к. существует общая закономерность соотношения аминокислот, следовательно, можно построить аппроксимирующую кривую обобщённого Идеального белка.
Наложив на данную кривую аминокислотные профили любого белка можно судить об оптимальности его по отклонению от этого аппроксимированного профиля «идеального» белка, считая её бочкой Либиха. А существует ли в природе белковая добавка с идеальным аминокислотным профилем?
А существует ли в природе белковая добавка с идеальным аминокислотным профилем?
Виды источников кормового белка
Как известно источники белка могут быть классифицированы по происхождению на 3 основные группы: животные, растительные, микробные. Иногда ещё добавляют две дополнительные группы: белки синтетического происхождения и белки насекомых, но они мало распространены.
Для каждой группы белков по происхождению характерен разный аминокислотный профиль.
Широко известно, что основной аминокислотой является лизин. Она является основным лимитирующим фактором в бочке Либиха. Если белок не содержит лизина, то ценность такого продукта низкая. Лидером в плане обеспеченности лизином считается белок животного происхождения, однако надо учитывать, что и животный белок может быть совершенно разным по АК профилю. Давайте посмотрим какой он бывает.
Ближе всего к идеальному белку по АК профилю располагается белок зародыша: яйцо, икра. В нём содержатся все аминокислоты в соответствии с потребностью универсального развития целостного живого организма.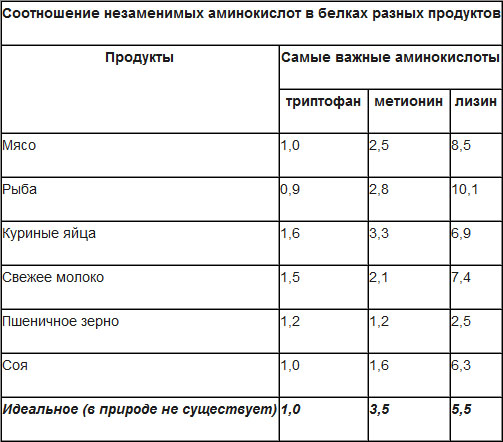 Такой белок оптимален для быстрого начального развития организма, но с его развитием потребность меняется. Поэтому его можно назвать базовым для развития всех живых организмов.
Такой белок оптимален для быстрого начального развития организма, но с его развитием потребность меняется. Поэтому его можно назвать базовым для развития всех живых организмов.
Из диаграммы видно, что АК профиль яичного белка вполне покрывает АК профиль идеального белка.
За ним идёт белок молока – это, прежде всего, казеин, содержание которого в коровьем молоке достигает 78-85%. Этот белок содержит полный набор незаменимых аминокислот, но имеет относительный провал по метионину и треонину.
К белкам животного происхождения также относятся другие белки, которые имеют аминокислотный профиль совсем далёкий от идеального. Они получены при переработке кожи, пуха, пера, костей и других отходов. В таких белках преобладают соединительные структурные белки – коллаген, эластин, кератин. Коллаген и эластин содержатся в коже, хрящах, костях, лёгких и кровеносных сосудах. Они содержат много глицина и пролина. В эластине больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. Кератин — это фибриллярный белок, обладающий высокой механической прочностью. В основном из него состоят волосы, ногти, рога, перья и клюв птиц и др.
Кератин — это фибриллярный белок, обладающий высокой механической прочностью. В основном из него состоят волосы, ногти, рога, перья и клюв птиц и др.
Как видно из диаграммы эти белки крайне бедны по основным незаменимым аминокислотам — лизину, метионину, гистидину, триптофану и далеко выпадают из профиля «идеального» белка. Гидролиз, ферментирование, концентрирование или изолирование таких белков не могут добавить им недостающих аминокислот, т.к. при дальнейшей переработке не меняется АК профиль.
Рыбная мука. АК профиль рыбной муки близок к профилю идеального белка, недостаток заметен только по метионину и фенилаланину. АК профиль рыбной муки также сильно колеблется, т.к. зависит из чего она сделана: из какой рыбы, из целой или из отходов, присутствия фальсифицирующих добавок.
Если же рыбная мука сделана из рыбных отходов, то аминокислотный профиль будет совсем иным – в нём будет провал по основным аминокислотам, в том числе лизину, из-за высокого содержания коллагенсодержащих вторичных рыбных ресурсов (головы, костей, плавников и др.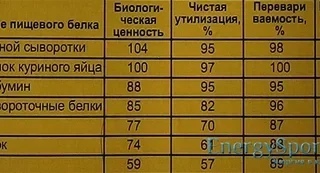 ).
).
Растительные белки. Растительные белки по сравнению с животными менее полноценны, так как они дефицитны по содержанию незаменимых аминокислот, прежде всего лизина и треонина.
Для белка пшеницы, кукурузы, также как и риса, пшена, подсолнечника первой лимитирующей аминокислотой является лизин, для бобовых — метионин. Среди растительных белков наиболее близка по АК профилю к идеальному соя, а все остальные культуры, включая горох, люпин, лён и другие уступают ей уступают, прежде всего, по содержанию лизина. Следует помнить, что аминокислотный профиль растительного белкового продукта будь это концентрат, гидролизат или изолят всегда сохраняет аминокислотный профиль исходного сырья, которое было использовано в производстве. Если же в готовом белковом продукте прослеживается значительное нарушение профиля, например завышенное содержание лизина, то это — фальсификат, в который добавляли синтетические аминокислоты или другие добавки. Такие добавки снижают питательность исходного природного белка и могут быть опасны, несмотря на более сбалансированный аминокислотный профиль.
Микробный белок. Микробный белок получают ферментаций микроорганизмов, целью которой является наработка биомассы. Обычно используют обычно дрожжи, как самый быстрорастущий м/о. В его биомассе накапливается обычно 45% белка. Аминокислотный профиль дрожжевого белка близок к идеальному, кроме содержания метионина.
Минусом такого дрожжевого белка является наличие у микроорганизмов клеточной стенки, которая сложно расщепляется ферментами живого организма.
Источник: http://soyanews.info/news/aspekty_aminokislotnogo_profilya_belka.html
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительным или отрицательным зарядом, тогда как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями. Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху — синий кружок; внизу — все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рис. 2. Структура белка бактериородопсина
2. Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Известные как альфа-спирали и бета-листов , эти стабильные паттерны сворачивания составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц. Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, которые растворены в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию находиться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не замораживаются. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Однако важно отметить, что полностью свернутые белки не замораживаются. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Хотя белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография . С помощью этого метода твердые кристаллы очищенного белка помещают в пучок рентгеновских лучей, а диаграмма отклоненных рентгеновских лучей используется для предсказания положений тысяч атомов в кристалле белка.
белков | Определение, структура и классификация
Белок , очень сложное вещество, которое присутствует во всех живых организмах.Белки имеют большую питательную ценность и непосредственно участвуют в химических процессах, необходимых для жизни. Важность белков была признана химиками в начале 19 века, в том числе шведским химиком Йенсом Якобом Берцелиусом, который в 1838 году ввел в обращение термин белок , слово, производное от греческого prōteios , что означает «удерживать первое место». Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Белки видоспецифичны; то есть белки одного вида отличаются от белков другого вида. Они также специфичны для органов; например, в пределах одного организма мышечные белки отличаются от белков мозга и печени.
Популярные вопросы
Что такое белок?
Белок — это встречающееся в природе чрезвычайно сложное вещество, состоящее из аминокислотных остатков, соединенных пептидными связями. Белки присутствуют во всех живых организмах и включают многие важные биологические соединения, такие как ферменты, гормоны и антитела.
Где происходит синтез белка?
Где хранится белок?
Белки не хранятся для дальнейшего использования в животных. Когда животное потребляет избыток белков, они превращаются в жиры (глюкозу или триглицериды) и используются для снабжения энергией или создания энергетических запасов.Если животное не потребляет достаточное количество белка, организм начинает разрушать богатые белком ткани, такие как мышцы, что приводит к истощению мышц и, в конечном итоге, к смерти, если дефицит является серьезным.
Что делают белки?
Белки необходимы для жизни и необходимы для широкого спектра клеточной деятельности. Белковые ферменты катализируют подавляющее большинство химических реакций, происходящих в клетке. Белки обеспечивают многие структурные элементы клетки и помогают связывать клетки вместе в ткани.Белки в форме антител защищают животных от болезней, и многие гормоны являются белками. Белки контролируют активность генов и регулируют экспрессию генов.
Белковая молекула очень велика по сравнению с молекулами сахара или соли и состоит из множества аминокислот, соединенных вместе, образуя длинные цепи, подобно тому, как бусинки расположены на нитке. Существует около 20 различных аминокислот, которые естественным образом встречаются в белках. Белки с аналогичной функцией имеют сходный аминокислотный состав и последовательность.Хотя пока невозможно объяснить все функции белка на основе его аминокислотной последовательности, установленные корреляции между структурой и функцией можно отнести к свойствам аминокислот, из которых состоят белки.
Молекулярная структура пептида (небольшого белка) состоит из последовательности аминокислот.
© raimund14 / Fotolia Растения могут синтезировать все аминокислоты; животные не могут, хотя все они необходимы для жизни.Растения могут расти в среде, содержащей неорганические питательные вещества, обеспечивающие азот, калий и другие вещества, необходимые для роста. В процессе фотосинтеза они используют углекислый газ, содержащийся в воздухе, для образования органических соединений, таких как углеводы. Однако животные должны получать органические питательные вещества из внешних источников. Поскольку содержание белка в большинстве растений низкое, очень большое количество растительного материала требуется животным, таким как жвачные животные (например, коровы), которые едят только растительный материал для удовлетворения своих потребностей в аминокислотах.Нежвачные животные, в том числе люди, получают белки в основном от животных и их продуктов, например мяса, молока и яиц. Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
Семена бобовых все чаще используются для приготовления недорогой, богатой белком пищи ( см. питание человека).
Бобовые, такие как фасоль, чечевица и горох, богаты белком и содержат много незаменимых аминокислот.
© Elenathewise / FotoliaСодержание белка в органах животных обычно намного выше, чем в плазме крови.Например, в мышцах содержится около 30 процентов белка, в печени — от 20 до 30 процентов, а в красных кровяных тельцах — 30 процентов. Более высокий процент белка содержится в волосах, костях и других органах и тканях с низким содержанием воды. Количество свободных аминокислот и пептидов у животных намного меньше количества белка; Белковые молекулы производятся в клетках путем поэтапного выравнивания аминокислот и попадают в жидкости организма только после завершения синтеза.
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту.Подпишись сейчас Высокое содержание белка в некоторых органах не означает, что важность белков связана с их количеством в организме или ткани; напротив, некоторые из наиболее важных белков, таких как ферменты и гормоны, встречаются в очень малых количествах. Важность белков в основном связана с их функцией. Все идентифицированные ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни, — белки, нуклеиновые кислоты, углеводы и липиды, — превращать их в другие вещества и разлагать их.Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Важность белков в основном связана с их функцией. Все идентифицированные ферменты являются белками. Ферменты, которые являются катализаторами всех метаболических реакций, позволяют организму накапливать химические вещества, необходимые для жизни, — белки, нуклеиновые кислоты, углеводы и липиды, — превращать их в другие вещества и разлагать их.Жизнь без ферментов невозможна. Есть несколько белковых гормонов с важными регуляторными функциями. У всех позвоночных респираторный белок гемоглобин действует как переносчик кислорода в крови, транспортируя кислород от легких к органам и тканям тела. Большая группа структурных белков поддерживает и защищает структуру тела животного.
Гемоглобин — это белок, состоящий из четырех полипептидных цепей (α 1 , α 2 , β 1 и β 2 ).Каждая цепь присоединена к группе гема, состоящей из порфирина (органическое кольцеобразное соединение), присоединенного к атому железа.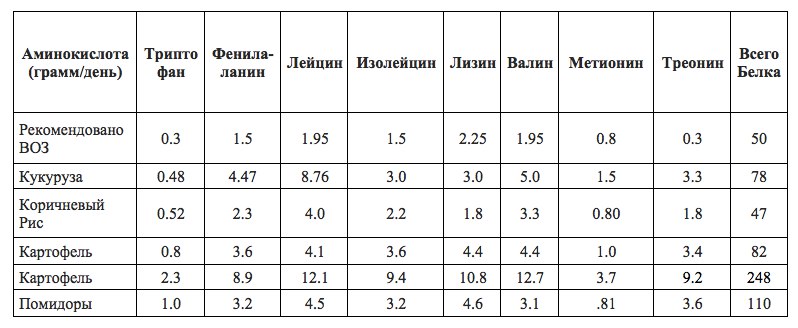 Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови.
Эти комплексы железо-порфирин обратимо координируют молекулы кислорода, что напрямую связано с ролью гемоглобина в переносе кислорода в крови.
Аминокислоты 101: строительные блоки белка
Хотя в природе существует более 80 аминокислот, только 20 из них объединяются, чтобы создать различные белки в организме человека.Девять из них называются «незаменимыми аминокислотами», что означает, что они должны быть получены с пищей. Незаменимыми аминокислотами являются изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Гистидин считается частично незаменимым, потому что нам нужно получать его только из пищевых источников в младенчестве. Наше тело производит другие 11, называемые «незаменимыми аминокислотами»: аргинин, аланин, аспарагин, аспарагиновая кислота, цистеин, глутамин, глутаминовая кислота, глицин, пролин, серин и тирозин.
«Аминокислоты соединяются вместе, образуя соединение, называемое полипептидами. Длинные цепи полипептидов приводят к образованию белков», — объясняет Самер Кутуби, доктор медицинских наук, профессор кафедры питания и физических упражнений Университета Бастира в Вашингтоне. Когда мы едим белок, он расщепляется на отдельные аминокислоты, а затем снова превращается в белки в организме. Чтобы прояснить, как соединяются отдельные аминокислоты, Нельда Мерсер, лицензированный диетолог и представитель Американской диетической ассоциации, сравнивает их со строительными блоками языка.«Различные комбинации аминокислот создают разные виды белка», — говорит она. «Это похоже на то, как можно составить много разных слов, используя 26 букв алфавита».
Длинные цепи полипептидов приводят к образованию белков», — объясняет Самер Кутуби, доктор медицинских наук, профессор кафедры питания и физических упражнений Университета Бастира в Вашингтоне. Когда мы едим белок, он расщепляется на отдельные аминокислоты, а затем снова превращается в белки в организме. Чтобы прояснить, как соединяются отдельные аминокислоты, Нельда Мерсер, лицензированный диетолог и представитель Американской диетической ассоциации, сравнивает их со строительными блоками языка.«Различные комбинации аминокислот создают разные виды белка», — говорит она. «Это похоже на то, как можно составить много разных слов, используя 26 букв алфавита».
Белки, которые образуют аминокислоты, играют важную роль в организме человека. Помимо множества функций, белок используется для построения и восстановления клеток, выработки гормонов и ферментов, регулирования жидкости, выработки антител и обеспечения энергией. «Каждый белок имеет цель и функцию, чтобы сделать нас здоровыми», — говорит Мерсер.
Хотя аминокислоты присутствуют почти во всем, что мы едим, наиболее богатыми отдельными источниками аминокислот являются продукты животного происхождения, такие как мясо, яйца и молочные продукты. «Когда пищевой белок содержит все незаменимые аминокислоты в правильном соотношении для удовлетворения потребностей человека, мы называем это полноценным белком», — объясняет Кутуби.
Соя — это неживотная пища, которая также является полноценным белком. Но веганы, которые не любят сою, могут легко получить весь необходимый им белок.Когда-то считалось, что растительные продукты необходимо комбинировать в одном приеме пищи, чтобы воспроизвести полноценный белок, недавние исследования показывают, что простое употребление разнообразных продуктов обеспечит достаточное количество белка, даже без мяса или молочных продуктов. «Вам не нужно быть таким скрупулезным, как мы когда-то думали, — говорит Мерсер, — если у вас есть запас аминокислот в течение дня».
По словам Мерсера, если вы придерживаетесь здоровой и разнообразной диеты, вы сможете получать все необходимые аминокислоты. «В Соединенных Штатах в нашей культуре будет очень редко, когда мы не получаем достаточного количества белка в нашем рационе. Если вы получаете достаточно калорий, вы получаете достаточно белка», — говорит Мерсер, который не рекомендует принимать аминокислотные добавки.
«В Соединенных Штатах в нашей культуре будет очень редко, когда мы не получаем достаточного количества белка в нашем рационе. Если вы получаете достаточно калорий, вы получаете достаточно белка», — говорит Мерсер, который не рекомендует принимать аминокислотные добавки.
По словам Мерсера, большинству людей требуется полграмма белка на килограмм тела в день, хотя есть и другие мнения о потреблении белка. Серьезным спортсменам может потребоваться больше, поскольку они тратят очень много энергии. Хотя нам нужен белок, чтобы выжить, употребление слишком большого количества белка может привести к увеличению веса, обезвоживанию, остеопорозу и проблемам с почками.
Однако некоторые специалисты в области здравоохранения говорят, что при некоторых распространенных заболеваниях необходимо добавлять аминокислоты. Дэвид Зейгер, доктор медицинских наук, медицинский директор Healthworks Integrative Health Clinic в Чикаго, говорит, что он часто прописывает своим пациентам аминокислотные добавки при различных состояниях, от стенокардии и диабета до депрессии и проблем роста. Зейгер говорит, что даже нормальные, здоровые взрослые люди могут извлечь выгоду из добавок глутатиона — комбинации цистеина, глицина и глутаминовой кислоты, которая помогает печени выводить токсины из организма.«Каждому человеку необходимы дополнительные аминокислоты в своем рационе, потому что сегодня мы постоянно подвергаемся воздействию токсинов, содержащихся в нашей пище и воде», — говорит он. Текущие исследования также изучают потенциальные преимущества глутатиона для пациентов, страдающих от рака, сердечных заболеваний и иммунодепрессии.
Зейгер говорит, что даже нормальные, здоровые взрослые люди могут извлечь выгоду из добавок глутатиона — комбинации цистеина, глицина и глутаминовой кислоты, которая помогает печени выводить токсины из организма.«Каждому человеку необходимы дополнительные аминокислоты в своем рационе, потому что сегодня мы постоянно подвергаемся воздействию токсинов, содержащихся в нашей пище и воде», — говорит он. Текущие исследования также изучают потенциальные преимущества глутатиона для пациентов, страдающих от рака, сердечных заболеваний и иммунодепрессии.
Однако Зейгер настоятельно предостерегает от самолечения. «Всегда полезно проконсультироваться с врачом, который разбирается в диетологии», — говорит он. «Если вы возьмете неправильную сумму, вы можете потерять выгоду.Или вы действительно можете навредить себе ». Аминокислоты следует принимать в сочетании друг с другом и в правильном соотношении. Несбалансированные аминокислотные добавки могут быть потенциально опасными, — говорит Зейгер, ссылаясь на пример лизина и аргинина. Соотношение, по его словам, две аминокислоты могут вызвать высыпания герпеса.
Соотношение, по его словам, две аминокислоты могут вызвать высыпания герпеса.
Дебаты по поводу аминокислотных добавок привлекли много внимания в последние годы, потому что многие спортсмены ищут аминокислоты для повышения своей производительности.По словам Зейгера, есть доказательства того, что прием нескольких граммов аминокислот в день действительно может стимулировать эндокринную систему к выработке большего количества гормона роста, что, в свою очередь, может помочь нарастить мышцы. Но Зейгер говорит, что неправильное самолечение аминокислот в спортивном сообществе является обычным явлением и может вызвать такие состояния, как обезвоживание, гигантизм, бесплодие и гиперактивность. Были некоторые анекдотические доказательства того, что прием большого количества аминокислот или производных аминокислот, таких как креатин, может вызвать спазмы желудка и диарею.И многие диетологи, в том числе Мерсер, говорят, что исследований, показывающих, что аминокислоты могут улучшить спортивные результаты, просто недостаточно, чтобы оправдать потенциально опасный дисбаланс в организме, который может вызвать этот вид добавок.
Аминокислота как натуральное средство
По словам Самера Кутуби, доктора медицины, доктора философии, доцента Бастирского университета, аминокислоты можно использовать для лечения множества заболеваний. Он рекомендует розничным торговцам напоминать потребителям, чтобы они работали с квалифицированным практикующим врачом, если они хотят исследовать эти способы использования.
- Аланин, глицин и глутаминовая кислота: доброкачественная гипертрофия простаты
- Аргинин: заживление ран, бесплодие, профилактика сердечного приступа и инсульта, гипертония и хроническая усталость, особенно мышечная усталость с миалгией
- Карнитин: болезни сердца, миопатия, гиперлипидемии и алкоголизм
- Цистеин, N-ацетилцистеин (NAC) или глутатион: непереносимость ксенобиотиков, нарушения детоксикации, расстройства, связанные со свободными радикалами, легочные состояния и СПИД
- Глютамин: восстановление желудочно-кишечного тракта, полное парентеральное питание, нарушения истощения, иммунная поддержка, побочные эффекты химиотерапии, хирургия, ожоги и алкоголизм
- Глицин: Нарушения детоксикации и заживление ран
- Гистидин: ревматоидный артрит ,00
- Лейцин, изолейцин и валин: алкоголизм, хирургия, голодание, инфекции, наращивание мышечной массы и полное парентеральное питание
- Лизин: Простой герпес (HSV-1, HSV-2) ,00
- Фенилаланин, тирозин: депрессия и болезнь Паркинсона
- S-аденозилметионин (SAM): депрессия, остеоартрит, фибромиалгия и заболевания печени
- Таурин: непереносимость хлора, гипохлорита (отбеливателя), фенолов, нитритов, аминов или альдегидов, мальабсорбция жира при муковисцидозе, судороги, заболевания глаз, заболевания желчного пузыря, болезни сердца и алкоголизм
- Триптофан: бессонница, депрессия, синдром беспокойных ног, алкоголизм, контроль веса и болезнь Паркинсона
—О. H-K.
H-K.
Другое использование аминокислот
У аминокислот также есть несколько применений, не связанных со здоровьем. Спорная пищевая добавка, например, глутамат натрия, содержит глутаминовую кислоту; несахарный подсластитель, аспартам (Equal), получают из аспарагиновой кислоты и фенилалалина; и коллаген, ингредиент для ухода за кожей, разглаживающий морщины, состоит из нескольких различных аминокислот, а также естественным образом вырабатывается в организме.
—О.Х.-К.
Мерчендайзер Natural Foods том XXVI / номер 3 / стр.94, 96
аминокислот | Биология для майоров I
Результаты обучения
- Продемонстрировать знакомство с мономерными единицами белков: аминокислоты
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот и , расположенных в линейной последовательности.
Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами.Каждая клетка живой системы может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот и , расположенных в линейной последовательности.
Рис. 1. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. .Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
1).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильно-кислотную группу в своей основной структуре. Как уже упоминалось, в белках присутствует 20 аминокислот. Девять из них считаются незаменимыми аминокислотами у человека, потому что человеческий организм не может их производить, и они получают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практический вопрос
Рис. 2. В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою R-группу (вариантная группа), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Показать ответ Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например. g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры аминокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, и у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты необходимы, варьируется от организма к организму.
Рис. 3. Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
При этом выделяется молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь является пептидной связью (рис. 3).
Продукты, образованные такими связями, называются пептидами. Чем больше аминокислот присоединяется к этой растущей цепи, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически является полимером аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
, и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, а центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты.Для каждой молекулы цитохрома с из разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. При сравнении последовательностей человека и макаки-резуса единственное различие было обнаружено в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Внесите свой вклад!
У вас была идея улучшить этот контент? Нам очень понравится ваш вклад.
Улучшить эту страницуПодробнее
Аминокислота — Энциклопедия Нового Света
Общее строение молекулы аминокислоты. Аминогруппа слева, а группа карбоновой кислоты справа. Группа R уникальна для каждой аминокислоты. Аминокислота — это органическая молекула с тремя основными компонентами: аминогруппой (-Nh3), группой карбоновой кислоты (-COOH) и группой R или боковой цепью, уникальной для каждой аминокислоты.
Аминокислоты являются основными структурными строительными блоками белков. Подобно тому, как буквы алфавита можно комбинировать по-разному, чтобы образовать бесконечное множество слов, ограниченное количество аминокислот может быть соединено вместе в различных последовательностях, чтобы сформировать обширный массив белков. Уникальная трехмерная форма каждого белка, которая является результатом линейной последовательности аминокислот, определяет конкретную функцию белка в организме.
Растения синтезируют необходимые им аминокислоты, используя углерод и кислород из воздуха, водород из воды и азот, который был преобразован в пригодную для использования форму посредством фиксации азота.Животные могут синтезировать определенные аминокислоты. Те важные аминокислоты, которые не могут быть синтезированы животным или со скоростью, достаточной для удовлетворения его физиологических потребностей, и которые, следовательно, должны быть получены с пищей, называются незаменимыми аминокислотами .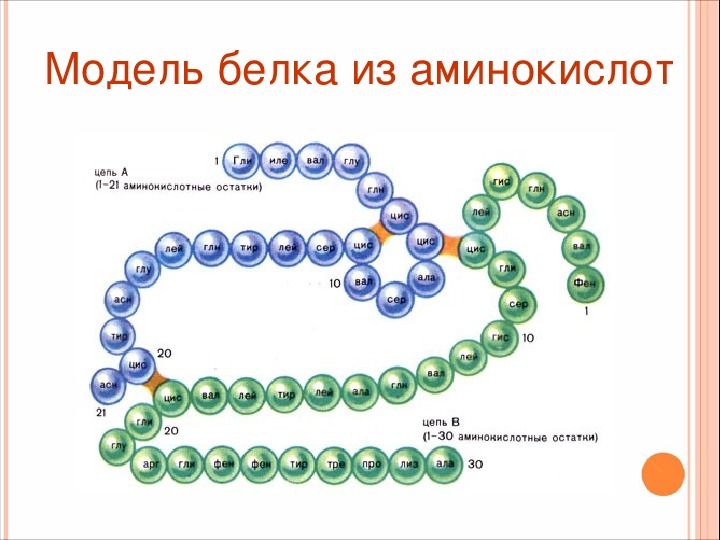 Незаменимые аминокислоты различаются в зависимости от типа животного. Хотя всем позвоночным необходимы определенные аминокислоты, которые их клетки не могут синтезировать, жвачные животные (например, крупный рогатый скот) несут в одном из желудков микробы, которые синтезируют аминокислоты, необходимые животным.Аминокислоты отражают взаимосвязь жизни, так как нежвачные животные зависят от растений для получения незаменимых аминокислот, жвачные животные зависят от микробов в качестве источника, и даже растения зависят от бактерий, которые фиксируют азот в форме, которую они могут использовать для производства аминокислоты.
Незаменимые аминокислоты различаются в зависимости от типа животного. Хотя всем позвоночным необходимы определенные аминокислоты, которые их клетки не могут синтезировать, жвачные животные (например, крупный рогатый скот) несут в одном из желудков микробы, которые синтезируют аминокислоты, необходимые животным.Аминокислоты отражают взаимосвязь жизни, так как нежвачные животные зависят от растений для получения незаменимых аминокислот, жвачные животные зависят от микробов в качестве источника, и даже растения зависят от бактерий, которые фиксируют азот в форме, которую они могут использовать для производства аминокислоты.
Хотя в природе существует более 100 аминокислот, человеческому организму для нормального функционирования требуется 20 аминокислот, называемых стандартных аминокислот . Примерно половина этих стандартных аминокислот считаются незаменимыми аминокислотами, которые не могут быть синтезированы и должны быть получены с пищей.
Источники аминокислот
Стандартные аминокислоты
У человека 20 аминокислот известны как стандартные аминокислоты или протеиногенные аминокислоты. Как следует из названия «протеиногенный» (буквально , строящий белок, ), эти аминокислоты кодируются стандартным генетическим кодом и участвуют в процессе синтеза белка. Они образуются из матрицы мРНК в процессе, называемом трансляцией, посредством которого генетическая информация, закодированная в форме нуклеиновых кислот, транслируется в аминокислоты, необходимые для синтеза белка.Комбинации этих аминокислот производят каждый отдельный белок, необходимый для гомеостаза (то есть поддержания стабильной внутренней среды) человеческого тела.
Как следует из названия «протеиногенный» (буквально , строящий белок, ), эти аминокислоты кодируются стандартным генетическим кодом и участвуют в процессе синтеза белка. Они образуются из матрицы мРНК в процессе, называемом трансляцией, посредством которого генетическая информация, закодированная в форме нуклеиновых кислот, транслируется в аминокислоты, необходимые для синтеза белка.Комбинации этих аминокислот производят каждый отдельный белок, необходимый для гомеостаза (то есть поддержания стабильной внутренней среды) человеческого тела.
Химические структуры 20 стандартных аминокислот.
Из этих 20, 19 встречаются в природе как оптически активные левосторонние молекулы из-за асимметричного центрального атома углерода, а одна (глицин) оптически нейтральна. Стандартные аминокислоты, таким образом, демонстрируют образец 1 + 19. Этот образец 1 + 19 также встречается в ядерной химии, описывая двадцать элементов, которые встречаются как «чистые изотопы»; один элемент (бериллий) имеет четный атомный номер 4, а остальные девятнадцать элементов (F, Na, Al, P, Sc, Mn, Co, As, Y, Nb, Rh, I, Cs, Pr, Tb, Ho, Tm, Au, Bi) имеют нечетные атомные номера. Такой же паттерн 1 + 19 встречается среди двадцати элементов, которые встречаются в виде двух стабильных изотопов. Соответствие узоров на разных уровнях природы — одна из неразгаданных загадок науки. [1]
Такой же паттерн 1 + 19 встречается среди двадцати элементов, которые встречаются в виде двух стабильных изотопов. Соответствие узоров на разных уровнях природы — одна из неразгаданных загадок науки. [1]
Незаменимые аминокислоты
Примерно половина из 20 стандартных аминокислот называется незаменимыми аминокислотами, потому что они не могут быть синтезированы человеческим организмом из других соединений посредством химических реакций; вместо этого их нужно принимать с пищей. У человека незаменимыми аминокислотами являются лизин , изолейцин , фенилаланин , лейцин , метионин , триптофан , треонин и валин . Аргинин и гистидин также можно классифицировать как незаменимые аминокислоты, хотя обычно они считаются незаменимыми только для детей, чей неразвитый метаболизм не может их синтезировать. Таким образом, количество незаменимых аминокислот в организме человека по-разному перечисляется как 8 или 10.
Остальные стандартные аминокислоты несущественны; хотя они могут быть получены из пищи, организм также может синтезировать их по мере необходимости.
Нестандартные аминокислоты
Помимо 20 стандартных аминокислот и двух специальных аминокислот, селеноцистеина и пирролизина, которые кодируются ДНК нетипичным образом, существует большое количество нестандартных или непротеиногенных аминокислот .Последние либо не встречаются в белках (таких как аминокислоты карнитин, ГАМК или L-ДОПА), либо они не кодируются стандартным генетическим кодом (например, гидроксипролин и селенометионин), но могут быть результатом модификации стандартных аминокислоты после того, как белок был сформирован на стадии трансляции синтеза белка.
Некоторые из этих нестандартных аминокислот были обнаружены в метеоритах, особенно в типе, известном как углеродистые хондриты, состав которых считается типичным для солнечной туманности или газового облака, из которого образовалась солнечная система. Например, более 79 аминокислот были обнаружены в примитивном метеорите Мерчисон, разновидности углеродистого хондрита. Микроорганизмы и растения также могут продуцировать необычные аминокислоты, которые можно найти в пептидных антибиотиках, таких как низин, который используется в качестве пищевого консерванта.
Например, более 79 аминокислот были обнаружены в примитивном метеорите Мерчисон, разновидности углеродистого хондрита. Микроорганизмы и растения также могут продуцировать необычные аминокислоты, которые можно найти в пептидных антибиотиках, таких как низин, который используется в качестве пищевого консерванта.
Строение аминокислот
В биохимии термин «аминокислота» часто используется для обозначения альфа-аминокислот : тех аминокислот, в которых амино- и карбоксилатные группы присоединены к одному и тому же углероду, так называемому альфа-углероду (альфа-углерод ).Общая структура этих протеиногенных альфа-аминокислот:
R
|
H 2 N-C-COOH
|
ЧАС
, где R представляет собой боковую цепь , специфичную для каждой аминокислоты. Исключением из этой базовой структуры является пролин, боковая цепь которого циклизуется на основной цепи, образуя кольцевую структуру, в которой вторичная аминогруппа заменяет первичную аминогруппу.
Когда аминокислоты соединяются, образуя белки, основная аминогруппа и кислая карбоксильная группа нейтрализуются.Вместо этого боковые цепи аминокислот определяют кислотно-основные свойства белков. Таким образом, аминокислоты обычно классифицируются по двум основным химическим свойствам боковой цепи: заряд группы R (который определяет, действует ли белок как слабая кислота или слабое основание) и его полярность (или склонность к взаимодействию с водой. при нейтральном pH).
Эти свойства влияют на взаимодействие аминокислот с другими структурами внутри белка, а также на их взаимодействие с другими белками.Например, растворимые белки имеют поверхность, богатую полярными аминокислотами, такими как серин и треонин. Напротив, интегральные мембранные белки имеют тенденцию иметь внешнее кольцо из гидрофобных аминокислот (которые, как правило, не взаимодействуют с водой), которые прикрепляют их к липидному бислою. Точно так же белки, которые должны связываться с положительно заряженными молекулами, имеют поверхности, богатые отрицательно заряженными аминокислотами, такими как глутамат и аспартат, в то время как белки, связывающиеся с отрицательно заряженными молекулами, имеют поверхности, богатые положительно заряженными цепями, такими как лизин и аргинин.
Изомеры
Большинство аминокислот встречается в виде двух возможных оптических изомеров, называемых D и L. L-аминокислоты представляют собой подавляющее большинство аминокислот, содержащихся в белках. D-аминокислоты содержатся в некоторых белках, вырабатываемых экзотическими морскими организмами, такими как шишки. Они также являются многочисленными компонентами протеогликанов клеточных стенок бактерий.
Функции аминокислот в синтезе белка
Резюме образования пептидной связи. Нажмите на изображение, чтобы увидеть реакцию. Две аминокислоты связаны между собой пептидной связью, которая образуется, когда основная аминогруппа одной аминокислоты реагирует с кислой карбоксильной группой второй аминокислоты. Эта реакция конденсации (потеря воды) дает пептидную связь и молекулу воды. Аминокислотный остаток — это то, что остается от аминокислоты после того, как молекула воды (H + со стороны аминогруппы и OH — со стороны карбоксильной группы) была потеряна при образовании пептида.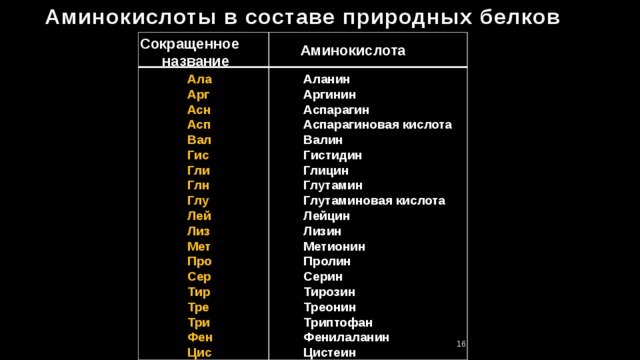 связь.
связь.
Белки затем создаются путем полимеризации аминокислот, процесса, в котором аминокислоты соединяются в цепочки, называемые, в зависимости от их длины, пептидами или полипептидами.
Другие биологические роли аминокислот
Помимо своей функции в образовании белков, аминокислоты играют и другие биологически важные роли. Стандартные аминокислоты глицин и глутамат, которые содержатся в белках, также действуют как нейротрансмиттеры, которые соответственно подавляют и усиливают сигналы в нервной системе.Нестандартная аминокислота карнитин используется для транспорта липидов внутри клетки.
Многие аминокислоты используются для синтеза молекул, отличных от белков:
- Триптофан — предшественник серотонина, нейромедиатора, важного для регуляции настроения.
- Глицин является одним из реагентов при синтезе порфиринов, таких как гем, который является компонентом молекул гемоглобина, обнаруженных в красных кровяных тельцах.
- Аргинин используется для синтеза гормона оксида азота.

Вещества, полученные из аминокислот, находят важное применение в медицине и пищевой промышленности; Например:
- Аспартам (аспартилфенилаланин-1-метиловый эфир) представляет собой искусственный подсластитель, а глутамат натрия — пищевая добавка, усиливающая вкус.
- 5-HTP (5-гидрокситриптофан) используется для лечения неврологических проблем, связанных с PKU (фенилкетонурия), а также депрессии (как альтернатива L-триптофану).
- L-ДОПА (L-дигидроксифенилаланин) — это лекарство, используемое для лечения симптомов болезни Паркинсона.
Таблица химических свойств
Ниже приводится таблица, в которой перечислены символы и химические свойства стандартных аминокислот. Указанная масса представляет собой средневзвешенное значение всех распространенных изотопов и включает массу H 2 О. Однобуквенный символ для неопределенной аминокислоты — X . Трехбуквенный символ Asx или однобуквенный символ B означает, что аминокислота представляет собой аспарагин или аспарагиновую кислоту, тогда как Glx или Z означает глутаминовую кислоту или глутамин. Трехбуквенный символ Sec или однобуквенный символ U относится к селеноцистеину. Буквы J и O не используются.
Трехбуквенный символ Sec или однобуквенный символ U относится к селеноцистеину. Буквы J и O не используются.
Незаменимые аминокислоты отмечены звездочкой.
| Сокр. | Полное имя | Тип боковой цепи | Масса | пИ | pK 1 (α-COOH) | pK 2 (α- + NH 3 ) | pKr (R) | Замечания | |
|---|---|---|---|---|---|---|---|---|---|
| А | Ала | Аланин | гидрофобный | 89.09 | 6,01 | 2,35 | 9,87 | Очень обильный и универсальный. Он ведет себя довольно нейтрально и может располагаться как в гидрофильных областях снаружи белка, так и в гидрофобных внутренних областях. | |
| С | Cys | Цистеин | гидрофобный (Nagano, 1999) | 121,16 | 5,05 | 1,92 | 10,70 | 8,18 | Атом серы легко связывается с ионами тяжелых металлов. В окислительных условиях два цистеина могут быть соединены дисульфидной связью с образованием аминокислоты цистина. Когда цистины являются компонентами белка, они усиливают третичную структуру и делают белок более устойчивым к разворачиванию и денатурации; поэтому дисульфидные мостики распространены в белках, которые должны функционировать в суровых условиях, пищеварительных ферментах (например, пепсине и химотрипсине), структурных белках (например, кератине) и белках, слишком малых для того, чтобы сохранять свою форму самостоятельно (например,инсулин). В окислительных условиях два цистеина могут быть соединены дисульфидной связью с образованием аминокислоты цистина. Когда цистины являются компонентами белка, они усиливают третичную структуру и делают белок более устойчивым к разворачиванию и денатурации; поэтому дисульфидные мостики распространены в белках, которые должны функционировать в суровых условиях, пищеварительных ферментах (например, пепсине и химотрипсине), структурных белках (например, кератине) и белках, слишком малых для того, чтобы сохранять свою форму самостоятельно (например,инсулин). |
| D | жерех | аспарагиновая кислота | кислый | 133,10 | 2,85 | 1,99 | 9,90 | 3,90 | Действует аналогично глутаминовой кислоте. Несет гидрофильную кислотную группу с сильным отрицательным зарядом. Обычно располагается на внешней поверхности белка, что делает его водорастворимым. Связывается с положительно заряженными молекулами и ионами, часто используется в ферментах для фиксации иона металла. |
| E | Glu | Глутаминовая кислота | кислый | 147.13 | 3,15 | 2,10 | 9,47 | 4,07 | Действует аналогично аспарагиновой кислоте. Имеет более длинную и чуть более гибкую боковую цепь. |
| * Ф | Phe | фенилаланин | гидрофобный | 165,19 | 5,49 | 2,20 | 9,31 | Фенилаланин, тирозин и триптофан содержат большую жесткую ароматическую группу на боковой цепи. Это самые большие аминокислоты.Подобно изолейцину, лейцину и валину, они гидрофобны и имеют тенденцию ориентироваться внутрь свернутой белковой молекулы. | |
| г | Gly | Глицин | гидрофобный | 75,07 | 6,06 | 2,35 | 9,78 | Из-за наличия двух атомов водорода у α-углерода глицин не является оптически активным. Это самая маленькая аминокислота, она легко вращается и добавляет гибкости белковой цепи.Он может поместиться в самые тесные пространства (например, тройная спираль коллагена). Это самая маленькая аминокислота, она легко вращается и добавляет гибкости белковой цепи.Он может поместиться в самые тесные пространства (например, тройная спираль коллагена). | |
| * В | Его | гистидин | базовый | 155,16 | 7,60 | 1,80 | 9,33 | 6,04 | Даже в слегка кислых условиях происходит протонирование азота, изменяющее свойства гистидина и полипептида в целом. Он используется многими белками как регуляторный механизм, изменяя конформацию и поведение полипептида в кислых областях, таких как поздняя эндосома или лизосома, вызывая изменение конформации ферментов. |
| * Я | Иль | Изолейцин | гидрофобный | 131,17 | 6,05 | 2,32 | 9,76 | Изолейцин, лейцин и валин имеют большие алифатические гидрофобные боковые цепи. Их молекулы жесткие, и их взаимные гидрофобные взаимодействия важны для правильной укладки белков, поскольку эти цепи имеют тенденцию располагаться внутри молекулы белка. | |
| * К | Lys | Лизин | базовый | 146.19 | 9,60 | 2,16 | 9,06 | 10,54 | Действует аналогично аргинину. Содержит длинную гибкую боковую цепь с положительно заряженным концом. Гибкость цепи делает лизин и аргинин подходящими для связывания с молекулами со многими отрицательными зарядами на их поверхности. (например, ДНК-связывающие белки имеют свои активные области, богатые аргинином и лизином.) Сильный заряд делает эти две аминокислоты склонными к расположению на внешних гидрофильных поверхностях белков. |
| * л | лей | лейцин | гидрофобный | 131,17 | 6,01 | 2,33 | 9,74 | Действует аналогично изолейцину и валину. См. Изолейцин. | |
| * М | Met | метионин | гидрофобный | 149,21 | 5,74 | 2,13 | 9,28 | Всегда первая аминокислота, которая включается в белок; иногда удаляется после перевода.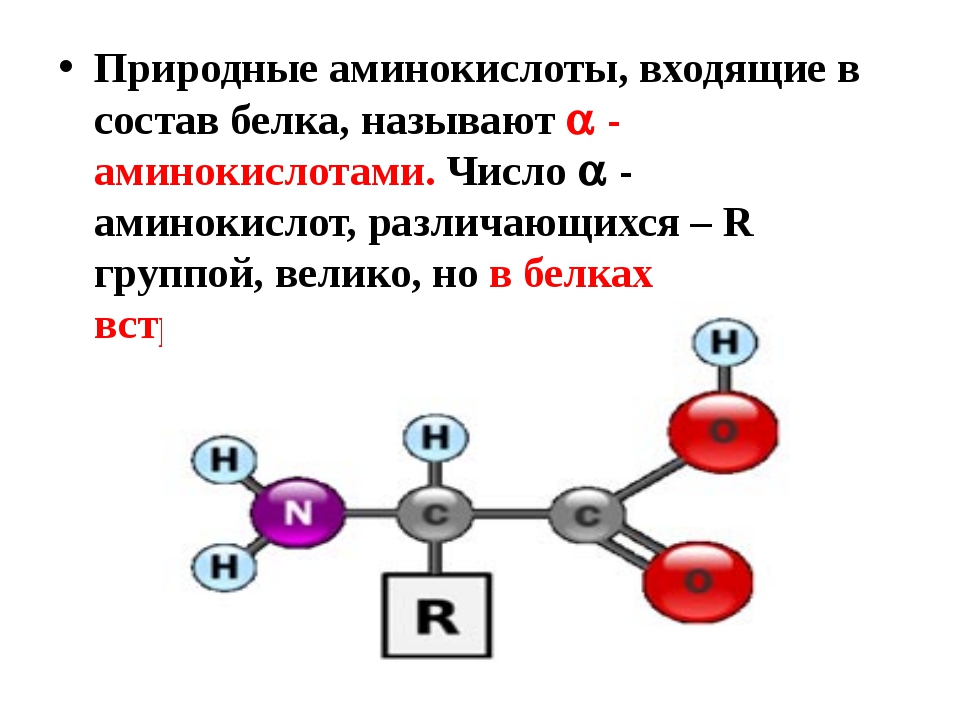 Как и цистеин, он содержит серу, но с метильной группой вместо водорода. Эта метильная группа может быть активирована и используется во многих реакциях, когда новый атом углерода добавляется к другой молекуле. Как и цистеин, он содержит серу, но с метильной группой вместо водорода. Эта метильная группа может быть активирована и используется во многих реакциях, когда новый атом углерода добавляется к другой молекуле. | |
| N | Asn | аспарагин | гидрофильный | 132,12 | 5,41 | 2,14 | 8,72 | Нейтрализованная версия аспарагиновой кислоты. | |
| П | Pro | пролин | гидрофобный | 115.13 | 6,30 | 1,95 | 10,64 | Содержит необычное кольцо для N-концевой аминогруппы, которое заставляет амидную последовательность CO-NH принимать фиксированную конформацию. Может нарушать структуры сворачивания белка, такие как α-спираль или β-лист, вызывая желаемый излом в белковой цепи. Обычен в коллагене, где он подвергается посттрансляционной модификации гидроксипролина. Необычный в других местах. | |
| Q | Gln | Глютамин | гидрофильный | 146.15 | 5,65 | 2,17 | 9,13 | Нейтрализованная версия глутаминовой кислоты. Используется в белках и как хранилище аммиака. | |
| * R | Arg | Аргинин | базовый | 174,20 | 10,76 | 1,82 | 8,99 | 12,48 | Функционально похож на лизин. |
| Ю | Ser | Серин | гидрофильный | 105.09 | 5,68 | 2,19 | 9,21 | Серин и треонин имеют короткую группу, оканчивающуюся гидроксильной группой. Его водород легко удалить, поэтому серин и треонин часто действуют как доноры водорода в ферментах. Оба они очень гидрофильны, поэтому внешние области растворимых белков, как правило, богаты ими. | |
| * т | Thr | Треонин | гидрофильный | 119,12 | 5. 60 60 | 2,09 | 9,10 | Действует аналогично серину. | |
| * В | Вал | Валин | гидрофобный | 117,15 | 6,00 | 2,39 | 9,74 | Действует аналогично изолейцину и лейцину. См. Изолейцин. | |
| * Вт | Trp | Триптофан | гидрофобный | 204,23 | 5.89 | 2,46 | 9,41 | Действует аналогично фенилаланину и тирозину (см. Фенилаланин). Предшественник серотонина. | |
| Y | Тюр | тирозин | гидрофобный | 181,19 | 5,64 | 2,20 | 9,21 | 10,46 | Действует аналогично фенилаланину и триптофану (см. Фенилаланин). Предшественник меланина, адреналина и гормонов щитовидной железы. |
Примечания
- ↑ Peter Plichta Plichta.
 Тайная формула Бога: расшифровка загадки Вселенной и простое число. Код . Shaftesbury: Element Books, 1997. ISBN 1862040141.
Тайная формула Бога: расшифровка загадки Вселенной и простое число. Код . Shaftesbury: Element Books, 1997. ISBN 1862040141.
Список литературы
- Дулиттл Р. Ф. 1989. Избыточность в белковых последовательностях. В Predictions of Protein Structure and the Principles of Protein Conformation , ed. Г.Д. Фасман, 599-623. Нью-Йорк, штат Нью-Йорк: Plenum Press.
- Нельсон Д.Л. и М. М. Кокс. 2000. Lehninger’s Principles of Biochemistry , 3rd edition. Нью-Йорк, штат Нью-Йорк: Издательство Worth.
- Naganoa, N., O. Motonori, and K. Nishikawa. 1999. Сильная гидрофобная природа остатков цистеина в белках. FEBS Letters 458 (1): 69-71. О гидрофобной природе цистеина.
Кредиты
Энциклопедия Нового Света Писатели и редакторы переписали и завершили статью Википедия в соответствии со стандартами New World Encyclopedia .Эта статья соответствует условиям лицензии Creative Commons CC-by-sa 3. 0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
0 (CC-by-sa), которая может использоваться и распространяться с указанием авторства. Кредит предоставляется в соответствии с условиями этой лицензии, которая может ссылаться как на участников New World Encyclopedia, , так и на самоотверженных добровольцев Фонда Викимедиа. Чтобы процитировать эту статью, щелкните здесь, чтобы просмотреть список допустимых форматов цитирования. История более ранних публикаций википедистов доступна исследователям здесь:
История этой статьи с момента ее импорта в New World Encyclopedia :
Примечание. Некоторые ограничения могут применяться к использованию отдельных изображений, на которые распространяется отдельная лицензия.
Глава 3. Белки и аминокислоты
Глава 3. Белки и аминокислоты1. БЕЛКИ
2. ПИЩЕВАРЕНИЕ БЕЛКОВ И МЕТАБОЛИЗМ
3. ОБЩИЕ ТРЕБОВАНИЯ К БЕЛКАМ
4. АМИНОКИСЛОТЫ
5. КОЛИЧЕСТВО ТРЕБОВАНИЯ К АМИНОКИСЛОТЕ
6.ДОБАВКА ДИЕТЫ С АМИНОКИСЛОТАМИ
7. ССЫЛКИ
Дж. Э. Халвер
Вашингтонский университет
Сиэтл, Вашингтон
1.1 Классификация
1.2 Структура
1.3 Свойства
1.4 Химическое определение
Белки представляют собой сложные органические соединения, состоящие из многих аминокислот, связанных вместе пептидными связями и поперечно связанных цепей сульфгидрильными связями, водородными связями и силами Ван-дер-Ваальса. Химический состав белков больше, чем у любой другой группы биологически активных соединений. Белки в различных клетках животных и растений придают этим тканям их биологическую специфичность.
1.1 Классификация
Белки можно разделить на:
(а) Простые белки. При гидролизе они дают только аминокислоты и иногда небольшие углеводные соединения. Примеры: альбумины, глобулины, глютелины, альбуминоиды, гистоны и протамины.(б) Конъюгированные белки. Это простые белки в сочетании с некоторым небелковым материалом в организме. Примеры: нуклеопротеины, гликопротеины, фосфопротеины, гемоглобины и лецитопротеины.
(c) Производные белки. Это белки, полученные из простых или конъюгированных белков физическими или химическими способами. Примеры: денатурированные белки и пептиды.
1,2 Конструкция
Потенциальная конфигурация белковых молекул настолько сложна, что многие типы белковых молекул могут быть сконструированы и обнаружены в биологических материалах с различными физическими характеристиками. Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами.Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки содержатся в волосах, мышцах и соединительной ткани. Кристаллические белки представлены хрусталиком глаза и подобными тканями. Ферменты — это белки со специфическими химическими функциями, которые опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролируя различные химические или физиологические процессы. Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролируя различные химические или физиологические процессы. Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
1.3 Недвижимость
Белки также можно охарактеризовать по их химическим реакциям. Большинство белков растворимы в воде, спирте, разбавленной основе или в различных концентрациях солевых растворов. Белки имеют характерную спиральную структуру, которая определяется последовательностью аминокислот в первичной полипептидной цепи и стереофонической конфигурацией радикальных групп, присоединенных к альфа-углероду каждой аминокислоты. Белки термолабильны, проявляя различную степень лабильности в зависимости от типа белка, раствора и температурного профиля.Белки могут быть обратимыми или необратимыми, денатурированными при нагревании, концентрации соли, замораживании, ультразвуковой нагрузке или старении. Белки подвергаются характерному связыванию с другими белками в так называемой пластеиновой реакции и соединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
1.4 Химическое определение
Содержание азота в большинстве белков животных, орехов и зерновых тканей составляет около 16 процентов; поэтому содержание белка обычно выражается как содержание азота × 6.25.
Проглоченные белки сначала расщепляются на более мелкие фрагменты пепсином в желудке или трипсином или химотрипсином из поджелудочной железы. Эти пептиды затем дополнительно восстанавливаются под действием карбоксипептидазы, которая гидролизует одну аминокислоту за раз, начиная со свободного карбоксильного конца молекулы, или с помощью аминопептидазы, которая отщепляет одну аминокислоту за раз, начиная со свободного амино-конца полипептида. цепь. Свободные аминокислоты, высвобождаемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем повторно синтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
Валовая потребность в белке была определена для нескольких видов рыб (см.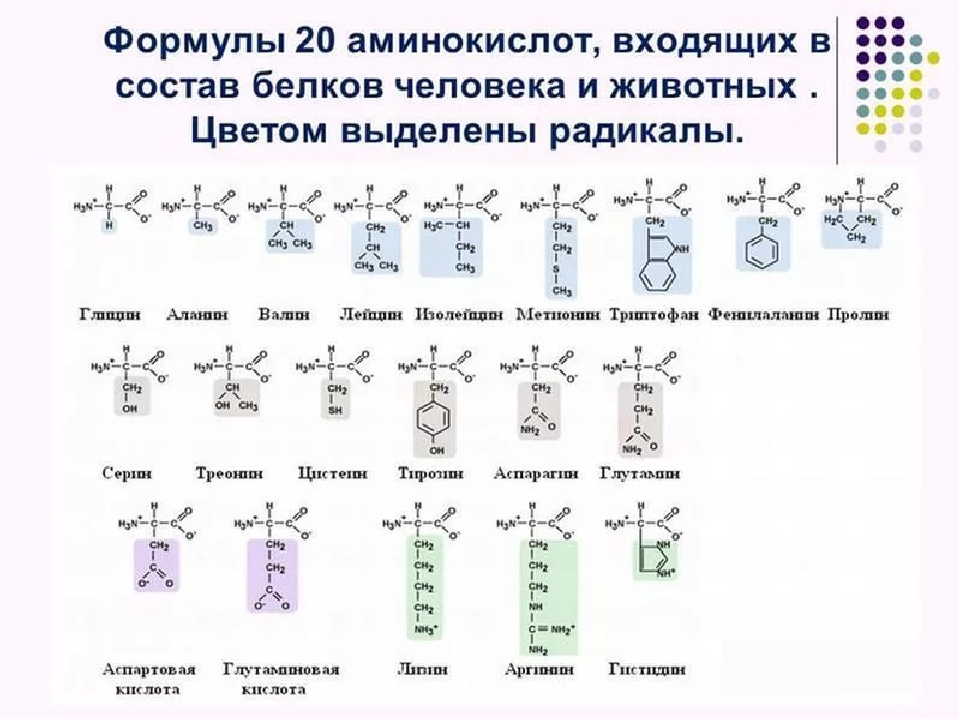 Таблицу 1). Имитация цельного яичного белка в тестовых диетах содержит избыток незаменимых аминокислот. Эти диеты поддерживались приблизительно изокалорийными за счет корректировки общего белка плюс усвояемые углеводные компоненты до фиксированного количества, поскольку лечение белковыми диетами варьировалось в испытанных диапазонах. Испытания на кормлении мальков, сеголетков и годовалых рыб показали, что общие потребности в белке являются самыми высокими у начальных кормовых мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, мальки должны иметь диету, в которой почти половина легкоусвояемых ингредиентов состоит из сбалансированного белка; через 6-8 недель это требование снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET). См. Рисунки 1 и 2. Общие потребности в белке молоди сома ниже, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и эта потребность уменьшается с увеличением размера.
Таблицу 1). Имитация цельного яичного белка в тестовых диетах содержит избыток незаменимых аминокислот. Эти диеты поддерживались приблизительно изокалорийными за счет корректировки общего белка плюс усвояемые углеводные компоненты до фиксированного количества, поскольку лечение белковыми диетами варьировалось в испытанных диапазонах. Испытания на кормлении мальков, сеголетков и годовалых рыб показали, что общие потребности в белке являются самыми высокими у начальных кормовых мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, мальки должны иметь диету, в которой почти половина легкоусвояемых ингредиентов состоит из сбалансированного белка; через 6-8 недель это требование снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET). См. Рисунки 1 и 2. Общие потребности в белке молоди сома ниже, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и эта потребность уменьшается с увеличением размера.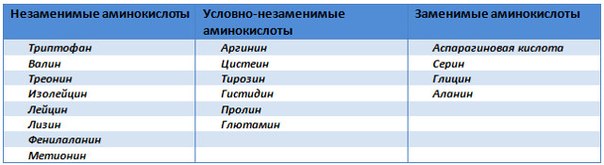 Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через ткань жабр непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой. Усвояемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяются потребности в белке для максимального роста (рисунки 1 и 2).
Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через ткань жабр непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой. Усвояемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяются потребности в белке для максимального роста (рисунки 1 и 2).
Таблица 1 — Расчетная потребность в белках некоторых видов рыб 1/
Виды | Уровень сырого протеина в рационе для оптимального роста (г / кг) |
Форель радужная ( Salmo gairdneri ) | 400-460 |
Карп ( Cyprinus carpio ) | 380 |
Чавыча ( Oncorhynchus tshawytscha ) | 400 |
Угорь ( Ангилья японский ) | 445 |
Камбала ( Pleuronectes platessa ) | 500 |
Золотистый лещ ( Chrysophrys aurata ) | 400 |
Белый амур ( Ctenopharyngodon idella ) | 410-430 |
Brycon sp. | 356 |
Морской лещ ( Chrysophrys major ) | 550 |
Желтохвост ( Seriola quinqueradiata ) | 550 |
1/ По материалам C.B. Cowey, 1978
Рис. 1. Потребность в белке чавычи при 47 ° F. Верхняя кривая: начальный индивидуальный средний вес рыбы, 1.5г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,6 г.
Рис. 2. Потребность в белке чавычи при температуре 58 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы 2,6 г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,8 г.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr ., 65: 589-99)
Обычно рыбе нужно давать диету, содержащую дифференцированные уровни высококачественного белка и энергии и адекватный баланс незаменимых жирных кислот, витаминов и минералов в течение длительного периода времени.Из полученной кривой доза / ответ потребность в белке обычно получают по графику Альмквиста. Считается, что эти различия в очевидной потребности в белке связаны с различиями в методах культивирования и составе рациона.
Относительно высокий уровень белка в рационе, необходимый для максимального роста некоторых рыб, таких как белый амур, Ctenopharyngodon idella, и Brycon spp. Удивительны тем, что эти рыбы всеядны. Brycon spp.выращиваются на нежелательных фруктах и другом растительном материале с низким содержанием белка, и в этих условиях, по-видимому, существенный вклад в потребление ими белка вносит естественная пищевая цепь.
Потребность в белке эвриталиновых рыб, таких как радужная форель, Salmo gairdneri, и кижуч, Oncorhynchus kisutch, , выращенных в воде с соленостью 20 ppt, примерно такая же, как потребность в пресной воде. Нет данных о потребности этих видов в белке в морской воде с полной концентрацией.(35 п.
4.1 Essential и заменимые аминокислоты
4.2 Незаменимые Аминокислоты и качество протеина
Аминокислоты являются строительными блоками белков; около 23 аминокислот были выделены из природных белков. Десять из них незаменимы для рыб. Животное не способно синтезировать незаменимые аминокислоты и поэтому должно получать их с пищей.
4.1 Незаменимые и заменимые аминокислоты
Корм для лосося, форели и канального сома, лишенный аргинина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, треонина, триптофана или валина, не рос (рис.3). Те же самые рыбы, которых кормили рационами, лишенными других L-аминокислот, росли так же, как и рыбы, получавшие все 18 протестированных аминокислот (рис. 4). Азотный компонент в тестируемых диетах состоял из 18 L-аминокислот по образцу цельного яичного белка. Вся тестируемая рыба быстро выздоравливала, когда в рационе была заменена недостающая аминокислота. Наклон кривой роста в группе восстановления был идентичен таковому у рыб, получавших полный тест на аминокислотный рацион.
4). Азотный компонент в тестируемых диетах состоял из 18 L-аминокислот по образцу цельного яичного белка. Вся тестируемая рыба быстро выздоравливала, когда в рационе была заменена недостающая аминокислота. Наклон кривой роста в группе восстановления был идентичен таковому у рыб, получавших полный тест на аминокислотный рацион.
Испытывали незаменимые аминокислоты: аланин, аспарагиновая кислота, цистин, глутаминовая кислота, глицин, пролин, серин и тирозин.Было обнаружено, что эти аминокислоты не являются необходимыми для роста лосося, форели и канального сома.
В количественных исследованиях потребности в 10 незаменимых аминокислотах использовалась смесь казеина и желатина с добавлением кристаллических L-аминокислот. Тестируемая диета содержала 40 процентов цельного яичного белка для азотного компонента. Эксперименты, проведенные с карпом и угрем, показали аналогичное отсутствие роста, когда в рационе отсутствовала незаменимая аминокислота.
Рис. 3. Рост рыб с дефицитом аргинина. Группа с дефицитом была разделена через шесть недель на диете с дефицитом, и недостающая аминокислота была заменена в одной из двух частей.
Рис. 4. Рост рыб с дефицитом цистина.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr., 65: 589-99)
4.2 Основные аминокислоты и качество белка
Если известны потребности рыбы в незаменимых аминокислотах, должно быть возможно удовлетворить эти потребности в системах культивирования различными способами за счет различных пищевых белков или комбинаций пищевых белков.
Фенилаланин избавлен от тирозина. Неизвестно, что он химически модифицируется или становится недоступным из-за суровых условий, которым обычно подвергаются кормовые белки во время обработки. Измерение фенилаланина в белках несложно, поэтому обеспечение и оценка фенилаланина в белках в практических диетах не представляет особых трудностей.
Лизин — основная аминокислота. В дополнение к -аминокислотной группе, обычно связанной пептидной связью, он также содержит вторую, -аминогруппу.Эта альфа-аминогруппа должна быть свободной и реакционной, иначе лизин, хотя и поддается химическому измерению, не будет доступен биологически. Во время обработки белков корма α-аминогруппа лизина может реагировать с небелковыми молекулами, присутствующими в корме, с образованием дополнительных соединений, которые делают лизин биологически недоступным.
Цистин избавлен от метионина. Однако измерить содержание метионина в кормовых белках непросто, поскольку аминокислота подвержена окислению во время обработки.После обработки метионин может присутствовать как таковой, или как сульфоксид, или как сульфон. Сульфоксид может образовываться из метионина во время кислотного гидролиза кормового белка перед измерением его кислотного состава, не содержащего кислоты. Кислотный гидролиз белков перед анализом нарушает исходное равновесие между двумя соединениями, так что состав гидролизата больше не отражает состав белка. При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.Однако в случае кормовых белков это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до его окисления и гидролиза.
Сульфоксид метионина может иметь некоторую биологическую ценность для рыб, которые могут иметь некоторую способность обратного преобразования его в метионин и, таким образом, частично восполнять часть метионина, окисленного во время обработки.
Недавно появились сообщения о методах измерения метионина в белках с использованием йодоплатинатного реагента до и после восстановления трихлоридом титана, чтобы получить значения как для метионина, так и для сульфоксида в исходном белке.Также был описан способ измерения метионина, в частности, с помощью расщепления цианогенбромидом. Оба метода еще предстоит оценить независимо. Микробиологический анализ метионина в белках кормов является ценным инструментом, хотя существует опасность того, что оксиды метионина могут различаться по своей активности в отношении микроорганизмов и искажать значения.
Количественные потребности лососевых в десяти незаменимых аминокислотах определялись путем кормления линейными приращениями одной аминокислоты за раз в тестируемой диете, содержащей аминокислотный профиль, идентичный цельному яичному белку, за исключением тестируемой аминокислоты.Повторяющиеся группы рыб подвергались диетическому лечению до тех пор, пока не появились большие различия в росте опытных партий. График реакции роста Альмквиста показывает уровень аминокислот, необходимый для максимального роста в этих конкретных условиях испытания. Рационы были разработаны таким образом, чтобы содержать белок на уровне или немного ниже оптимальной потребности в белке для этого вида и условий тестирования, чтобы гарантировать максимальное использование ограничивающей аминокислоты. Сравнение требований к десяти незаменимым аминокислотам между видами показано в таблице 2.
Недавним нововведением стало использование в тестовых диетах белков, относительно дефицитных по данной незаменимой аминокислоте. Таким образом, комбинации рыбной муки и зеина использовались в тестовых диетах для определения потребности радужной форели в аргинине. Рационы, содержащие различные относительные количества казеина и желатина, показали, что увеличение уровня связанного с белками аргинина с 11 до 17 г / кг привело к значительному увеличению роста канального сома.
Таблица 2 Потребность семи животных в аминокислотах 1/
Аминокислота | Молодь угря | Мальки карпа | Канальный сом | Молодь чавычи | Цыпленок | Молодой поросенок | Крыса |
Аргинин | 3.9 (1,7 / 42) | 4,3 (1,65 / 38,5) | 6,0 (2,4 / 40) | 6,1 (1,1 / 18) | 1,5 (0,2 / 13) | 1,0 (0,2 / 19) | |
Гистидин | 1,9 (0,8 / 42) | 1,8 (0,7 / 40) | 1,7 (0,3 / 18) | 1.5 (0,2 / 13) | 2,1 (0,4 / 19) | ||
Изолейцин | 3,6 (1,5 / 42) | 2,6 (1,0 / 38,5) | 2,2 (0,9 / 41) | 4,4 (0,8 / 18) | 4,6 (0,6 / 13) | 3,9 (0,5 / 13) | |
лейцин | 4.1 (1,7 / 42) | 3,9 (1,5 / 38,5) | 3,9 (1,6 / 41) | 6,7 (1,2 / 18) | 4,6 (0,6 / 13) | 4,5 (0,9 / 19) | |
Лизин | 4,8 (2,0 / 42) | 5,1 (1,23 / 24,0) | 5,0 (2,0 / 40) | 6.1 (1.1 / 18) | 4,7 (0,65 / 13) | 5,4 (1,0 / 19) | |
метионин 2/ | 4,5 (2,1 / 42) 3/ | 3,1 (1,2 / 38,5) | 2,3 (0,56 / 24,0) | 4,0 (1,6 / 40) 3/ | 4.4 (0,8 / 18) | 3,0 (0,6 / 20) | 3,0 (0,6 / 20) |
Фенилаланин 4/ | 5,1 (2,1 / 41) 5/ | 7,2 (1,3 / 18) | 3.6 (0,45 / 13) | 5,3 (0,9 / 17) | |||
Треонин | 3,6 (1,5 / 42) | 2,2 (0,9 / 40) | 3,3 (0,6 / 18) | 3,0 (0,4 / 13) | 3,1 (0,2 / 19) | ||
Триптофан | 1,0 (0,4 / 42) | 0.5 (0,2 / 40) | 1,1 (0,2 / 18) | 0,8 (0,2 / 25) | 1,0 (0,2 / 19) | ||
Валин | 3,6 (1,5 / 42) | 3,2 (1,3 / 40) | 4,4 (0,8 / 18) | 3,1 (0,4 / 13) | 3,1 (0,4 / 13) |
1/ Выражается в процентах от диетического белка.В скобках числители — это потребности в процентах от сухой диеты, а знаменатели — это процент от общего количества белка в рационе.2/ При отсутствии цистина
3/ Метионин плюс цистин
4/ При отсутствии tyro sine
5/ Фенилаланин плюс тирозин
(по материалам: Национальный исследовательский совет, 1977 г.)
Потребность радужной форели в аргинине была определена по стандартной кривой доза / реакция (рост), а также путем измерения уровней свободного аргинина в тканях (крови и мышцах) в группах форели, получавших возрастающее количество аргинина в рационе.После того, как диетическая потребность форели в аргинине была удовлетворена, любое дальнейшее увеличение потребления аргинина привело к увеличению концентрации свободного аргинина в крови и мышцах. Было получено хорошее согласие между двумя методами.
Данные, приведенные в таблице 2, предполагают, что между видами рыб существуют реальные различия в их потребностях в определенных аминокислотах. Это приводит к трудностям при составлении белкового компонента практического рациона для тех видов, потребности которых в аминокислотах еще не известны.Возможное решение — использовать для каждой аминокислоты наивысший уровень, необходимый для любого из тех видов, по которым имеются данные. Необходимость дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые действительно или потенциально могут использоваться в качестве сельскохозяйственных животных, очевидна.
Одним из решений использования белков, относительно дефицитных по одной или нескольким аминокислотам, является добавление к белку соответствующих количеств аминокислоты, необходимых в практических диетах. Рыба, по-видимому, использует свободные аминокислоты с разной степенью эффективности.
Молодой карп, Cyprinus carpio, оказался неспособен расти на диетах, в которых белковый компонент (казеин, желатин) был заменен смесью аминокислот, аналогичных по общему составу. Гидролизат трипсина казеина также оказался неэффективным. Однако, если диета, содержащая свободные аминокислоты в качестве белкового компонента, тщательно нейтрализуется NaOH до pH 6,5-6,7, то некоторый рост молоди карпа действительно происходит. Этот рост был заметно ниже, чем при сопоставимой казеиновой диете в тех же условиях.
Канальный сом также не может использовать свободные аминокислоты в качестве добавки к дефицитным белкам. Когда соевый шрот был заменен изоназотом на муку менхадена, рост и эффективность корма канального сома были значительно снижены. Добавление свободного метионина, цистина или лизина, наиболее ограничивающих аминокислот, к этим заменителям сои не привело к увеличению веса.
Повышение уровня аргинина в рационе сома с 11 до 17 г / кг путем изонитрогенной замены желатина на казеин значительно увеличивало набор веса, но добавление свободного аргинина, цистина, триптофана или метионина к казеину мало влияло на рост или преобразование пищи.
Лососевые могут использовать свободные аминокислоты для роста. Было показано, что зеин-желатиновая диета с добавлением лизина и тритофана заметно превосходит зеин-желатиновую диету для радужной форели, когда в качестве критериев использовались прибавка в весе и использование белка.
Несколько исследователей продемонстрировали возможность дополнения белков с дефицитом аминокислот ограничивающими аминокислотами в рационах лососевых. Казеин с добавлением шести аминокислот давал коэффициенты конверсии корма для атлантического лосося, аналогичные тем, которые были получены при использовании изолированного рыбного белка в качестве источника пищевого белка.Соевый шрот с добавлением пяти или более аминокислот (включая метионин и лизин) был лучшим источником белка для радужной форели по сравнению с одним соевым шротом. Однако однократное добавление метионина и лизина не привело к повышению ценности соевого шрота. Эти результаты позволяют предположить, что аминокислотный спектр выделенного рыбьего белка, который они использовали, может приблизительно соответствовать потребности в аминокислотах радужной форели. Пищевая ценность изолята соевого белка может быть увеличена путем добавления в него первой ограничивающей аминокислоты; я.е., метионин.
Рационы, содержащие в качестве белкового компонента рыбную муку, мясо-костную муку, а также дрожжевую и соевую муку, можно улучшить путем одновременного добавления цистина (10 г / кг) и триптофана (5 г / кг). Рыбную муку можно полностью заменить без снижения конверсии корма в рационах для радужной форели смесью из субпродуктов домашней птицы и перьевой муки вместе с 17 г лизина HCL / кг, 4,8 г DL-метионина / кг и 1,44 г DL. -триптофан / кг.
Коуи, К.Б. и Дж. Р. Сардженты, 1972 Кормление рыб. Adv.Mar.Biol., 10: 383-492
Коуи, С.Б., 1979 Потребности рыб в белках и аминокислотах. В Технология кормления и кормления рыб, под редакцией Дж. Э. Халвера и К. Тьюса. Материалы Всемирного симпозиума, спонсируемого EIFAC / FAO, ICES и IUNS, Гамбург, 20-23 июня 1978 г. Schr . Bundesforschungsanst . Fisch ., Hamb ., (14/15) vol. 1: 3-16
Мерц, Э.Т., 1972 г. Потребности в белке и аминокислотах. В Питание рыб, под редакцией Дж. Э. Халвера. Нью-Йорк, Academic Press, стр. 106-43.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 года, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук (Потребность домашних животных в питательных веществах) 78 стр.
аминокислот: структура, классификация и функции
Шариковая модель глутамата аминокислоты.Callista Images / Источник изображения / Getty Images
Аминокислоты — это органические молекулы, которые при соединении с другими аминокислотами образуют белок. Аминокислоты необходимы для жизни, поскольку образующиеся ими белки участвуют практически во всех функциях клетки. Некоторые белки действуют как ферменты, некоторые — как антитела, а другие обеспечивают структурную поддержку. Хотя в природе встречаются сотни аминокислот, белки состоят из набора из 20 аминокислот.
Ключевые выводы
- Почти все функции клетки связаны с белками.Эти белки состоят из органических молекул, называемых аминокислотами.
- Хотя в природе существует множество различных аминокислот, наши белки состоят из двадцати аминокислот.
- Со структурной точки зрения аминокислоты обычно состоят из атома углерода, атома водорода, карбоксильной группы, а также аминогруппы и вариабельной группы.
- На основе вариабельной группы аминокислоты можно разделить на четыре категории: неполярные, полярные, отрицательно заряженные и положительно заряженные.
- Из набора из двадцати аминокислот одиннадцать могут вырабатываться организмом естественным образом и называются заменимыми аминокислотами. Аминокислоты, которые организм не может вырабатывать естественным путем, называются незаменимыми аминокислотами.
Строение
Основная аминокислотная структура: альфа-углерод, атом водорода, карбоксильная группа, аминогруппа, группа «R» (боковая цепь). Ясин Мрабет / Wikimedia CommonsОбычно аминокислоты обладают следующими структурными свойствами:
- Углерод (альфа-углерод)
- Атом водорода (H)
- Карбоксильная группа (-COOH)
- Аминогруппа (-NH 2 )
- «переменная» группа или группа «R»
Все аминокислоты имеют альфа-углерод, связанный с атомом водорода, карбоксильной группой и аминогруппой.Группа «R» варьируется среди аминокислот и определяет различия между этими мономерами белка. Аминокислотная последовательность белка определяется информацией, содержащейся в клеточном генетическом коде. Генетический код — это последовательность нуклеотидных оснований в нуклеиновых кислотах (ДНК и РНК), которые кодируют аминокислоты. Эти генные коды не только определяют порядок аминокислот в белке, но также определяют структуру и функцию белка.
Аминокислотные группы
Аминокислоты можно разделить на четыре основные группы на основании свойств группы «R» в каждой аминокислоте.Аминокислоты могут быть полярными, неполярными, положительно заряженными или отрицательно заряженными. Полярные аминокислоты имеют группы «R», которые являются гидрофильными, что означает, что они стремятся контактировать с водными растворами. Неполярные аминокислоты противоположны (гидрофобны) в том смысле, что они избегают контакта с жидкостью. Эти взаимодействия играют важную роль в сворачивании белков и придают белкам их трехмерную структуру. Ниже приведен список из 20 аминокислот, сгруппированных по их свойствам группы «R». Неполярные аминокислоты гидрофобны, а остальные группы гидрофильны.
Неполярные аминокислоты
- Ala: Аланин Gly: Глицин Ile: Изолейцин Leu: Лейцин
- Met: Метионин Trp: Триптофан Phe: Фенилаланин Pro: Пролин Валин
Полярные аминокислоты
- Cys: Цистеин Ser: Серин Thr: Треонин
- Tyr: Тирозин Asn: Аспарагин Gln: Глютамин
Основные полярные аминокислоты (положительно заряженные)
- His: Гистидин Lys: Лизин Arg: Аргинин
Полярные кислотные аминокислоты (отрицательно заряженные)
- Asp: Аспартат Glu: Глутамат
Хотя аминокислоты необходимы для жизни, не все они могут вырабатываться в организме естественным путем.Из 20 аминокислот 11 могут быть произведены естественным путем. Эти заменимые аминокислоты представляют собой аланин, аргинин, аспарагин, аспартат, цистеин, глутамат, глутамин, глицин, пролин, серин и тирозин. Заменимые аминокислоты, за исключением тирозина, синтезируются из продуктов или промежуточных продуктов важнейших метаболических путей. Например, аланин и аспартат получают из веществ, вырабатываемых во время клеточного дыхания. Аланин синтезируется из пирувата, продукта гликолиза.Аспартат синтезируется из оксалоацетата, промежуточного продукта цикла лимонной кислоты. Шесть незаменимых аминокислот (аргинин, цистеин, глутамин, глицин, пролин и тирозин) считаются условно незаменимыми , поскольку пищевые добавки могут потребоваться во время болезни или у детей. Аминокислоты, которые не могут быть произведены естественным путем, называются незаменимыми аминокислотами . Это гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.Незаменимые аминокислоты необходимо получать с пищей. Общие пищевые источники этих аминокислот включают яйца, соевый белок и сиг. В отличие от человека растения способны синтезировать все 20 аминокислот.
Аминокислоты и синтез белка
Просвечивающая электронная микрофотография ДНК (розовая). Во время транскрипции нити мРНК (зеленые) синтезируются и транслируются рибосомами (синие).ДР ЕЛЕНА КИСЕЛЕВА / Getty Images
Белки производятся в процессе транскрипции и трансляции ДНК.При синтезе белка ДНК сначала транскрибируется или копируется в РНК. Полученный транскрипт РНК или информационная РНК (мРНК) затем транслируется с образованием аминокислот из транскрибированного генетического кода. Органеллы, называемые рибосомами, и другая молекула РНК, называемая транспортной РНК, помогают транслировать мРНК. Полученные аминокислоты соединяются вместе посредством синтеза дегидратации, процесса, в котором между аминокислотами образуется пептидная связь. Полипептидная цепь образуется, когда ряд аминокислот связаны пептидными связями.После нескольких модификаций полипептидная цепь становится полностью функционирующим белком. Одна или несколько полипептидных цепей, скрученных в трехмерную структуру, образуют белок.
Биологические полимеры
Хотя аминокислоты и белки играют важную роль в выживании живых организмов, существуют другие биологические полимеры, которые также необходимы для нормального биологического функционирования. Наряду с белками, углеводы, липиды и нуклеиновые кислоты составляют четыре основных класса органических соединений в живых клетках.
Источники
- Рис, Джейн Б. и Нил А. Кэмпбелл. Кэмпбелл Биология . Бенджамин Каммингс, 2011.


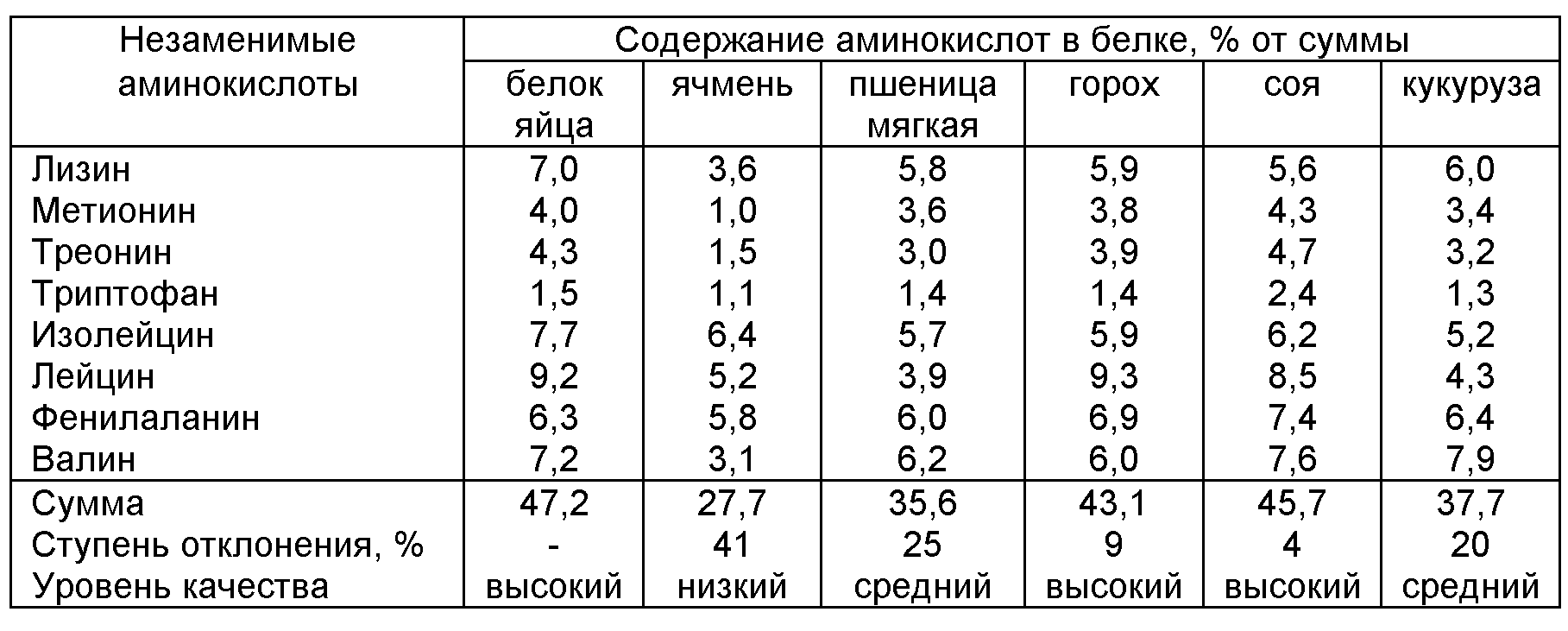
 Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
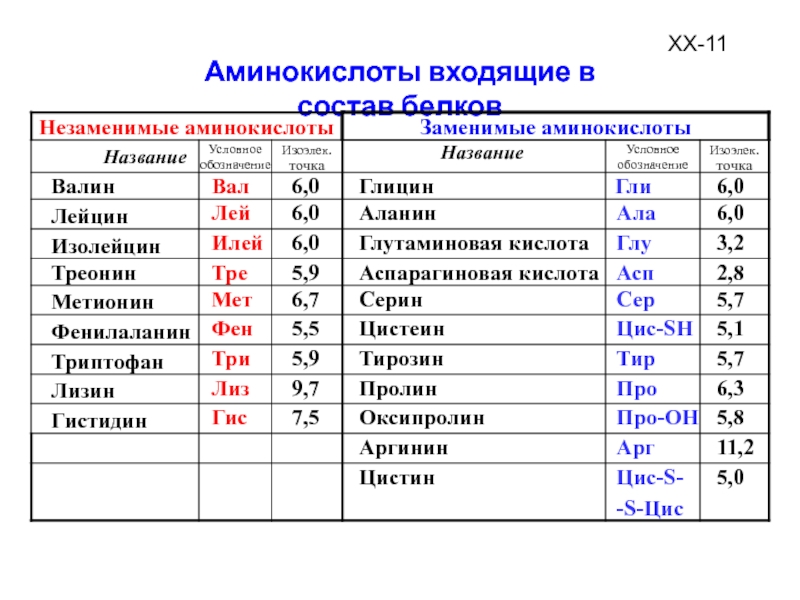
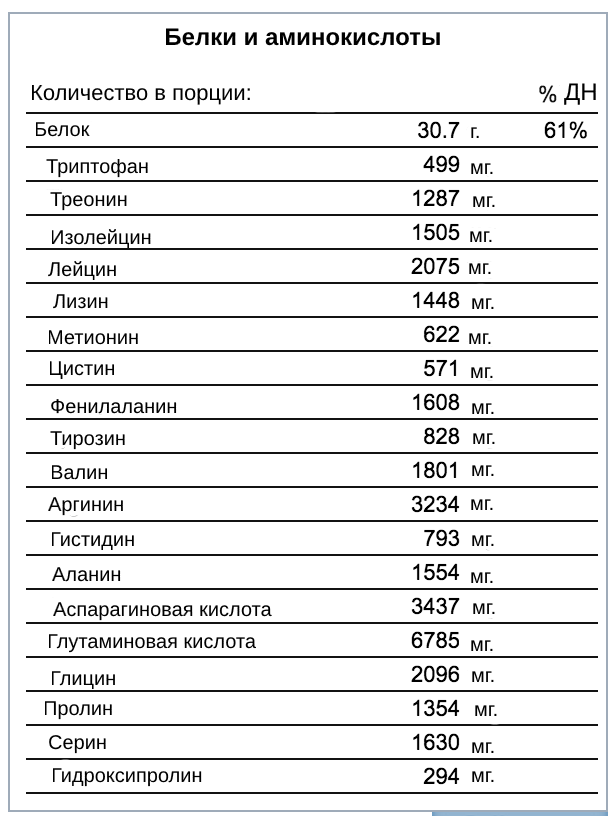

 Тайная формула Бога: расшифровка загадки Вселенной и простое число. Код . Shaftesbury: Element Books, 1997. ISBN 1862040141.
Тайная формула Бога: расшифровка загадки Вселенной и простое число. Код . Shaftesbury: Element Books, 1997. ISBN 1862040141. ДОБАВКА
ДИЕТЫ С АМИНОКИСЛОТАМИ
ДОБАВКА
ДИЕТЫ С АМИНОКИСЛОТАМИ 
